Dr A.Gironés Muriel. H. Sanitas La Moraleja.
Dr. Angel Villar-Pellit. H Virgen de la victoria.
Introducción
Desde la irrupción en nuestro arsenal terapéutico de los nuevos anestésicos enantiómeros, depurados en su forma levógira (levobupivacaína y ropivacaína). Son múltiples los estudios clínicos derivados de su uso, encontrando con demasiada frecuencia divergencias en sus resultados, de tal manera que el estudio de los anestésicos locales en base exclusivamente a dichos estudios clínicos puede resultar insuficiente e incluso puede llevarnos a confusión.
Como anestesiólogos tenemos la obligación de un conocimiento profundo de los anestésicos locales, que son uno de los pilares de nuestra especialidad, y el deber de promulgar entre las nuevas generaciones de anestesiólogos su dominio, tanto a nivel práctico como a nivel teórico. Un conocimiento basado en conceptos bioquímicos y farmacológicos, de tal manera, que podamos tener una sana visión crítica frente a diversas afirmaciones que otros investigadores pudieran tener al respecto. Por ello pensamos que una revisión exhaustiva de la forma de actuar de estos fármacos será la plataforma en la que lanzar nuevos interrogantes y posicionarnos con criterio.
La primera pregunta que debemos hacernos es; ¿Como actúan los anestésicos locales?, a la que contestaremos de una manera general, que mediante la supresión del estimulo nervioso a través del bloqueo de la membrana excitable de la célula nerviosa.
Pero el quedarnos en la superficie de la respuesta nos impedirá poder vislumbrar el futuro de estos fármacos tan usados en nuestra profesión. El conocer más íntimamente su forma de actuar y las teorías que hay al respecto nos aportará una base crítica y nos condicionará en la manera de enfrentarnos, no solo a estos dos enantiómeros (Levobupivacaína y Ropivacaína ), sino a las nuevas moléculas que se están estudiando actualmente y que de salir al mercado supondrán una revolución. Esto nos obliga al estudio más profundo de la forma de bloquear dicho estímulo y a preguntarnos si todos los anestésicos locales actúan de la misma manera.
El estímulo nervioso
El estimulo nervioso, de origen químico, mecánico o de temperatura genera un impulso que viaja a través de la fibra nerviosa. Este debe propagarse de manera constante con independencia de si el estímulo inicial persiste o varía, y eso solo es posible porque el impulso viaja gracias a la propia energía liberada en la fibra nerviosa.
La evolución ha creado un ingenioso sistema de comunicación en la que no importa la distancia recorrida. Dicho impulso llegará de la misma manera e intensidad tanto si el estimulo se localiza a metros de la zona de control como a escasos centímetros. El artífice de esto es la propia fibra nerviosa que es capaz de aportar la energía necesaria para perpetuar este impulso y propagarlo indefinidamente. Objetivamente dicho impulso no es más que un potencial eléctrico, una diferencia de energía lograda mediante una permeabilidad selectiva de la célula nerviosa respecto a ciertos iones. Esta permeabilidad selectiva consigue generar una diferencia de potencial eléctrico de 60 a 90 mv. en su interior respecto al espacio extracelular. Un potencial que puede variarse y propagase unidireccionalmente por toda su membrana con independencia de su longitud, de una manera autónoma y sin merma de su intensidad.
Por todo ello diremos que la membrana nerviosa ha evolucionado hasta convertirse en una membrana semipermeable con carga negativa en su interior. Dicha carga se logra al comportarse en estado de reposo de una manera diferente para los distintos iones, siendo los más implicados en la transmisión nerviosa el potasio y el sodio (K+ y el NA+).
– La membrana nerviosa es permeable al K+2 Esto genera una fuerza pasiva que impulsa a igualar las concentraciones de dicho ion tanto a nivel intracitoplasmático como fuera de la membrana . Sin embargo, ante esta acción pasiva existe la bomba de Na+2/k+ que trabaja para introducir iones de k+2 en el interior y sacar iones de Na+ hacia el exterior celular. Del mismo modo, la carga electronegativa en reposo del interior de la propia membrana ejerce una atracción electroestática que impide una migración pasiva a favor de gradiente de este ion.
Tenemos por tanto un «exceso» de iones de K+ en el interior axoplásmico, un K+ que pugna por salir al exterior e igualar concentraciones.
– La membrana además es solo parcialmente permeable al Na+ e impide una entrada masiva de estos iones al interior celular. Esta entrada esta impulsada tanto por un favorable gradiente de concentración (difundirían al espacio intracelular donde su concentración es mucho menor) como por el gradiente electroestático de la membrana (pues como iones positivos serian atraídos por la carga negativa intracitoplasmática al interior).
Tenemos así un déficit de Na+ intracitoplasmático que genera una “ tensión iónica“ de moléculas de sodio que pugnan por entrar al interior de la fibra nerviosa.
Cuando se permite el paso masivo de iones cargados positivamente se produce un cambio de potencial eléctrico, el cual se produce no a través de la membrana (que como hemos visto se comporta de una manera semipermeable), si no a través de unos canales que atraviesan dicha membrana; los llamados canales iónicos o ionoforos.
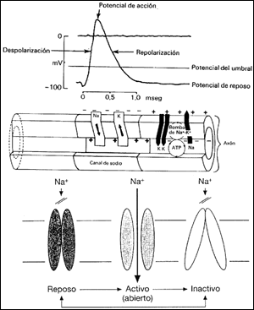
Son estos canales iónicos que atraviesan dicha membrana, la puerta de entrada masiva de iones (en este caso con carga positiva al interior celular),dejando pasar de 107-108 iones/msg, una velocidad 1000 veces mayor de la que sería capaz cualquier proteína transportadora. Los canales iónicos son por tanto, una veloz puerta regulable que origina lo que llamamos la despolarización de la membrana. Esta despolarización se define por la entrada masiva de estos iones de Na cargados positivamente originando un cambio en la polaridad interior de la membrana (de unos -70 mv a unos +10 mv). Dicho cambio electroquímico es capaz de transmitirse periféricamente hasta llegar al siguiente canal iónico cuya apertura provocará también un cambió de polaridad en su periferia lo que hará avanzar dicho fenómeno de manera autónoma.
Los canales iónicos
Hemos explicado que son estas puertas también llamadas “ pasos transmembránicos“ las vías que permiten la entrada de iones al interior de la fibra nerviosa .Sin embargo existen variedad de estas puertas o ionoforos en distintos tipos de células y su estudio es el que nos permitirá obtener mejores anestésicos locales con menor toxicidad y mayor especifidad de acción. Hoy en día sabemos que hay innumerables tejidos excitables en el cuerpo humano y la regulación de su impulso depende generalmente de un flujo de cargas entre el exterior y el interior celular. Dicha regulación se realiza a través de diferentes tipos de canales cuyo tipo y distribución dependen del tipo de célula implicada y su función.
Una manera de clasificar estos canales se puede hacer en base a su modo de activación, de tal manera que nos encontraríamos con:
– Unos Canales regulados por ligandos o neurotransmisores. Estos canales iónicos se abren por un cambio de su estructura, un cambio basado principalmente en la fosforilación o desfosforilación de una proteína que conforma su estructura al unirse a otra proteína. Estos son, por ejemplo, los receptores metabotrópicos, de neuropéptidos, glutamato , GABA, etc.
– Los canales regulados por voltaje: Estos canales alteran su conformación al variar la carga eléctrica en su entorno; Son los canales de sodio, de potasio, de calcio y de cloro, siendo los principales implicados en la transmisión nerviosa de impulsos. Dentro de ellos existen varios subtipos que se distribuyen de diferente forma según la función celular encomendada por el organismo, de tal manera, que su estudio será importante para comprender los diferentes mecanismos de acción de los anestésicos locales y con vistas a lograr el anestésico local ideal para nuestra actividad asistencial.
Canales de Na+ voltaje dependientes
En realidad estos canales o ionoforos son unas lipoproteínas con un poro acuoso selectivo a ciertos iones.
La selectividad del canal de sodio se consigue por dos mecanismos fundamentales: por una parte porque tiene un grupo carboxilato negativo que origina una selectividad electromolecular a determinadas sustancias y por otro lado porque el poro es estrecho. El diámetro de paso en el interior de estos canales es tal que iones como el K+ o el Na+ con una hidratación mayor de 5 A. tienen una facilidad de paso 11 veces menor que para los iónes de Na+ poco hidratados que son de pequeño tamaño.
En cambio los canales de K+ presentan una facilidad de paso 100 veces mayor para el K+ que para el Na+ y su selectividad se presenta principalmente por la disposición de sus átomos de oxigeno. Unos átomos que impiden un buen acoplamiento para la deshidratación del Na+ , condición necesaria para disminuir su diámetro y permitir el paso secuencial de la molécula.
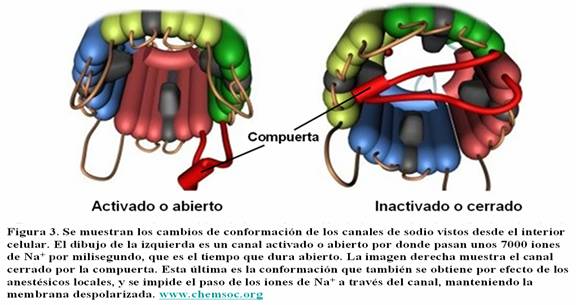
El canal de sodio basa por tanto su mecanismo de acción en el pequeño diámetro interior que impide el paso de iones. Por ello es necesario un cambio de configuración estructural en ese canal para que se haga más ancho y permita el flujo libre de esos iones al interior celular. Este cambio ocurre cuando el estímulo electroquímico llega a la zona de la membrana donde se encuentra dicho canal originando su apertura y la consiguiente entrada masiva de iones de Na+ . Este proceso origina a su vez un cambio de electronegatividad en el interior de la membrana alrrededor del canal, alcanzando el siguiente canal iónico y perpetuando el impulso nervioso.
Además el canal iónico tiene una capacidad de inhibición intrínseca que impide la nueva apertura del canal hasta pasado un tiempo tras su activación, esta característica es la causa por la cual la corriente del impulso viaja solo en una dirección e impide que el cambio de negatividad o la despolarización intraaxoplasmica viaje hacia atrás. Dicho de otro modo, el cambio de polaridad se distribuye en ambas direcciones a partir del canal iónico pero solo puede activar a aquel canal iónico que se encuentra en la dirección correcta ya que el anterior se encuentra en periodo refractario.
Por tanto, los canales de sodio presentan tres configuraciones; la abierta (O) que coincide con el periodo de despolarización, una configuración inactiva (I) que coincide con el periodo refractario en la cual no se puede abrir de nuevo el canal, y una fase de reposo (C).
Estructura molecular
A nivel molecular los canales de Na+ consisten en tres subunidades (alfa1, beta1, y beta2), siendo la mas grande la subunidad alfa que a su vez consta de una estructura peptídica conformada por cuatro subregiones hidrofóbicas o dominios (dominios de I a IV).
Dichos dominios se disponen alrededor del poro y están interconectados entre sí por unos puentes intracelulares de tal manera que cruzando la membrana celular forman las paredes del canal o ionoforo propiamente dicho.
Los investigadores nos han dado a su vez la estructura de estas subregiones o dominios que se conforman cada una como seis segmentos transmembranas (llamados de S1 a S6).
El segmento S4 es el sensor de voltaje propiamente dicho, mientras que el puente que existe entre el segmento 5 y el segmento 6 configura el revestimiento del poro exterior, a su vez el puente que existe entre el dominio III y el IV es la llamada puerta de inactivación.
La importancia de dicha investigación radica en averiguar cual es la cadena peptídica encargada de unirse a las moléculas que configuran los anestésicos y conocer como es su función dentro del mecanismo de apertura y cierre del canal, para de este modo poder abrir nuevas vías de investigación con nuevas moléculas, y ofrecernos nuevos anestésicos locales.
Los canales de K+ son en cambio estructuras muy heterogéneas de membranas proteicas. Algunos responden a neurotransmisores, a la unión con el Ca+ o el ATP otros son también voltaje dependientes con un segmento S4 muy similar al de los canales de Na+ voltaje dependiente.
La similitud estructural de alguno de estos canales puede explicar los efectos que originan a nivel cardiaco los anestésicos locales y por añadidura su toxicidad, efecto que es más llamativo con la bupivacaina cuya afinidad a los canales de K+ y su afectación de la contracción cardiaca especialmente en diástole es bien conocida.
Esta mayor afinidad o mayor toxicidad cardiaca de la bupivacaina racémica parece estar mediada por la adhesión de una proteína a este anestésico, originando una estructura molecular con un pobre coeficiente de disociación fármaco -receptor, esto crea por tanto un bloqueo de larga duración a nivel fármaco-receptor en estos canales situados en el músculo cardiaco con las consecuencias para la contractibilidad cardiaca que todo anestesiólogo conoce así como las dificultades para revertirlas una vez que se han instaurado.
Cómo actúan los Anestésicos Locales
Como dijimos al principio, los anestésicos locales actúan interfiriendo esa conducción nerviosa pero… ¿a que nivel?, ¿actúan solo a nivel de los canales de sodio?, ¿por qué de su toxicidad?
Estas preguntas se han intentado responder no solo para valorar su mecanismo de acción sino para encontrar nuevas vías de investigación con el fin de descubrir nuevos productos, exponemos la teoría más aceptada actualmente y que es capaz de dar respuesta a la mayoría de las preguntas que podemos hacernos sobre el mecanismo de acción de los anestésicos locales.
Teoría de los receptores específicos
Según esta teoría que parte de los estudios de Takman de 1975 y que varios autores avalan se afirma que existen varios receptores específicos para la acción de sustancias que actuarían como anestésicos locales tanto a nivel extracitoplasmático como intracitoplasmático, de tal manera que se puede obtener una clasificación de sustancias anestésicas según el lugar de acción:
– Tipo A: Cuya acción se localiza en el exterior de la membrana, a nivel de los canales iónicos. En este nivel se encontrarían ciertas biotoxinas como la tetrodoxina y la saxitoxina.
– Tipo B: Cuya acción se localiza en el interior de la membrana nerviosa como serían los análogos de la lidocaína y ciertos venenos de escorpión.
– Tipo C: Con una acción independiente del receptor. Como es la benzocaína cuya acción parece expresarse en la propia membrana citoplasmatica alterando su configuración y por consiguiente alterando la configuración de los ionoforos por alteracion de la membrana adyacente.
– Tipo D: Que serían las sustancias que actuarían tanto a nivel de un receptor como mecanismos independientes en base a su dualidad como sustancia catiónica o como base sin carga. A este tipo pertenecen la mayoría de los anestésicos con utilidad clínica de la actualidad.
Los investigadores afirman los anestésicos locales dependiendo de su clasificación ejercen su acción anestésica en base al bloqueo de una u otra manera del canal de sodio voltaje dependiente, que son los canales más frecuentes en las membranas de los axones.
Una premisa fundamental es que los anestésicos de uso clínico en la actualidad son del tipo D y deben penetrar hasta su lugar de acción en el canal iónico desde su polo interior, lo cual condiciona una serie de implicaciones interesantes.
Estos anestésicos locales, parecen actuar de una manera no específica interactuando con la fenilalanina y la tirosina en el segmento (S6) del dominio IV. Que se encuentra aproximadamente a un tercio de la distancia total del canal o ionoforo.
Los anestésicos locales de uso común parecen también influir en otro tipo de canales iónicos (de Ca+ y de K+ principalmente) aunque la menor afinidad de estos canales a la conformación molecular de los anestésicos explica que se necesiten mayores concentraciones de fármaco para bloquearlos, tampoco hay que olvidar que se han visto varios tipos de canales de Na+ (hasta 9 tipos se han anunciado) cada uno con pequeñas variaciones en su estructura. Por tanto el lógico pensar que la afinidad electroestática entre la cadena aminoácida del canal iónico y la molécula del anestésico puede variar según sea el tipo de canal iónico y según la molécula del anestésico, lo que condiciona las respuestas clínicas variables de cada tipo de anestésico.
Como hemos dicho al principio, los anestésicos usado actualmente deben penetrar primero al interior axoplásmico y desde allí llegar a su lugar especifico de acción, por tanto para que actúe el anestésico y exista bloqueo del canal es necesario que la puerta de activación localizada en polo intracitoplasmático debe estar abierta (estado activo;O ) esta es la principal razón que explica que los lugares donde el impulso nervioso es continuo, es decir, estructuras excitable donde la frecuencia de estimulación o de apertura/cierre del canal sea mayor es donde se producen los principales síntomas de toxicidad mediada por anestésicos.
Recordemos que la diferencia principal entre un efecto deseado con los anestésicos y un efecto tóxico es el lugar de acción donde bloqueamos el impulso nervioso.
El bloqueo del axón es lo buscado mientras que el bloqueo del impulso a nivel cardiaco o de sistema nervioso central condiciona los principales efectos deletéreos. El por qué de esta especifidad de acción se puede explicar por tanto porque el bloqueo fásico o uso dependiente necesita de una menor concentración de fármaco que la usada para bloquear el impulso de un nervio en reposo (o bloqueo tónico), por tanto los efectos tóxicos de estas moléculas cuando alcanzan el sistema vascular y se distribuyen por todo el organismo son más notables a nivel cardiaco o cerebral, que son tejidos con un nivel de excitabilidad permanente.
Todos estos avances siendo importantes no explican todos los interrogantes que se derivan del uso de estos fármacos. El estudio del axón del calamar, único axón encontrado en la naturaleza lo suficientemente grande para trabajar in vivo con él nos ha dado muchas respuestas pero todavía insuficientes para encontrar el anestésico ideal con mínima toxicidad y gran especificad de acción.
A la luz de los descubrimientos actuales parece quedar claro que los anestésicos locales usados actualmente actúan a nivel de estos canales de Na+ bloqueándolos desde el interior de la membrana. Esta apreciación es muy importante para su uso clínico puesto que implica que la molécula debe atravesar la membrana citoplasmática y actuar mientras el canal está abierto para llegar al interior del canal donde actuará. Por tanto buscaremos un fármaco que tenga facilidad de paso a través de estas membranas liposolubles, un fármaco que sea activo intracitoplasmaticamente y que permita una disociación adecuada del sitio de bloqueo, es decir, las propiedades bioquímicas y farmacológicas serán determinantes para adecuarse a un buen uso clínico en nuestros pacientes.
Anestésicos habituales iónicos
Hemos dicho que los anestésicos locales usualmente usados son los del tipo D, actuando a nivel de un receptor en base a su dualidad como sustancias ionizadas o no. Para ello estos fármacos se almacenan como bases débiles a un pH ácido necesario para hacerlos hidrosolubles y estables, y esto se logra generalmente mediante la agregación de HCl . Si no, tendríamos el compuesto liofilizado y tendríamos que disolverlo nosotros como otros fármacos antes de administrarlo al paciente con la incomodidad e inexactitud de la concentración dada.
Esta base hidrosoluble permanece estable a un pH entre 4.5 y 6,5 y puede estar incluso mas acidificada con la agregación de otros excipientes como en el caso de anestésicos que llevan adrenalina, puesto que el bisulfito de sodio que se añade para estabilizar dicha adrenalina y evitar su oxidación puede bajar su pH hasta 3.
Por ello decimos que los anestésicos habitualmente usados son fármacos que son estables a un pH bajo pero que necesitan alcanzar un pH más alto para poder ser efectivos.
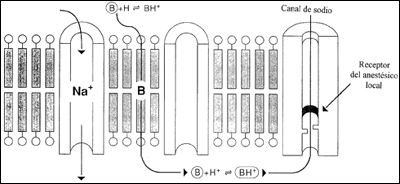
Pues bien, una vez inyectado el anestésico en el fluido extracelular (con ese característico dolor a la infiltración por el pH ácido que presenta) este sufre una reacciones bioquímicas para presentarse en sus dos formas, la iónica y la no iónica con cualidades totalmente contrapuestas tanto a nivel de liposolubilidad y por tanto de facilidad de paso a través de membranas , como a nivel de actividad intrínseca de bloqueo de canales iónicos.
BHCL=BH+ + CL–
BH+ + HC03 = B + H20 +C02
Observamos que existe una forma ionizada (BH+) activa, hidrosoluble y por tanto poco liposoluble que es la que se presenta mayoritariamente a un pH bajo , y una forma no ionizada (B) no activa pero liposoluble y por tanto la fracción capaz de atravesar membranas citoplasmáticas. El anestésico debe convertirse por tanto primero en una forma no ionizada para atravesar la membrana y una vez llegado a fluido intracelular convertirse en una forma ionizada para poder bloquear el canal de sodio desde su interior. Esta cualidad marca profundamente la actividad clínica del fármaco en cuanto requiere de una doble transformación para poder actuar.
La proporción existente entre estas dos formas viene dado por la diferencia entre el pKa del fármaco y el pH del medio inyectado, siendo el pKa un valor clásico que se deriva de la también clásica ecuación de Henderson-Hasselbach:
pKa= pH +log (BH+)/(B)
El pKa es el valor de pH en el cual el 50% de la solución se encuentra en su forma ionizada y la otra mitad no. Por tanto cuanto menor sea ese valor de pKa mayor facilidad tendrá el fármaco de disociarse de su forma iónica no liposoluble ( que predomina en el pH bajo que tiene la presentación comercial del anestésico) a la forma no iónica pero capaz de atravesar las membranas necesarias para llegar al axón intracitoplasmático y cumplir su función. Es por tanto un valor fundamental que nos informa de la facilidad que tiene el compuesto de llegar a su lugar de acción, de la rapidez de instauración de sus efectos o dicho de un modo más clínico, de su periodo de latencia.
De la misma manera, el pH del medio extracelular tendrá una importancia en los efectos clínicos del fármaco por cuanto los pH acidos; Tejidos inflamados, o con impregnación continua de anestésicos (que como hemos dicho presentan un pH de 4,5 a 6) son tejidos que originan en los anestésicos o bien un efecto clínico menor de lo esperado, o bien observemos como el efecto clínico que buscamos va desapareciendo incluso con incrementos de cantidad de anestésico (efecto de taquifilaxia).
También esta característica dual de los anestésicos habituales es la que explica el hecho de añadir bicarbonato a ciertos anestésicos (lidocaína principalmente) produce una disminución de su periodo de latencia, al «aproximar» la solución acida del anestésico a su pKa ya desde antes de la administración al paciente .
Del mismo modo el añadir en demasía bicarbonato o subir demasiado ese pH, origina la precipitación de aquel anestésico que se presenta como una base con un nivel de solubilidad mínima como es el caso de la bupivacaína, la ropivacaina y la levobupivacaína, originando una turbidez característica en la mezcla. Por tanto de modo general diremos que las necesidades de añadir bicarbonato sin que precipite en estos anestésicos son una decima parte de las que necesita la lidocaína por lo algunos autores abogan que la práctica de acercar el pH de la solución al pH fisiológico no añade utilidad clínica en estos fármacos.
¿NUEVOS ANESTÉSICOS LOCALES?
Como hemos visto la mayoría de los anestésicos locales con los que asistimos a nuestros pacientes actúan de esa manera, sin embargo los laboratorios pugnan por encontrar nuevas moléculas que superen a las anteriores en seguridad y en «prestaciones clínicas«.
Otros anestésicos
Existen actualmente varias líneas de investigación encaminadas a darnos anestésicos más seguros, más fáciles de utilizar y más eficaces mediante modificaciones farmacocinéticas y a veces farmacodinámicas de sustancias ya existentes en la actualidad. También se experimenta con coadyuvantes que mejoren las características de los ya usados. Pero también se buscan nuevos fármacos activos sobre el canal de sodio o con otros lugares de acción con efecto anestésico local. Obviamente debemos esperar a que se demuestre a nivel clínico que los nuevos anestésicos supongan una ventaja frente a los ya existentes para producirse el cambio de alguno de ellos. Enumeramos algunos de ellos simplemente para tener noción de ellos, y darnos cuenta que existen otros caminos para la investigación.
Fenilcarbamatos
El primer fenilcabamato comercializado fue el Diprodon en 1936 como resultado de la búsqueda de un anestésico ester con mayor resistencia a la hidrolisis. A partir de ellos los denominados esteres básicos del ácido fenilcarbámico alcoxisustituido se nos han presentado sin mucha fortuna. La carbisocaina, la heptacaina que presentaban una acción muy hipotensora y la pentacaina que se uso en el ámbito veterinario y acabó como gastroprotector. Todos estos anestésicos tienen la particularidad de ser fármacos altamente lipofílicos incluso a un pH acido lo que les supone una supuesta ventaja frente a los anestésicos locales clásicos en los tejidos acidificados que aún no ha sido «acoplada» a nuestro quehacer diario pero que supone un punto de partida interesante para futuras investigaciones.
Otros bloqueantes de los canales de sodio:
– Diclonina: anestésico local tipo cetona.
– Ametocaina: baja latencia y toxicidad.
– Dibucaina: reducción de los niveles de ATP intracelulares.
– Crobenetina: bloqueo fásico de los canales de sodio.
– BIIR 561 CL: bloquea los canales y antagoniza los receptores AMPA.
Bloqueantes de los canales de Ca++:
– Verapamilo: por inhibicion de la ATP sintentasa.
– TEA: antagoniza los canes de K+, potenciando el efecto de la lidocaína.
– Ibutilida: antiarrítmico de tipo III, antagoniza los canales de K+.
Otros bloqueantes de canales:
– Butamben: bloquea los canales de sodio, de calcio, y de potasio.
– Prenilamina: antiaginoso que antagoniza los canales de sodio y de calcio.
– Eugenol: parecido a la capsaicina en un antagonista vanílico del GABA y de los NMDA.
– Dizocilpina: antagonista no competitivo de los receptores NMDA.
– Sameridina: agonista parcial de los receptores opioides mu.
Liposomas
Existe además líneas de investigación consistentes en el uso de preparaciones liposomiales de anestésicos ,dichos liposomas consistirían en una fase acuosa con las moléculas hidrosolubles activas englobadas en una cápsula lipídica de escasos nanometros de diámetro capaz de atravesar las barreras membranosas y soltar así la «carga activa» intracitoplasmaticamente. De tal manera que ahorraríamos los pasos de formas iónicas y no iónicas.
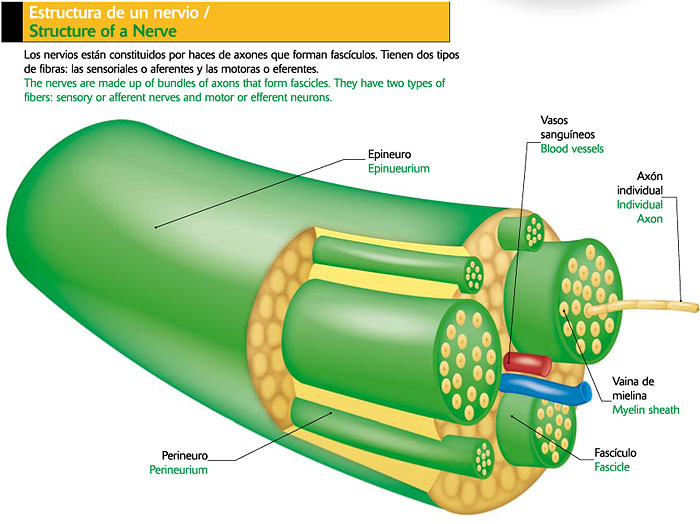
La Estructura de los nervios
Como hemos dicho anteriormente los anestésicos locales usados habitualmente deben llegar en condiciones de molécula activa al interior intracitoplasmatico, y desde allí introducirse en su lugar de acción que es el interior de los canales del Na+. Como es lógico pensar, la distribución del anestésico empleado desde su lugar de administración hasta su lugar de acción estará condicionada no solo por las cualidades intrínsecas del fármaco sino también tendrá mucho que ver el tipo de estructuras orgánicas que debe atravesar para conseguir su efecto clínico.
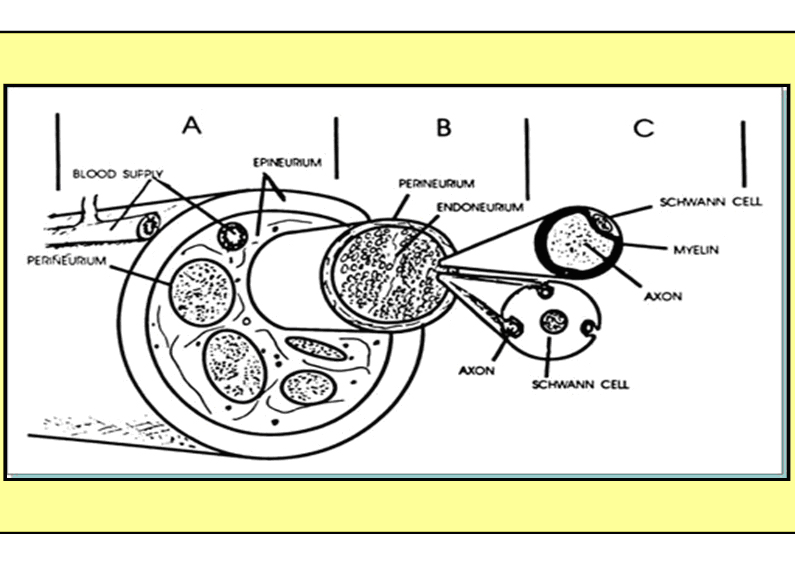
El axoplasma de una fibra nerviosa esta limitada por el axolema, que es la membrana propiamente dicha que contiene los ionoforos de los que hemos hablado previamente. El axón, que no es sino la prolongación citoplasmatica perinuclear de una neurona puede medir de unos milímetros a un metro y se halla envuelto por la célula de Schawnn y a veces por un manguito de mielina. Alrededor de todo ello se encuentra una membrana basal llamada neurolema recubierta por el endoneuro.
La célula de Schawnn es la célula de sostén del axón que la engloba individualmente, aunque puede englobar a veces a varios axolemas ( si son fibras amielínicas ) ,cuando estos axolemas alcanzan el diámetro crítico de 1 o 2 micras la célula se Schawn se enrolla sobre sí misma de forma concéntrica constituyendo un manguito de mielina, cuyo espesor es proporcional al tamaño de la fibra. De esta manera obtenemos una envoltura del axón lo protege y le otorga una impermeabilización frente a sustancias externas .Son la uniones consecutivas con las otras células se Schawnn el punto de entrada de los anestésicos (llamados nódulos de Ranvier ), lugar en la que los ionoforos se hacen muy numerosos y donde se origina los cambios de potenciales de manera saltatoria ( de un nódulo a otro) La distancia de estos nódulos primordiales para nuestra actuación anestésica varia de unas micras en las fibras amielinicas a casi 2 milimetros en las fibras mielínicas gruesas y son necesarios el bloqueo de los canales a nivel de mas de una de estas“ aperturas“ para bloquear el impulso nervioso.
Tenemos así un tipo de fibras; las amielínicas, que presentan mayor número de“ agujeros en la impermeabilización“ del axón además contar con una impermeabilización más fina por lo que la llegada de las moléculas de anestésico estará más favorecida y por tanto la capacidad de bloquear el impulso nervioso en este tipo de fibras.
El estudio de los distintos tipos de fibras nerviosas nos puede contestar cual de las dos variables fundamentales en la administración de un anestésico es la principal implicada en el éxito o fracaso de dicho bloqueo; bien manejando cantidad de volumen que impregne la mayor superficie de fibra, o bien manejando concentración de moléculas para que lleguen con facilidad al interior del axoplasma diana. Por tanto nos plantearemos a la hora de bloquear un impulso nervioso que tipo de fibra es la principal implicada , el grosor aproximado del nervio en su conjunto y la profundidad a la que se encuentra el haz implicado dentro de la estructura de dicho nervio.
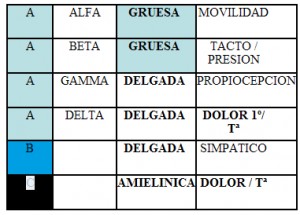
Clasificación de las fibras
En 1925 Gasser y Erlanger agruparon estos conocimientos y clasificaron las fibras nerviosas por su grosor y su función. El A o grupo de las fibras mielinizadas del sistema cerebroespinal, el B constituido por fibras mielinizadas del sistema nervioso autónomo, y el C o fibras amielínicas de las raices posteriores raquídeas y del sistema simpático. Estas últimas son las menos“ aisladas“ y en general las primeras que podemos bloquear con el anestésico.
Por tamaño, las fibras A se han clasificado en alfa, beta, gamma y delta por los mismos autores, (o por Lloyd que las clasificó como I, II, III) todas ellas no son sino clasificaciones de grosor y de aislamiento mielínico.
A modo de resumen práctico, solo un 20% de las fibras sensitivas se engloban dentro de estas gruesas fibras tipo A, con unas velocidades de conducción elevadas, El otro 80% son fibras de pequeño calibre mielínicas o amielínicas con velocidades de conducción más pequeñas que se engloban en los grupos A delta o III , o incluso del delgado grupo C y son las responsables de trasladar las sensaciones dolorosas que son las principales fibras diana de la anestesia locoregional.
____________________________________________________________________________
Passer H.S. Unmedullated fibers originating in dorsal root ganglia J.Gen Physiol. 33 651-690 . 1950
De esta manera es fácil comprender varios conceptos: Por un lado la llamada CIM o concentración inhibitoria mínima que presentan los fármacos anestésicos, se aplica a cualidad que algunos tienen de originar un bloqueo diferencial (bloqueo sensitivo pero no motor) en cuanto aprovechamos su capacidad de llegar con mayor facilidad a las fibras delgadas y poco aisladas como son las que conducen el dolor , de las cuales el 80% es transmitido a través de las delgadas fibras de tipo C, y por otro lado encontrar cierta resistencia a llegar al axoplasma de las gruesas fibras motoras. Del mismo modo se entiende el bloqueo secuencial de sensaciones según el tipo de fibras que las conducen (dolor>frió>calor>tacto>presión profunda>movilidad).
También hemos visto al principio las fibras nerviosas no viajan individualmente sino agrupadas en haces en lo que comúnmente llamamos nervios, o troncos nerviosos que no son sino múltiples haces de fibras nerviosas englobadas cada una por su endoneuro y reunidas en una estructura única englobada a su vez por el perineuro. Esta característica sí es importante para una aplicación práctica de nuestro trabajo asistencial pues no es lo mismo bloquear un tronco de grueso calibre en la que los haces centrales quedarán poco expuestos a anestésicos poco liposolubles, que a troncos nerviosos de poco diámetro.
Bibliografía
1.- Comparison of 2% lignocaine with adrenaline and fentanyl, 0.75% ropivacaine and 0.5% levobupivacaine for extension of epidural analgesia for urgent caesarean section after low dose epidural infusion during labour.Anaesth Intensive Care. 2008 Sep;36(5):659-64.Sng BL, Pay LL, Sia AT. (PubMed)
2.- A comparison of the inhibitory effects of bupivacaine and levobupivacaine on isolated human pregnant myometrium contractility Fanning RA, Campion DP, Collins CB, Keely S, Briggs LP, O’Connor JJ, Carey MF.Anesth Analg. 2008 Oct;107(4):1303-7. (PubMed) (Pdf)
3.- Bupivacaine, levobupivacaine and ropivacaine: are they clinically diferent?“. Andrea Casati MD, Marta Putzu MD. Best practice & Research Clinical Anesthesiology. June 2005, vol 19, issue 2;p 247-268. (PubMed)
4.- A randomized sequential allocation study to determine the minimum effective analgesic concentration of levobupivacaine and ropivacaine in patients receiving epidural analgesia for labor. Dan Benhamou, MD., Caroline Ghosh MD., Fréderic J Mercier, MD., Ph.D. Anesthesiology 2003;99:1383-6. (PubMed)
5.- The relative motor blocking potencies of bupivacaine and levobupivacaine in labor. Hector J. Lacassie, MD; Malachy O. Columb, F.R.C.A. Anesth Analg 2003;97:150. (PubMed) (Pdf)
6.- Relative analgesic potencies of levobupivacaine and ropivacaine for epidural analgesia in labor. Linda S. Polley, MD;Malachy O.Columb F.R.C.A. Anesthesiology 2.003;99:1354-8. (PubMed)
Para saber más
– Aurelio Gomez Luque. Puesta al día en anestesia regional y tratamiento del dolor. Volumen II 2.007 .
– Anestesia Locorregional. P.Gauthier – Lafaye. 1987 .Ed Masson 1.985.
– Principles and Practice of Pharmacology for Anesthetists. 5ª ed 2008. TN Calvey and NE. Williams.
– Farmacología de los anestesicos Locales. J.M. de Carlos y MA Viamonte. 1.999.
– Medicamentos habitualmente empleados para el bloqueo nervioso. Farmacología de los anestésicos locales de Cosmo A. Cap 39 de Tratamiento practico del dolor .P. Prithvi Raj ed Harcout 2.002.
Dr A.Gironés Muriel. H. Sanitas La Moraleja. Madrid. España.Dr. Angel Villar-Pellit. H Virgen de la victoria .Málaga. España.









Genial!!!!!
Muy bien explicado
FORMIDABLE MANERA DE RECORDAR, DE ESTAR AL DÍA Y DE EDUCACIÓN MÉDICA CONTINUA. GRACIAS
Un artículo magnífico. Una forma de explicar muy didáctica. Gracis