García Martínez B, Cuesta Montero P, Martínez Blázquez A, Charco Roca LM, Carpintero Moreno F.
Complejo Hospitalario Universitario de Albacete.
Introducción
La enfermedad de Steinert o distrofia miotónica tipo I es el síndrome miotónico más frecuente de la edad adulta. Tiene una incidencia de 3-5/100.000 y una herencia autosómica dominante 1, en la mayoría de los casos la transmisión es por parte de la madre 2, 3, 4. El gen para este desorden esta localizado en el brazo largo del cromosoma 19 2. El comienzo de esta enfermedad se sitúa entre las segunda y tercera década de la vida, aunque en algunas familias se produce el fenómeno del acortamiento cromosómico adelantándose la presentación en las siguientes generaciones. Es una enfermedad del músculo, no del sistema nervioso periférico ni de la unión neuromuscular producida por un defecto de la función de los canales de sodio y cloro 3, 4, que determinan una inestabilidad eléctrica de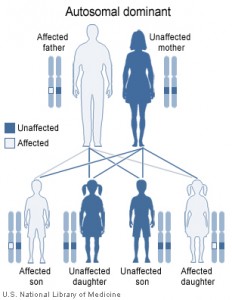
El manejo anestésico de estos enfermos es un reto para el anestesiólogo por la gran variedad de complicaciones que se pueden presentar tanto en el intraoperatorio como en el postoperatorio, tanto por la evolución de la enfermedad como por la susceptibilidad a la gran mayoría de los agentes anestésicos.
Manifestaciones Clínicas 1, 2
1. Musculares:
a) Miotonia: contracción persistente del músculo esquelético observado luego de una contracción voluntaria o provocada. El paciente no es capaz de relajar el músculo después de usarlo Las contracciones no son dolorosas.
b) Debilidad Muscular: es la causante de la invalidez en estos pacientes. Es de carácter progresivo por degeneración de las fibras musculares sobre todo en los músculos craneo-faciales y a nivel distal en las extremidades. La debilidad a nivel facial les da un facies característico, con sonrisa invertida, fosas temporales, mejillas hundidas (debilidad de los masticadores), ptosis parpebral, disartria. La debilidad incluye la musculatura esofágica, gástrica, intestinal y uterina.
2. Cardíacas: son muy comunes, a veces asintomáticas, aunque junto con las respiratorias son las que causan más mortalidad. Presentan alteraciones de la conducción un 90% de los pacientes. Hay un deterioro progresivo de la conducción con bloqueos de primer grado, de rama y de tercer grado (éste relacionado con muerte súbita). Afectación miocárdica por la distrofia determinando insuficiencia cardíaca, miocardiopatía y defectos septales. Valvulopatías (sobre todo prolapso mitral, presente en el 20% de los pacientes).
3. Alteraciones Ventilatorias: los problemas respiratorios en estos pacientes son de origen multifactorial. Se afectan los músculos respiratorios, incluido el diafragma, alterando la mecánica ventilatoria. Se afecta la musculatura orofaríngea, produciéndose dificultad para toser y acumulación de secreciones. Se observan alteraciones restrictivas pulmonares, disminución de la CV, CPT, hipoventilación alveolar y un aumento de apneas obstructivas del sueño. Además, existe un aumento de la sensibilidad de los efectos depresores ventilatorios de: opiáceos, sedantes, barbitúricos.
4. Gastrointestinales: el 80% de los pacientes las presentan. Incluye debilidad de los músculos faringeos con alteraciones deglutorias, disfagia, retardo del vaciado gástrico, atonía gástrica, pseudobstrucción intestinal, disminución del peristaltismo esofágico, mayor incidencia de colelitiasis, etc.
5. Oftálmicos: casi todos desarrollan cataratas por encima de los 20 años.
6. Calvicie Frontal: sobre todo los varones.
7. Alteraciones Endocrinas: hipotiroidismo, insuficiencia gonadal primaria, atrofia testicular, alteraciones del metabolismo de la glucosa, insulina e incluso diabetes mellitus 5.
8. Coeficiente Intelectual (CI): se observa un CI bajo en la mayoría de estos enfermos.
9. Hipertermia Maligna: se ha relacionado esta enfermedad con la susceptibilidad a padecer esta complicación.
Presentación de los Casos Clínicos
Presentamos 2 pacientes con enfermedad de Steinert en los que se realizan laparotomías abdominales por tumoraciones ginecológicas.
CASO 1
Mujer de 39 años programada para laparoscopia por tumoración ovárica compleja.
Como antecedentes personales destaca enfermedad de Steinert, con alimentación por PEG debido a disfagia derivada del propio Steinert. Intervenciones quirúrgicas previas: amigdalectomía, meniscectomía bilateral y mastectomía por cáncer de mama. En esta última intervención precisó ingreso en UCI en el posoperatorio inmediato por retraso en el despertar.
Estudio preoperatorio con analítica, ECG y Rx de tórax dentro de la normalidad. En la exploración física destaca una facies característica con un bocio bilateral.
A su llegada a quirófano se premedica con ranitidina 50 mg y ondansetrón 4 mg. Monitorización estándar con ECG, PANI, temperatura, SatO2, capnografía, BIS y de la relajación muscular con TOF-Watch.
Se realiza inducción anestésica con atropina 0,5 mg, fentanilo 100 mcg, propofol 100 mg y rocuronio 20 mg, éste último a dosis inferiores a las habituales (0,4 mg/Kg) ya que puede existir una respuesta exagerada a los RMND o desencadenarse una crisis miotónica.
Se decide IOT con Airtrack porque, a pesar de presentar Mallampati I, buena apertura bucal y distancia tiromentoniana > 6 cm, estos pacientes pueden presentar vía aérea difícil por contractura de cuello o mandíbula derivados de la propia enfermedad. Se intuba sin incidencias (Cormack I/IV) con tubo del número 7,5.
Se realiza mantenimiento anestésico con sevoflurano al 1% y remifentanilo en perfusión continua entre 0,05 y 1 mcg/Kg/min, manteniendo en todo momento un BIS entre 40 y 55. No es necesaria la repetición de dosis de rocuronio al no haber obtenido más de 2 respuestas de 4 en el tren de 4 (TOF) a lo largo de la intervención.
Por complicaciones durante la técnica quirúrgica se realiza laparotomía para revisión quirúrgica. La paciente es extubada en quirófano sin complicaciones una vez hemos obtenido un TOF-ratio de 0,9, previa administración de sugammadex 100 mg (2 mg/Kg), puesto que presentaba un bloqueo moderado con respuesta en la cuenta postetánica (PTC) y en el TOF.
Se traslada a Unidad de Reanimación para control postquirúrgico, sobre todo desde el punto de vista cardíaco y pulmonar, así como control de los problemas derivados de la disfunción de los músculos faríngeos como la aspiración. Tras 24 horas en la Unidad de Reanimación sin haber presentado ninguna complicación, la paciente es dada de alta a planta.
CASO 2
Mujer de 40 años programada para histerectomía abdominal por miomas uterinos.
Como antecedentes personales destaca enfermedad de Steinert, sin otros hallazgos de interés ni intervenciones quirúrgicas previas.
En el estudio preoperatorio se evidencian predictores positivos de vía aérea dificil: apertura limitada, Mallampati IV, movilidad cervical limitada. El resto de preoperatorio, analítica, ECG y Rx de tórax dentro de la normalidad.
A su llegada a quirófano se premedica con ranitidina 50 mg y ondansetrón 4 mg. No premedicamos con benzodiacepinas para evitar una posible depresión respiratoria. Monitorización estándar con ECG, PANI y SatO2. En este caso se decide anestesia intradural con bupivacaína hiperbara 0,5% 12 mg y fentanilo 20 mcg. Intraoperatorio anodino.
Tras la intervención quirúrgica la paciente pasa a Reanimación, donde se realiza bloqueo del plano abdominal transverso (TAP) de forma bilateral con 15 ml de levobupivacaína 0,25% a cada lado para analgesia y para control postoperatorio, siendo dada de alta a planta a las 24 horas sin ninguna complicación.
Discusión
El curso y el empeoramiento de esta enfermedad se puede ver afectado tanto por el estrés quirúrgico como por las técnicas anestésicas utilizadas, por lo que es muy importante el correcto manejo perioperatorio.
Valoración preoperatoria
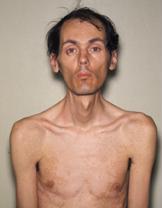
Debido a la debilidad de los músculos faríngeos, es muy importante la profilaxis de broncoaspiración y el ayuno durante todo el perioperatorio.
En nuestros 2 pacientes encontramos limitaciones durante la anamnesis sobre el conocimiento de su enfermedad y de las manifestaciones sistémicas que podían presentar. En el caso nº2 encontramos una vía aérea difícil. Se programó su ingreso un día antes de su intervención para comprobar su estado y se reservó cama en la unidad de Cuidados Críticos.
Intraoperatorio
Los pacientes con esta enfermedad tienen una sensibilidad aumentada a las drogas anestésicas de uso habitual.
Los relajantes musculares depolarizantes (RMD) representan un problema particular en el paciente miotónico. La succinilcolina tiene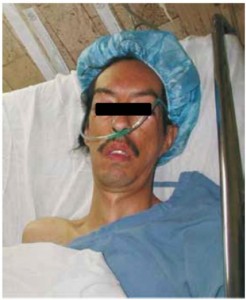
Una respuesta miotónica generalizada típica frente a la succinilcolina consiste en el rápido desarrollo de rigidez de los músculos mandibulares, torácicos y abdominales con arqueamiento de la espina cervical y lumbar. La ventilación y la intubación puede ser difícil o imposible en 4-5 minutos. Además, debido a que la miotonía es causada por un defecto primario del músculo, los RMND no pueden abolir la contracción generalizada. Por eso este fármaco debe ser evitado en los pacientes miotónicos.
Aunque la respuesta a los relajantes musculares no despolarizantes (RMND) es normal, cuando ocurre un desgaste muscular se puede presentar una respuesta exagerada, por lo que es muy recomendable el uso de monitorización de la relajación muscular cuando se usen esos fármacos.
Los anticolinesterásicos, como la neostigmina, utilizados para antagonizar los efectos residuales de los RMND puede también precipitar una miotonía 3, presumiblemente debido a que el músculo miotónico tiene incrementada su sensibilidad frente a los efectos estimulantes de la acetilcolina. Si es necesario utilizar los relajantes neuromusculares sería recomendable utilizar un relajante como el rocuronio para el que tenemos un reversor diferente a la neostigmina.
Aunque se han descrito crisis miotónicas con todos los anestésicos, parecen tener más seguridad los agentes intravenosos, siendo hoy en día el propofol y el remifentanilo la opción más recomendada en caso de anestesia general, ya que en se han descrito efectos adversos graves con los gases halogenados, como las crisis miotónicas y la hipertermia maligna.
Sólo se realizó anestesia general en el caso nº1, y se evitaron los agentes halogenados así como fármacos de vida media larga. Utilizamos rocuronio con monitorización neuromuscular, y realizamos reversión con sugammadex 6.
Ciertos factores físicos pueden precipitar la miotonía, como el frío y el temblor 4. Nos interesa en este punto destacar la monitorización de la temperatura central y mantener normotermia (colchón térmico, fluidos intravenosos tibios), ya que el frío puede actuar como un desencadenante. Si bien el temblor se ha asociado a la hipotermia, puede ser independiente de la temperatura corporal. Sin embargo, el mantenimiento de la normotermia reduce la incidencia y duración del temblor postoperatorio.
Los opiáceos, tanto parenterales como espinales, pueden disminuir los temblores asociados con las técnicas anestésicas generales o locorregionales, pero se han descrito casos de espasmo muscular tras su administración.
En ambos pacientes se realizó un calentamiento de la sala de quirófano así como monitorización de la temperatura corporal e infusión de fluidos con calentador.
La miotonía no responde al bloqueo neuromuscular, ni al bloqueo regional ni periférico. Drogas como el dantroleno, la procainamida, la quinina y la fenitoina (que actúan directamente sobre la membrana muscular) pueden ser útiles para el control de la crisis miotónica. En este mismo sentido, cabe situar la utilidad de la infiltración del músculo con anestésico local para provocar relajación.
Previo a la intervención se dispuso en quirófano y en la unidad de Cuidados Críticos de dantroleno y fenitoina para preveer cualquier evento adverso.
No hay técnica anestésica que exima de la probabilidad de aparición de una crisis miotónica. Sin embargo, la anestesia locorregional ES LA TECNICA ANESTESICA DE ELECCION, ya que evita algunas situaciones desencadenantes y permite obviar el uso de succinilcolina y de agentes halogenados.
Postoperatorio
Las complicaciones que se pueden presentar en el postoperatorio son el resultado de la disfunción pulmonar y/o cardíaca, y de la debilidad de los músculos faríngeos que aumentan el riesgo de aspiración.
Se recomienda ingreso en una unidad de cuidados intensivos al menos durante 24 horas.
Las complicaciones más frecuentes son las pulmonares, que pueden generar una insuficiencia respiratoria aguda.
Es recomendable el uso de ventilación mecánica no invasiva (VMNI) en estos pacientes para evitar el riesgo de una nueva intubación 4 y el uso concomitante de más fármacos anestésicos.
Conclusiones
La aparición de una crisis miotónica constituye un gran problema para la seguridad del paciente en quirófano. Si ocurriera durante la fase de intubación podría dificultarla e incluso imposibilitarla. Los factores desencadenantes más importantes son la cirugía, la hipotermia y ciertos agentes anestésicos.
La anestesia regional es una buena opción para la cirugía abdominal de estos pacientes 7, ya que proporciona una adecuada relajación para el cirujano y una adecuada analgesia posoperatoria inmediata, que evita el uso de mórficos que nos puedan ocasionar una depresión respiratoria.
Cuando por el tipo de cirugía se requiera una anestesia general, es preferible la utilización de agentes intravenosos de vida media corta 8 y evitar siempre que se pueda el uso de los relajantes musculares. Si esto último no es posible, se recomienda usarlos con monitorización neuromuscular y a dosis muy reducidas.
Por otro lado, y sobre todo tras una anestesia general, estos pacientes deben pasar las primeras 24 horas posoperatorias en una Unidad de Cuidados Críticos dada su predisposición a presentar complicaciones respiratorias y cardíacas.
Bibliografía
1.- Martínez Silva O. Enfermedades Neuromusculares y Anestesia. Marzo de 2002. Disponible en (pdf1) (pdf2)
2.- Oriol- López SA, Hernández- Bernal CE. Anestesia en la distrofia muscular de Steinert. Revista Mexicana de Anestesiología. 2010; 33 (3): 160- 165. (pdf1) (pdf2)
3.- Fabiano Souza Araújo, Roberto Cardoso Bessa Júnior, Carlos Henrique Viana de Castro, Marcos Guilherme Cunha Cruvinel, Dalton Santos. Anestesia em Paciente com Doení§a de Steinert. Relato de Caso. Rev Bras Anestesiol. 2006; 56 (6): 649-653. (PubMed) (pdf)
4.- Flora Margarida Barra Bisinotto, Daniel Capucci Fabri, Maida Silva Calí§ado, Paula Borela Perfeito, Lucas Vieira Tostes, Gabriela Denardi Sousa. Anestesia para Colecistectomía Videolaparoscópica en Paciente Portador de Enfermedad de Steinert. Relato de Caso y Revisión de la Literatura. Rev Bras Anestesiol. 2010 Mar-Apr;60(2):181-91, 105-10. (PubMed)
5.- Toby N Weingarten, Ryan E Hofer, Margherita Milone, Juraj Sprung. Anesthesia and myotonic dystrophy type 2: a case series. Can J Anesth. 2010; 57: 248- 255. (PubMed) (pdf)
6.- Pellegrini L, Mercier MF, Cornese A, Blasco V, Albane J. Induction en séquence rapide chez un patient porteur d“™une dystrophie myotonique de Steinert: intéríªt de l“™association d“™une forte dose de rocuronium et de sugammadex. Annales Franí§aises d“™Anesthésie et de Réanimation. 2012; 31: 155- 157. (PubMed)
7.- Sivathondan D. Myotonic dystrophy and pain management of a patient undergoing total abdominal hysterectomy in a metropolitan general hospital. Anaesth Intensive Care. 2006; 34 (4): 506- 509. (PubMed)
8.- Yasuhiro M, Masako M, Takao H, Hiroaki M, Takefumi S. Target-controlled infusion of propofol for a patient with myotonic dystrophy. J Anesth. 2005;19(4):336-8. (PubMed)
García Martínez B, Cuesta Montero P, Martínez Blázquez A, Charco Roca LM, Carpintero Moreno F.Servicio de Anestesia y Reanimación.
Complejo Hospitalario Universitario de Albacete.


Me ha parecido una revisión muy completa e interesante.
Muchas gracias por presentarla para que todos aprendamos.
Un saludo. Marisa Mariscal.
hola gracias por la publicacion es muy importante el conocimiento para entender esta enfermedad gracias