Ignacio Fernández
Complejo Hospitalario de Toledo.
Introducción
La resección hepática se ha convertido en el pilar del tratamiento de las neoplasias malignas. Los resultados después de la resección han mejorado significativamente con los avances de las técnicas quirúrgicas, anestésicas y cuidados perioperatorios.
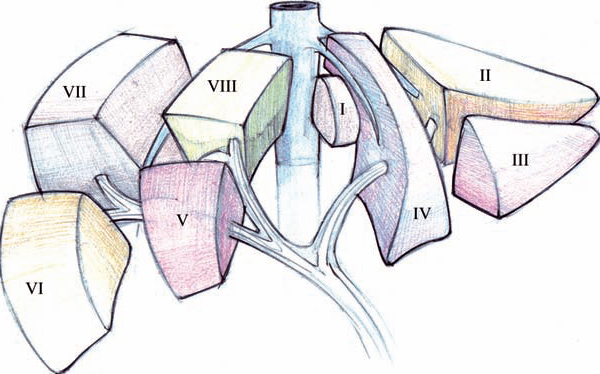
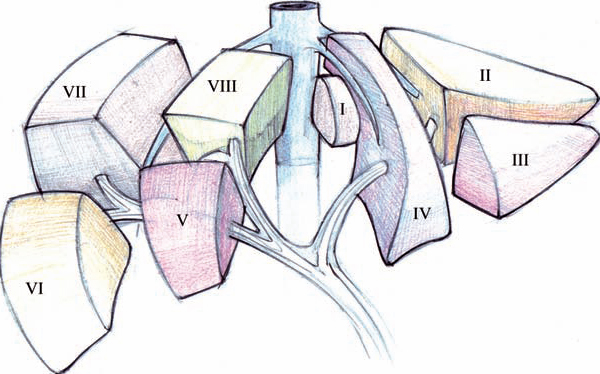
El hígado se compone de 2 lóbulos anatómicos de diferente tamaño, derecho e izquierdo, separados por la cisura hepática mayor. Cada lóbulo está formado por segmentos que constituyen unidades independientes en cuanto a vascularización y a drenaje biliar. El lóbulo derecho integra del IV al VIII segmento. Y el izquierdo del I a III segmento.
El hígado recibe sangre arterial y venosa. La arteria hepática provee un 30% del flujo sanguíneo hepático. El resto proviene de la porta. Los vasos hepáticos, la vía biliar y los nervios del sistema autónomo forman el pedículo hepático. Según la nomenclatura internacional, una hepatectomía mayor es cualquier resección de al menos 3 segmentos.
Figura 1.- Segmentación hepática.
- La hepatectomía derecha consiste en la resección de los segmentos: V, VI, VII y VIII. La hepatectomía izquierda en la resección de los segmentos: I, II, III y IV.
- La lobectomía derecha es una hepatectomía derecha asociada a la resección del segmento IV. La lobectomía izquierda consiste en la resección de los segmentos I, II, y III.
- La hepatectomía central consiste en la resección de los segmentos I, IV, V, y VIII, contiguos a la vena cava inferior (VCI).
Los principales riesgos intraoperatorios en la hepatectomía mayor son la hemorragia, la embolia gaseosa y las consecuencias de la reperfusión hepática.
Para reducir las perdidas hemáticas intraoperatorias es frecuente el pinzamiento pedicular o maniobra de Pringle, esta técnica consiste en pinzar la arteria hepática, la vena porta y el conducto biliar. Este pinzamiento produce isquemia del hígado. El tiempo de isquemia tolerable es del orden de 120 minutos para un hígado sano. En el caso de los pacientes cirróticos sería de 60-90 min.
Se puede resecar hasta el 75% de un hígado sano sin provocar insuficiencia hepática aguda postoperatoria. La masa hepática se regenera en aproximadamente 6 semanas. Si es necesaria una resección mayor del 75%, estaría indicada la embolización del territorio a resecar 1 mes antes de la cirugía, con la finalidad de hipertrofiar el parénquima restante. Esta opción no es válida en un hígado cirrótico por poseer una capacidad de hipertrofia lenta.
La mortalidad perioperatoria actual se encuentra entorno al 1%, con un 32% de morbilidad si la resección es de un segmento o menos, y aumenta a un 75% de morbilidad y 7.8% de mortalidad en pacientes con resección de más de seis segmentos.
La edad influye poco, y la mortalidad no aumenta en los pacientes mayores de 70 años. La mortalidad si dependerá de la magnitud de la resección hepática. Se han identificado 5 factores de riesgo independientes: la colangitis, la creatinina mayor de 1,3 mg./dl., la bilirrubinemia mayor de 6 mg./dl., la resección de la vena cava, y las pérdidas sanguíneas superiores a 3 litros. Las resecciones hiliares tienen una morbilidad del 65% y una mortalidad del 15%.
Las complicaciones más frecuentes en el periodo postoperatorio inmediato son la hemorragia, la coagulopatía, la infección, las fístulas biliares, la ascitis y el fallo hepático postquirúrgico.
Hepatectomía en paciente cirrótico
La cirrosis es un factor importante de morbilidad porque repercute sobre numerosas funciones, y la mortalidad tras una hepatectomía sobre hígado cirrótico puede llegar hasta el 20% en algunas series.
Diferentes grupos de expertos contraindican las resecciones hepáticas mayores en pacientes Child C, y las desaconsejan en los grados A y B. La resección en el paciente cirrótico debe ser más limitada que el 75% del paciente con hígado sano. Muchos autores recomiendan el aclaramiento del verde de indocianina para evaluar la reserva funcional hepática en pacientes de este tipo (< del 10% a los 15 min. sería un valor normal). En este grupo de pacientes las complicaciones postoperatorias presentan una incidencia del 25-75%.
Una correcta evaluación preoperatoria del riesgo de fallo hepático postoperatorio es necesaria para determinar el procedimiento quirúrgico adecuado. Una reserva funcional hepática insuficiente en el parénquima remanente llevaría al fallo de regeneración de la función hepática.
La clasificación de Child-Turcotte-Pugh es una forma simple de evaluar la función hepática (Tabla 1), aunque algunos estudios consideran que esta clasificación está limitada en la práctica clínica. Recientemente se están utilizando métodos de imagen para evaluar el volumen de remanente hepático, como la tomografía axial computarizada, la ecografía o la resonancia magnética nuclear. Con estas técnicas se ha demostrado que el volumen hepático está relacionado con la reserva funcional hepática. A través de las pruebas de imagen también se puede establecer una clasificación en diferentes grados de los pacientes con hígados cirróticos. Y, a su vez, estos grados tendrán correlación pronóstica.
Tabla 1.- Clasificación Child-pugh. El índice de mortalidad es menor de 10% para Child A, de 20-30% para Child B, y de 50-60% para Child C.
Existe otra escala de valoración del paciente cirrótico, la escala MELD (Model for End Stage liver Disease), que evalúa las variables de bilirrubina, creatinina e INR (MELD Score = 9,6 Ln(Creat)+3,8 Ln(Bili) + 11,2 Ln(INR) + 6,4 ). Estarían recomendados los procedimientos quirúrgicos en pacientes con valores de MELD inferiores a 10, se debería tener precaución y una indicación quirúrgica estricta en pacientes con valores entre 10-15, y estaría contraindicada cualquier intervención con valores superiores a 15. No obstante en resección hepática la presencia de hipertensión portal sería un predictor de peor pronóstico que la escala Child-Pugh.
De acuerdo con Pisani et al. el APACHE III fue superior al Child-Pugh en evaluar el pronóstico de supervivencia en pacientes cirróticos sometidos a hepatectomía.
Teh et al. en un estudio que enfrenta valoración de MELD en pacientes cirróticos y no cirróticos concluye que esta escala fracasa en la predicción postoperatoria de las complicaciones en pacientes no cirróticos, pero supone un factor predictivo en cirróticos sometidos a hepatectomía.
Volumetría hepática
Vauthey et al. (2000) realizan volumetría hepática con TAC y objetivan complicaciones postoperatorias muy serias cuando el remanente hepático es menor del 25% del volumen inicial.
Para realizar una adecuada valoración no solo se debe tener en cuenta el volumen a resecar, sino también la naturaleza de la causa de resección así como la severidad y el tipo de intervención a llevar a cabo. La reserva funcional hepática está relacionada con la cantidad y la calidad celular del hígado remanente. No hay consenso sobre el remanente hepático necesario para evitar el fallo hepático. Hay casos descritos de mínimas resecciones hepáticas que conllevaron a un fallo hepático fulminante postoperatorio. De acuerdo con los estudios, el mínimo remanente adecuado para la resección hepática por metástasis de cáncer colorectal es de 25-30%. Aunque debemos recordar que pacientes que han recibido quimioterapia probablemente sólo toleren resecciones menores.
Algunos estudios recomiendan la combinación de la volumetría por TAC con el aclaramiento de verde de indocianina para una valoración exhaustiva de la reserva funcional hepática. El límite para hepatectomía mayor en pacientes cirróticos sería una retención de menos del 15% de indocianina tras 15 minutos, y ante esta situación se podría resecar hasta un 60% del parénquima hepático.
No solo los pacientes cirróticos deberían someterse al aclaramiento de indocianina, sino también aquellos sometidos a quimioterapia e hígados esteatósicos.
El estudio del parénquima residual postoperatorio debe ser más exhaustivo en el caso de que el paciente presente cirrosis. La ausencia de hipertensión portal y valores normales de bilirrubina suponen los mejores predictivos de buen pronóstico postoperatorio con una supervivencia del 70% a los 5 años. En cambio, alteraciones en los niveles de bilirrubina e hipertensión portal reducen al 30% la supervivencia posthepatectomía de acuerdo con los criterios de Child-Pugh.
Manejo de líquidos y nutrición
El postoperatorio se caracteriza por un desequilibrio en el balance hidroelectrolítico, por lo que se recomienda el uso de coloides para restaurar el volumen intravascular. Es frecuente la ascitis postoperatoria, sobretodo en pacientes cirróticos, por lo que es necesaria una restricción de sodio así como un uso juicioso de los diuréticos. Se deben evitar las soluciones con lactato dado que el hígado insuficiente produce este en vez de metabolizarlo. Un control del lactato postoperatorio puede hacernos intuir la buena reserva funcional del hígado intervenido.
El periodo posterior a la resección se caracteriza por un estado catabólico, el soporte nutricional en este periodo es crítico para asegurar una regeneración hepática adecuada. Los pacientes con un estado nutricional adecuado preoperatorio no necesitan ninguna intervención especial, salvo iniciar tolerancia oral tan pronto sea posible. En el caso de presentar un cuadro de desnutrición preoperatoria o cirrosis podrían beneficiarse del uso de nutrición enteral.
Richter et al. estudian el uso de nutrición enteral frente a la parenteral, y encuentran que con la primera se reduce el riesgo de infección de la herida así como las complicaciones relacionadas con el catéter. En un trabajo, Hotta, et al. encuentran que el uso rutinario de nutrición parenteral no tuvo efecto sobre los resultados postoperatorios.
La hiperglucemia inducida por el estrés quirúrgico causa disfunción del metabolismo hepático y de la función inmune. El control de la glucemia con terapia intensiva de insulina reduce morbilidad y mortalidad en estos pacientes. Debido al riesgo de hipoglucemia, sería recomendable mantener niveles entre 140-180 mg./dl.
La hipofosfatemia es frecuente después de la resección hepática mayor. Se cree que es debida al aumento de consumo de fosfatos por el hígado en regeneración. La hipofosfatemia supone un riesgo para los pacientes (disfunción hematológica, arritmias, resistencia a la insulina, etc.), por lo que se aconseja su reposición según analítica en el postoperatorio inmediato.
Coagulopatía
El pico de coagulopatía de estos pacientes se presenta entre el 2º y el 5º día. Aunque en la actualidad no existe consenso en cuanto a la transfusión de plasma fresco congelado (PFC). La prolongación del INR suele ser autolimitada y no precisar la transfusión de PFC en pacientes no cirróticos. En algunos centros se trata de corregir cualquier alteración de la coagulación por mínima que sea, mientras que en otros sólo se interviene si el INR es mayor de 2.
Por otra parte, podría estar recomendada la administración de vitamina K y un control más exhaustivo de la coagulopatía en pacientes cirróticos.
Tratamiento del dolor
Aunque estos pacientes puedan beneficiarse de la analgesia epidural, en resecciones amplias la colocación del catéter a este nivel puede dar más problemas que ventajas debido a la coagulopatía y la posible inestabilidad hemodinámica que pueden presentar, pudiendo obtener un control analgésico optimo por vía endovenosa.
Sobre el uso del catéter paravertebral para el manejo del dolor en la resección hepática hay pocos estudios realizados. A su vez deberían evitarse los AINE´s por aumentar el riesgo de sangrado y de la insuficiencia renal, pudiendo predisponer al síndrome hepato-renal en pacientes cirróticos. Por otra parte, conviene recordar que las dosis máximas de paracetamol recomendadas en paciente con insuficiencia hepática es de 2 g./24 horas.
Infección postoperatoria
La infección después de la resección hepática es un factor importante que contribuye a la morbi-mortalidad postoperatorias, siendo la causa de un 40% de la muertes tras esta intervención quirúrgica.
Los factores de riesgo son la obesidad, el drenaje biliar preoperatorio, la extensión de la resección hepática, el sangrado intraoperatorio y la fuga biliar postoperatoria.
Reducir los tiempos quirúrgicos, una técnica meticulosa con el mínimo sangrado, y un buen manejo de la vía biliar minimizarían las complicaciones infecciosas. La movilización precoz del paciente y un manejo adecuado de los catéteres venosos debe realizarse de rutina. El reconocimiento precoz de la infección y manejo con antibioterápia de amplio espectro es imprescindible para disminuir la mortalidad infecciosa.
Jarnagin et al. estudiando complicaciones tras hepatectomía demostraron que en la mayoría de las infecciones el foco era la vía biliar, seguido del respiratorio. La colección perihepática fue la complicación infecciosa más frecuente.
En 207 hepatectomías Garwood et al. tuvieron una incidencias de infección del 3,3% con una mortalidad entre los pacientes que presentaban esta complicación del 33%. El único test de laboratorio relacionado con la infección postoperatoria fue la albumina, y los factores de riesgo fueron la extensión de la resección así como la duración del procedimiento. Un tiempo quirúrgico mayor de 6 horas se asoció con una incidencia aumentada de infección. Las bacterias más prevalentes en la resección hepática son los bacilos gram negativos entéricos y los cocos gram positivos, Enterobacter sp. y Enterococcus sp. El germen más frecuentemente encontrado entre los pacientes que fallecieron fue el Staphylococcus sp meticilin resistente.
En estudios de necropsias también han sido encontradas infecciones por hongos como Cándida albicans.
En caso de infección y precisar antibioterapia empírica, deberíamos asociar un carbapenem a vancomicina o linezolid y a un antifúngico tipo azol o una equinocandina dependiendo de la situación clínica del paciente. En el caso de colecciones perihepáticas puede ser necesario el drenaje por medio de radiología intervencionista.
Tromboprofilaxis
La prevalencia del tromboembolismo venoso postoperatorio, incluyendo trombosis venosa profunda (TVP) y tromboembolismo pulmonar (TEP), en pacientes de cirugía general es del 15-40%, estando asociado a un aumento de la morbi-mortalidad postoperatoria. Clásicamente se evitaba el uso de agentes farmacológicos para la prevención de la TVP en hepatectomías, pero hoy se sabe que estos pacientes presentan un estado de hipercoagulabilidad debido a la disminución de producción de factores anticoagulantes por el hígado remanente, la limitada movilidad postoperatoria, los reactantes de fase aguda, neoplasia asociada, etc.
Por lo que se recomienda asociar medidas farmacológicas y no farmacológicas. En una revisión retrospectiva de 415 pacientes sometidos a hepatectomía mayor, la tromboprofilaxis farmacológica redujo la tasa de TEV, pero no aumentó la tasa de transfusión. Algunas guías recomiendan iniciarla el mismo día de la cirugía.
Sangrado postquirúrgico
El empleo de nuevas técnicas quirúrgicas ha disminuido la incidencia de pérdidas de sangre tanto intra como postoperatoriamente. Un control analítico exhaustivo y la corrección de la coagulopatía puede minimizar la complicación hemorrágica en las primeras horas.
La intervención puede conllevar pérdida masiva de sangre intraoperatoria, que asociada a la hipotermia y a la producción disminuida de factores de la coagulación por un hígado temporalmente insuficiente, puede favorecer el sangrado en las primeras horas postoperatorias.
Fístula biliar
La fístula biliar es la complicación específica más frecuente de las resecciones hepáticas. Tienen una incidencia de entre un 4,8 a un 7,6%.
Existen varios tipos en función de su relación con la vía biliar principal, algunas precisarán reparación quirúrgica, otras cerrarán de forma espontánea y otras se complicarán generando un aumento de la morbimortalidad. Su prevención es fundamental, sobre todo en aquellos pacientes con mayor riesgo en su desarrollo como son los que presentan hígados cirróticos o aquellos con resecciones hepáticas amplias que comprometen a segmentos centrales.
Ascitis
Es frecuente la producción de ascitis en el postoperatorio inmediato de la resección hepática. Un aumento de la presión portal, el hiperaldosteronismo secundario y la hipoproteinemia en este periodo pueden hacer que se presente ascitis incluso en pacientes con función hepática preoperatoria íntegra. La administración de albúmina, la restricción de sodio y el uso de diuréticos son necesarios para su adecuado manejo. A veces es necesaria la realización de paracentesis evacuadoras para controlar la ascitis a tensión.
Fallo hepático
Una buena valoración preoperatoria puede minimizar el riesgo de fallo hepático postoperatorio. Si bien la funcionalidad del remanente hepático va a depender de la cantidad de hígado residual, también dependerá de su calidad. Previamente habíamos definido los márgenes de seguridad para hígados cirróticos y no cirróticos, así como para aquellos que sin serlo habían sufrido algún tipo de agresión (Quimioterápia).
Existen otros factores durante la cirugía que influirán en la viabilidad del remanente hepático. La hipotensión, la anemia o las maniobras de Pringle pueden producir isquemia del hígado residual y desencadenar un fallo hepático. Este se objetivará por una coagulopatía con aumento progresivo del INR y una alteración de los marcadores hepáticos: transaminasas, bilirrubina, y albúmina. Así como el desarrollo de encefalopatía hepática en sus diferentes grados (tabla 2).
Tabla 2.- Grados de encefalopatía hepática.
El manejo se lleva a cabo con medidas de soporte, transfusión de plasma fresco congelado para corregir la coagulopatía, manejo del edema cerebral, así como intubación y conexión a ventilación mecánica para proteger la vía aérea. Algunos pacientes cumplirán los criterios de trasplante hepático del fallo hepático fulminante del King College (Tabla 3). Aunque hay que considerar que la mayoría de los pacientes sometidos a una hepatectomía amplia no son candidatos al trasplante hepático por su patología de base. Alguna excepción podría ser la resección hepática por quiste o un hepatocarcinoma sin enfermedad diseminada. En esos casos debería valorarse el traslado de los pacientes a un centro en el que se lleve a cabo el trasplante hepático ortotópico.
Tabla 3.- Criterios King´s College para la indicación del trasplante hepático en el fallo hepático agudo.
Bibliografía
1.- Belgheti J Seven hundred forty-seven hepatectomies in the 1990s: an update to evaluate the actual risk of liver resection. J Am Coll Surg 2000; 191:38-46. (PubMed)
2.- Shigeta H Bacteremia after hepateetomy: an analysis of a single center, 10-year experience with 407 patients. Langenbecks Arch Surg 2002; 387:(l) 17-24. (PubMed)
3.- Mullin EJ How much liver resection is too much? Am J Surg 2005; 190:87-97. (PubMed)
4.- Pugh RN. Transection of the oesophagus for bleeding oesophageal varices. Br J Surg 1973; 60:646-49. (PubMed)
5.- Schindl MJ. The value of residual liver volume as a predictor of hepatic dysfunction and infection after major liver resection. Gut 2005; 54 (2):289-96. (PubMed) (pdf1) (pdf2) (epub)
6.- Schneider PD. Preoperative assessment of liver function. Surg Clin North Am 2004; 84 (2):355-73. (PubMed)
7.- Vauthey JN. Standardized measurement of the future liver remnant prior to extended liver resection: methodology and clinical associations. Surgery 2000; 127: 512-519. (PubMed)
8.- Bruix J. Surgical resection of hepatocellular carcinoma in cirrhotic patients: prognostic value of preoperative portal pressure. Gastroenterology 1996; 111 (10) 1018-22. (PubMed)
9.- Bruix J. Practice Guidelines Committee, American Association for the Study of Liver Diseases. Hepatology 2005; 42 (5):1208-36. (PubMed)
10.- Horigome H. Treatment of solitary small hepatocellular carcinoma: consideration of hepatic functional reserve and mode of recurrence. Hepatogastroenterology 2000; 47:507-11. (PubMed)
11.- Capussotti L. Liver resection for large-size hepatocellular carcinomas in 47 non-cirrhotic patients-no mortality long-term survival. Hepatogastroenterology 2006; 53:768-72. (PubMed)
12.- Pisani AC. Surgery in the cirrhotic patient. Prognosis and risk factors. Minerva Chir 2000; 55 (11):771-8. (PubMed)
13.- Cescon M. Indication of the extent of hepatectomy for hepatocellular carcinoma on cirrhosis by a simple algorithm based on preoperative variables. Arch Surg 2009; 144 (1):57-63. (PubMed) (pdf)
14.- Teh SH. Model for End-stage Liver Disease score fails to predict perioperative outcome after hepatic resection for hepatocellular carcinoma in patients without cirrhosis. Am J Surg 2008; 195 (5):697-701. (PubMed)
15.- Watanabe I. Hyperlactemia can predict the prognosis of liver resection. Shock. 2007; 28:35-38. (PubMed)
16.- Geerse DA. Treatment of hypophosphatemia in the intensive care unit: a review. Crit Care. 2010; 14:R147. (PubMed) (pdf1) (pdf2) (epub)
17.- Datta HK. Hepatic surgery-related hypophosphatemia. Clin Chim Acta. 2007; 380:13-23. (PubMed)
18.- Bezeaud A. Hypercoagulability after partial liver resection. Thromb Haemost. 2007; 98:1252-1256. (PubMed)
19.- Hotta T. Evaluation of postoperative nutritional state after hepatectomy for hepatocellular carcinoma. Hepatogastroenterology. 2003; 50:1511-1516. (PubMed)
20.- Richter B. Nutritional support after open liver resection: a systematic review. Dig Surg. 2006; 23:139-145. (PubMed) (pdf)
21.- Ciuni R. Nutritional aspects in patient undergoing liver resection. Updates Surg. 2011; 63:249-252. (PubMed)
22.- Wrighton LJ. Postoperative management after hepatic resection. J Gastrointest Oncol. 2012 March; 3 (1): 41““47. (PubMed) (pdf1) (pdf2) (epub)
23.- Jarnagin WR. Improvement in Perioperative outcome after Hepatic resection. Ann Surg 2002;236 (4):397-407. (PubMed) (pdf) (epub)
24.- Garwood RA. Infectious Complications After Hepatic Resection. The American Surgeon 2004; 70:787-92. (PubMed)
25.- Imamura H. One thousand fifty-six hepatectomies without mortality in 8 years. Arch Surg 2003; 138:1198-206. (PubMed) (pdf)
26.- García C. Bilirragia y fístula biliar posthepatectomía. Rev. Chilena de Cirugía 2005; 57 (1):45-51. (pdf)
27.- Dilly MP. Anestesia y cuidados intensivos en cirugía hepática y portal. Enciclopedia Medico-Quirúrgica E-36-562-A-10. (web)
28.- Wrighton LJ. Postoperative management after hepatic resection. J Gastrointest Oncol. 2012 Mar; 3 (1):41-7. (PubMed) (pdf1) (pdf2) (epub)
Ignacio FernándezUnidad de reanimación. Servicio de anestesiología y reanimación.
Complejo Hospitalario de Toledo.





Articulo interesante