Ferreras Vega R, Gutiérrez García I, Méndez Marín MD, Gómez García J, Rubio Pascual P.
Servicio Anestesia y Reanimación pediátrica.
Hospital 12 de Octubre, Madrid
Introducción
Los defectos del tubo neural están presentes en 6 – 17 cada 1000 nacidos vivos y en el caso del mielomeningocele 0,5 – 1 de cada 1000 (1). A pesar de ser una patología poco frecuente, es conveniente conocer el manejo anestésico de este grupo de pacientes, por la necesidad de ser intervenidos en las primeras 24 horas de vida (4) y la frecuente asociación de otras malformaciones, entre ellas hidrocefalia (67.4%) y Arnold Chiari II (58.4%) (3).
Descripción
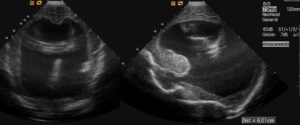
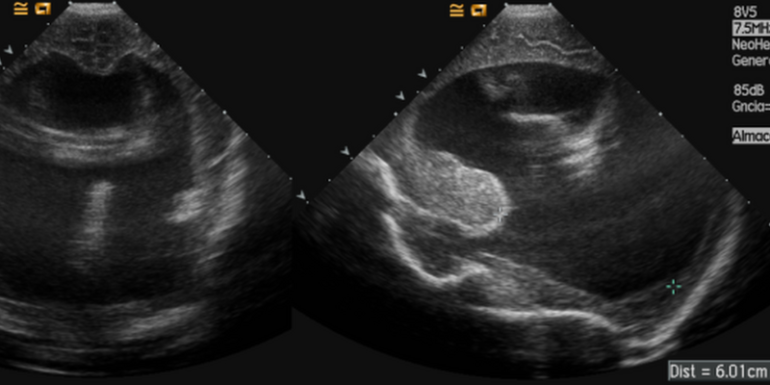
Presentamos el caso de un neonato de 24 horas de vida, recién nacido a término con peso adecuado para la edad gestacional (39 semanas), 3.4 kg, con diagnostico prenatal de mielomeningocele lumbosacro en ocho cuerpos vertebrales. Además asocia: malformación Arnold-Chiari grado II con hidrocefalia (Figura 1), atresia anal sin fístula, anomalía genitoureteral que impiden técnicamente sondaje vesical (cloaca vs seno urogenital único) y agenesia renal izquierda con hidronefrosis derecha grado III. En ecocardiograma se evidencia foramen oval permeable (shunt I-D) y ductus arterioso con shunt bidereccional. Analítica preoperatoria: Hemoglobina 18.8 g/dl, TP: 15,7 s, TTPa 31s, fibrinogeno: 114 mg/dl. A las 36 horas del parto por cesárea, se decide realizar en el mismo acto quirúrgico, corrección del defecto neural y colostomía de descarga.
Antes de la inducción anestésica monitorizamos con: ECG de 3 canales, saturación periférica de oxígeno pre y postductal, presión arterial no invasiva, termómetro esofágico y oximetría cerebral (NIRS). El paciente fue colocado en decúbito lateral izquierdo, con protección y almohadillado del defecto neural. Realizamos inducción (sevofluorano 6%, fentanilo 4 mg/kg y rocuronio 1mg/kg i.v) e intubación orotraqueal en dicha posición, con mínima movilidad de la cabeza (Cormack-Lehane I).
El mantenimiento anestésico se realizó con: sevofluorano 1,5%, remifentanilo 0,1 mcg/kg/min, rocuronio 0,5 mg/kg/h, y bolos de fentanilo. Canalizamos vena yugular interna derecha ecoguiada. Ventilado en presión control, 1.3ml/min (FR 43 rpm), 23 cmH2O y volúmenes corrientes de 6.5 ml/kg, llegando a pH mínimo venoso de 7.25 (con PCO2: 64 mmHg bicarbonato 19 mmol/l). Fue oxigenado con FI02 de 0.3% y PEEP 3 cm de agua para saturaciones de 97%. Se realizó control de la temperatura con calentamiento de líquidos intravenosos y manta de calor. Se emplearon soluciones cristaloides isotónicas balanceadas y las necesidades basales de glucosa fueron respuestas con glucosa 5% en perfusión continua. Precisó durante el procedimiento transfusión de 70 ml de concentrado de hematíes. Continuamos antibioterapia de UCI neonatal (Vancomicina y Gentamicina).
La duración toral del procedimiento fue de 380 minutos, divididos en tres períodos: inducción, canalización venosa central y sondaje mediante cistoscopia en decúbito supino (60 minutos); cierre del defecto del tubo neural en decúbito prono (230 minutos) y colostomía en decúbito supino (90 minutos).
Tras procedimientos se realiza traslado en ventilación mecánica con incubadora de trasporte a UCI neonatal.
Discusión
Hay varios aspectos que deben ser considerados en anestesia neonatal y que nuestro caso los pone de manifiesto:
Monitorización invasiva.
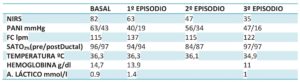
La monitorización invasiva en el paciente neonatal es difícil y con una alta frecuencia de complicaciones. El NIRS como medida no invasiva cuyo valor se modifica por cambios en la perfusión tisular, ayuda al diagnóstico y puede guiar la toma de decisiones (5). En nuestro paciente se registraron 3 episodios de descenso respecto al valor basal (Figura 2), relacionados con:
- Hipotensión 40/19 mmHg con FC: 137 lpm, tras inducción (que cede tras infusión de albúmina 5% (15 ml). La caída del NIRS se produjo antes de la determinación de la PANI, que se realizaba a intervalos de 5 minutos.
- Intubación selectiva, tras cambio de posición del paciente. Descenso parejo a la desaturación periférica. 56/34 mmHg FC:114 lpm.
- Hipotensión: 47/16 mmHg llegando a un valor mínimo en NIRS de 35 en ese momento. Realizamos gasometría (hemoglobina11g/dl; láctico 1 mmol/l) por lo aumentamos el ritmo de la trasfusión mejorando rápidamente la cifra de NIRS. Es relevante que, tras fallo en manta de calor, durante este episodio el paciente se encontraba en hipotermia (34,9ºC) suponiendo menor consumo de oxígeno cerebral. Sin embargo, esta situación no impidió detectar el descenso del NIRS secundario a sangrado (Tabla 1).
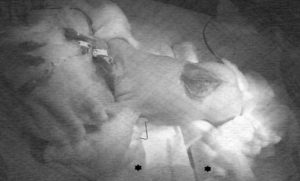
Posición del paciente.
Durante la intervención son necesarios tres cambios de posición quirúrgica. Las movilizaciones deben ser cuidadosas. La malformación Arnold Chiari II se ha asociado a paro cardíaco por herniación de 4º ventrículo (3), en maniobras de inducción. En nuestro caso realizamos una intubación en decúbito lateral con control cervical. La zona occipital, se encontraba protegida por un rodete, intentando minimizar el efecto sobre la presión intracraneal. En prono se coloca rodete en cara con dos cilindros almohadillados en las raíces de los miembros y algodón en zonas proclives (Figura 3). Los repetidos cambios en la posición quirúrgica, se acompañan de malposición del tubo endotraqueal y pérdida de temperatura del paciente. La colostomía se realiza en decúbito supino utilizando un rodete en la espalda, cuyo diámetro interno evita la presión sobre la incisión posterior.
Analgesia.
Las alteraciones en la sensibilidad del mielomeningocele deben ser consideradas pero el uso de fármacos analgésicos no debe ser diferente.
Control de la temperatura.
La exposición quirúrgica de diferentes cavidades, así como los cambios repetidos de posición, conllevan una gran pérdida de calor.
Conclusiones
La anestesia del paciente con múltiples malformaciones supone un reto anestésico, tanto por las implicaciones hemodinámicas debidas a la pérdida de volumen, como por los cambios de posición que aumentan la frecuencia de eventos (perdidas de vías, malposición de tubo endotraqueal o extubación accidental, perdida de temperatura). Atender a la posición quirúgica, alteraciones hidroelectrolíticas y control de la temperatura es de especial relevancia en estos procedimientos. Observamos que en nuestra práctica diaria el NIRS nos ayuda al diagnóstico de eventos adversos y en la toma de decisiones anestésicas, por lo que recomendamos su uso.
Bibliografía
- Bowman RM, Boshnjaku V, McLone DG. The changing incidence of myelomeningocele and its impact on pediatric neurosurgery: a review from the Children’s Memorial Hospital.Bowman Childs Nerv Syst. 2009 Jul;25(7):801-6. (PubMed) https://www.ncbi.nlm.nih.gov/pubmed/19326126
- Adzick NS, Thom EA, Spong CY, Brock JW 3rd, Burrows PK, Johnson MP, et al. A Randomized Trial of Prenatal versus Postnatal Repair of Myelomeningocele. N Engl J Med 2011; 364:993-1004. (PubMed) (HTML) (PDF)
- Singh, Deepak, Rath, Girija, Prasad, Dash, et al. Anesthetic Concerns and Perioperative Complications in Repair of Myelomeningocele A Retrospective Review of 135 Cases. Journal of Neurosurgical Anesthesiology 2010; 22: 11-15. (Abstract)
- Soundararajan N, Cunliffe M. Br. Anaesthesia for spinal surgery in children. J. Anaesth 2007;99 (1): 86-94. (PubMed) (HTML) (PDF)
- Scheeren TW, Schober P, Schwarte LA. Monitoring tissue oxygenation by near infrared spectroscopy (NIRS): background and current applications. J. Clin Monit Comput. 2012; 26(4): 279–287. (PubMed) (HTML) (ePub) (PDF)





Muy interesante el caso,me ha gustado mucho el caso, en particular la «ayuda» que supone la monitorización no invasiva.
Me llama la atención que no se menciona el tema profilaxis primaria látex, indicado por ser un neonato, polimalformado (futuro multioperado) y con un defecto de tubo neural bastante importante. Imagino que se ha dado por sentado pero es interesante mencionarlo dentro de las consideraciones anestésicas dado el alto riesgo de sensibilización que tiene el paciente…
Un saludo
Si así es, no está mencionado pero si se realiza por protocolo en estos enfermos. Muchas gracias por su comentario.