Pérez Herrero M. A.
FEA Anestesiología y Reanimación. Hospital Clínico Universitario de Valladolid
Artículo original: Miller, TE, Myles PS. Perioperative Fluid Therapy for Major Surgery. Anesthesiology 2019; 130: 825–32. (HTML)
Introducción
La optimización de la fluidoterapia es clave en los protocolos y vías clínicas perioperatorias. Las prácticas recomendadas han cambiado desde la publicación de nuevos ensayos clínicos (1) y estudios observacionales multicéntricos con un tamaño muestral elevado que han mejorado la evidencia en este tema y cambiado las pautas tradicionales.
Descripción del Artículo
Revisión sistemática sobre las pautas de fluidoterapia perioperatoria en cirugía mayor, abarcando todo el periodo perioperatorio, desde el preoperatorio (reposición de pérdidas hídricas y pautas de ayuno), intraoperatorio (volumen y tipo de suero más indicado en función de la situación hemodinámica del paciente, monitorización y criterios para la administración) y postoperatorio (recuperación precoz de la vía oral) Las recomendaciones en cuanto a administración de fluidos en cirugía mayor se resumen en la tabla I.
A. PREOPERATORIO
- Manejo preoperatorio de fluidos y tiempos de ayuno
Se aconseja acortar los periodos de ayuno preoperatorio, tal como se resume en la tabla II, incluso las vías clínicas de optimización de recuperación postquirúrgica indican maltodextrina por vía oral (2) horas antes de la cirugía. - Evaluar la capacidad de respuesta de fluidos
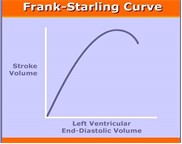
La reposición hídrica preoperatoria está indicada en la mayoría de las cirugías urgentes y en las que se programan después de periodos largos de ayuno o grandes pérdidas. La cuantificación de la volemia es difícil, pero una historia clínica, examen físico y pruebas complementarias adecuadas pueden predecir los casos donde la administración de líquido intravenoso aumentaría el gasto cardiaco y mejoraría la perfusión tisular. Una respuesta positiva al aumento de la precarga (generalmente con un bolo intravenoso de 250 ml de coloide, pero la administración de volúmenes menores o cristaloide consiga el mismo efecto, lo posición de Trendelemburg o la elevación de extremidades inferiores que incrementa en 300 ml el retorno venoso, o las maniobras de reclutamiento pulmonar en caso de ventilación mecánica) aumenta el volumen sistólico del 10% o más (Ver figura 1: Curva Frank-Starling).
En condiciones ideales, las variaciones del volumen sistólico como respuesta a la sobrecarga de fluidos se monitoriza de forma avanzada con un dispositivo invasivo de la onda de pulso o Doppler esofágico. Otras técnicas utilizadas son la variación de la onda de presión arterial; o modificación del diámetro de la vena cava inferior medido por ultrasonido (índice de distensibilidad mayor del 15%) con la respiración.
B. INTRAOPERATORIO
- Monitorización de la respuesta a la sobrecarga de fluidos. Al igual que en el periodo preoperatorio.
- Reposición de líquidos.
La selección, duración y dosis de la fluidoterapia intravenosa debe individualizarse para alcanzar la máxima eficacia con los mínimos efectos secundarios, teniendo en cuenta los protocolos hospitalarios y las características del paciente. El objetivo de la fluidoterapia intraoperatoria es el mantenimiento y reposición de las pérdidas hídricas, evitando tanto el déficit como la sobrecarga de líquidos, considerando como ideal un balance positivo de 1-2 litros en las primeras 24 horas de la intervención (1) (administración intravenosa de 3 litros de suero para un procedimiento de 3-4 h sin gran sangrado ni exposición de vísceras). Por el contrario, las terapias restrictivas para conseguir un balance cero favorecen la aparición de fallo renal agudo y otras complicaciones, tal como demostró el estudio RELIEF1.
Históricamente, se administraban grandes cantidades de líquidos intravenosos para compensar las pérdidas insensibles al tercer espacio. Sin embargo, se ha demostrado que la administración liberal de fluidos intravenosos (más de 6 litros en el día de la cirugía) asocia un aumento significativo del edema tisular (aumento de aproximadamente 4 kg de peso). Por otra parte, En cambio, la fluidoterapia restrictiva (menos de 4 litros) sólo presentaban una ganancia de peso de 1 kg.
El mantenimiento debe compensar las pérdidas insensibles y por orina (desde el inicio del ayuno preoperatorio) con perfusión de 1-1,5 ml/kg/h (1-3 ml/kg/h en cirugía mayor con grandes pérdidas de líquidos) de cristaloides isotónicos y balanceado (Ringer lactato, Hartmann, PlasmaLyte A [ Baxter Healthcare Corp., EE. UU.], Normosol [Hospira Inc., EE. UU.]).
La utilización de solución salina al 0.9% se asocia con hipercloremia, acidosis metabólica y daño renal agudo; y mayor mortalidad y terapias de sustitución renal en pacientes críticos.
En cuanto a la reposición de las pérdidas, debe guiarse mediante la monitorización avanzada para optimizar el volumen sistólico1 o minimizar la variación del volumen sistólico, sugiriendo un algoritmo de actuación resumido en la figura 2. Una vez corregida la volemia, si persiste la hipotensión (presión arterial media inferior a 65 mmHg o mayor en caso de hipertensión crónica) se puede utilizar un vasopresor o un inotrópico (si el índice cardiaco es menor de 2,5 l/min/m2)5. El tipo de suero más indicado todavía está en discusión: los coloides permanecen más tiempo en espacio intravascular, la reposición de la hemorragia es más rápida, y se necesitan menores volúmenes (relación 1,6:1) que con los cristaloides; pero no se han demostrado diferencias significativas.
La administración rápida de bolos de suero intravenoso (generalmente 250 ml) permite evaluar la respuesta al volumen, tratar la hipovolemia y mejorar intercambio tisular de oxígeno.

Los casos de hemorragia grave merecen consideración aparte, aplicando estrategias y protocolos de transfusión masiva, reposición rápida y estrategias individualizadas de productos sanguíneos.
C. PERIODO POSTOPERATORIO
Las guías de optimización perioperatoria recomiendan la administración de líquidos por vía oral de forma precoz, idealmente en las primeras 24 horas, tanto para favorecer la motilidad intestinal y disminuir las perdidas intestinales de líquidos; como para retirar vías intravenosas, sondas y catéteres, que dificultan la deambulación precoz.
Análisis crítico del artículo
La optimización de la volemia y la fluidoterapia es una de las competencias más importantes en las guías de optimización perioperatoria, pues constituye la primera línea de tratamiento de un paciente quirúrgico con hipotensión o signos de hipoperfusión tisular. A pesar de ello, la práctica asistencial se ha basado en la práctica clínica y estudios de baja calidad metodológica. En esta revisión se describen los hallazgos de diversos ensayos y estudios descriptivos con tamaño muestral apropiado. Las conclusiones de estos deben servir de base a nuevas guías clínicas en todo el proceso perioperatorio.
Se mantienen puntos de controversia en el manejo de líquidos pues la evidencia actual no permite extraer conclusiones en ciertos aspectos como: el tiempo necesario de ayuno preoperatorio, la elección del suero óptimo y la indicación de la monitorización hemodinámica más adecuada.
Mientras la práctica clásica recomendaba un ayuno de al menos 6 horas antes de la cirugía, muchos protocolos4 no sólo permiten, sino que aconsejan la ingesta de líquidos claros sin restricción hasta 2 horas antes de la intervención, e incluso en algunos hospitales pediátricos y las unidades de cirugía ambulatoria se ha eliminado el ayuno previo a la cirugía para líquidos claros. Contrariamente a la creencia clásica, se ha demostrado menor riesgo de aspiración (volumen gástrico inferior a 25 ml y pH superior a 2.5) cuando se administran líquidos claros de 2 a 4 h antes de un procedimiento en comparación con el ayuno nocturno.
La producción continua de saliva y secreciones gástricas endógenas aumenta 500-1.250 ml el contenido gástrico tras 8 horas de ayuno. El contenido gástrico se diluye y alcaliniza con la ingesta, por lo que la bebida sin restricción de líquidos claros podría mejorar la seguridad y comodidad del paciente, pues reduce la sed y el hambre, no aumenta los volúmenes gástricos y reduce la acidez de contenidos gástricos. La ingesta de maltodextrina preoperatoria ha demostrado múltiples efectos beneficiosos, como la reducción de la resistencia a la insulina; mayor satisfacción del paciente por reducir la sensación de sed, hambre y náuseas y vómitos postoperatorios; y disminución del riesgo de infección nosocomial.
Por otra parte, el respeto a unas horas de ayuno predeterminadas no asegura un estómago vacío. En este punto la ecografía del antro gástrico permite estudiar el grado de llenado gástrico, así como su contenido (líquido o sólido) y secundariamente evitar la aspiración pulmonar de este contenido de forma individualizada.
Otro punto de controversia es la monitorización de la volemia. Idealmente, la elevación pasiva de las piernas debe hacerse con monitoreo avanzado de la capacidad de respuesta de fluidos usando un dispositivo de contorno de pulso o Doppler esofágico para mejorar el registro de los cambios del volumen sistólico; y si no está disponible, el efecto sobre la presión sistólica, sin olvidar que la mayoría de los órganos son flujo-dependientes, pero la respuesta fisiológica a la hipovolemia es mantener la presión para mantener la perfusión de los órganos vitales. Por ello, la medida del flujo sanguíneo puede detectar la hipovolemia antes que la medida de la presión.
Conclusiones
Los recientes ensayos y estudios multicéntricos sobre fluidoterapia nos han permitido permitido profundizar en el conocimiento y aplicar esta evidencia a nuestra práctica asistencial diaria. Sin embargo, todavía las guías clínicas y los protocolos deben actualizarse de forma continua, en función de las nuevas evidencias y el centro donde desarrollemos nuestra actividad, estableciendo un plan individualizado para cada paciente a lo largo de todo el periodo perioperatorio (resumido en la figura 3).

Bibliografía
1. Myles PS, Bellomo R, Corcoran T, Forbes A, Peyton P et al. Australian and New Zealand College of Anaesthesists Clinical Trials Network and the Australian and New Zealand Intensive Care Society Clinical Trials Group: Restrictive versus liberal fluid therapy for major abdominal surgery. N Engl J Med 2018; 378: 2263–74. (PubMed)
2. Shin CH, Long DR, McLean D, Grabitz SD, Ladha K et al. Effects of intraoperative fluid management on postoperative outcomes: A hospital registry study. Ann Surg 2018; 267: 1084–92. (PubMed)
3. Smith I, Kranke P, Murat I, Smith A, O’sullivan G, Søreide E, et al. European Society of Anaesthesiology. Perioperative fasting in adults and children: guidelines from the european society of anaesthesiology. Eur J Anaesthesiol 2011; 28: 556–69. (PubMed)
4. Green SA, Saxen MA, Urman RD. Practice guidelines for preoperative fasting and the use of pharmacologic agents to reduce the risk of pulmonary aspiration: Application to healthy patients undergoing elective procedures: An updated report by the American Society of Anesthesiologists Task Force on Preoperative Fasting and the Use of Pharmacologic Agents to Reduce the Risk of Pulmonary Aspiration. Anesthesiology 2017; 126: 376–93. (PubMed)
5. Calvo-Vecino JM, Ripollés-Melchor J, Mythen MG, Casans-Francés R, Balik A et al. FEDORA Trial Investigators Group: Effect of goal-directed haemodynamic therapy on postoperative complications in low-moderate risk surgical patients: A multicentre randomised controlled trial (FEDORA trial). Br J Anaesth 2018; 120: 734–44. (PubMed)https://www.ncbi.nlm.nih.gov/pubmed/29576114






Totalmente de acuerdo con sus argumentos, nos existe evidencia de calidad en muchos de los temas que trata de abordar el paper.
Yo agregaría:
1.- La monitorización con “parámetros dinámicos” no aporta nada de información del estado de volemia de los pacientes, estrictamente hablando solo indica una dependencia del gasto cardiaco a un retorno venoso dado, por lo cual, se debe de tener mucho cuidado a la hora de su interpretación.
2.- Otra ves, estos monitores si bien, dan una idea de la posición del paciente en la Curva de Frank – Starling (meseta – pendiente), no dicen nada de la posición de la curva en el espacio, recordamos que está, determinará también la capacidad de respuesta del paciente y se modifica con base al inotropismo y compliance cardiaca.
Estos dos puntos ayudarían a explicar por qué los resultados contradictorios en los muchos estudios de la terapia guiada por objetivos (parámetros dinámicos). Nos dicen muchas cosas pero nada que ver con la volemia.
3.- El pensar que un reto de líquidos movilizará “mágicamente” volumen de “no estrés” a “estrés” es concebir el sistema circulatorio como un cilindro rígido, dicho de otra manera, no contemplar la compliance y capacitancia principalmente venosas – el líquido que administramos fluye pero al mismo tiempo se distribuye – esto fenómeno nos ayudaría a comprender por qué cuando administramos líquidos existe un aumento SOLO TRANSITORIO del volumen sistólico, una ves redistribuido se comete el error de hacer múltiples retos con los mismos resultados, provocando únicamente una sobrecarga de volumen.
4.- Basar parte de la fluidoterapia en los volúmenes urinarios en el perioperatorio no es buena idea, recordemos que como parte de la respuesta metabólica al ayuno, cirugía y anestesia es el aumento de hormona antidiuretica, aldosterona, lo cual provocará variaciones impredecibles en los volúmenes urinarios que no necesariamente reflejarán el estado de volemia de los pacientes.
5.- Por último pero no menos importante, la sobrecarga de volumen también está relacionada a lesión renal aguda, esto por qué, el riñón es el único órgano que al aumentar su presión de perfusión lo estamos condenando a una sobrecarga de trabajo (aumento del consumo de O2) consecuencia de la “hipervolemia” además, añadimos las alteraciones que este estado provoca en la microcirculación (coherencia hemodinámica) como edema dará como resultado alteraciones en el acoplamiento consumo y aporte de oxígeno llevando al paciente a falla.
En primer lugar, gracias por sus comentarios y aportaciones, el debate en este tema nos permitirá profundizar en el conocimiento para la optimización en el tratamiento de nuestros pacientes. El artículo comentado constituye un primer paso a la investigación en fluidoterapia, buscando evidencia en este campo.
Invariablemente la fluidoterapia es un hilo frágil, ya que la fluidoterapia debe de ser ajustada e individualizada acorde a los requerimientos de cada paciente, el tipo de cirugía y el plan postoperatorio. Parte de ese arduo trabajo es comprender 1.- la respuesta metabólica al trauma, 2.- que el cuerpo humano está hecho para tolerar más las hipovolemia y no las hipervolemias, 3.- que se debe de realizar hidroterapia dirigida por metas.
Dentro de este último punto se debe de considerar la evidencia de cada monitoreo ya sea invasivo, mínimo invasivo o no invasivo, se menciona la elevación pasiva de piernas, la VVS, uresis/kg/h, y lo q no mencionan y en la actualidad es una herramienta muy útil y es a la cabecera del paciente y no es invasiva es el USG medir el Índice colapsabilidad de la vena cava inferior,.
Consideró liberal el aporte de líquidos para compensar los requerimientos de 1 a 3 ml/kg/h, sería más específico el cálculo como tal de los requerimientos básales ( fórmula de Holliday-Segar), el ayuno, el trauma quirúrgico, el sangrado, la uresis y cuando amerita el caso el circuito anestésico.
Cómo se menciona son guías de apoyo para poder tener un punto de partida y de la misma manera una gama de opciones para los diferentes escenarios.
Efectivamente, la medida del índice de colapsabilidad de la vena cava inferior es una herramienta a considerar en el cálculo de la volemia y de la respuesta del organismo al relleno volumétrico, si bien debo realizar dos consideraciones: en primer lugar, no siempre es fácil obtener la visualización de la cava inferior en el paciente quirúrgico, además de que este índice se describió en pacientes en ventilación espontánea, no mecánica (a pesar de haberse descrito diversas extrapolaciones en caso de ventilación con presión positiva); por otra parte, los numerosos protocolos que estudian el índice de colapsabilidad de la vena cava inferior, lo hacen junto a la ecocardiografía para evaluar el gasto cardiaco.
Muchas gracias por las reflexiones planteadas, opiniones como las aportadas, nos hacen avanzar en el conocimiento de un tema tan poco estudiado como la fluidoterapia.