Membrilla Moreno C, Sánchez López ML, Simón Polo E, Charco Roca LM
Facultativo Especialista de Área de Anestesiología y Cuidados Intensivos. Complejo Hospitalario Universitario de Albacete.
Introducción
El riñón es uno de los principales órganos implicados en la detoxificación del organismo. El principal motivo que condiciona la toxicidad renal de los fármacos es su eliminación mediante esta vía, así como su biotransformación en metabolitos activos.
Para facilitar el enfoque diagnóstico en la nefrotoxicidad, es fundamental conocer las manifestaciones clínicas características de cada fármaco.
En la actualidad, a nivel mundial un alto porcentaje de ingresos hospitalarios son debidos a cuadros de insuficiencia renal, tanto aguda como crónica reagudizada. Ha habido un incremento de su incidencia en las últimas décadas, lo que puede explicarse por un aumento de los factores de riesgo, como son la edad avanzada, la presencia previa de enfermedad renal crónica (ERC) y la diabetes mellitus.
La incidencia descrita de la insuficiencia renal aguda (IRA) varía según los criterios que se utilizan para clasificarla y el perfil del centro sanitario u hospital que se incluyen los estudios. Se calcula que hasta un 35% de las IRAs son debidas a nefrotoxicidad medicamentosa o inducida por fármacos. Aproximadamente el 20% de los casos e IRA requieren terapia de reemplazo renal TRR), lo que lo relaciona con un aumento de la mortalidad, llegando a tasas de más del 60% en países en desarrollo1.
Epidemiología de la insuficiencia renal aguda en el ámbito hospitalario
Dentro del ámbito hospitalario, la literatura muestra que la IRA es más común en las unidades de cuidados intensivos (UCI), llegando a una incidencia de hasta el 60% en pacientes críticos.
En estas unidades, se debe tener en cuenta que además de existir un mayor uso de fármacos nefrotóxicos, el riesgo de IRA se ve condicionado por múltiples factores: la hipovolemia, la sepsis, la disfunción multiorgánica y la activación de los mediadores de la inflamación, que potencian el efecto tóxico de los medicamentos administrados. Esto supone un problema a la hora de investigar la etiología principal de la IRA, ya que no existen pruebas específicas que demuestren o definan con claridad el mecanismo predominante del daño1.
Algunos de los factores potencialmente presentes en la práctica clínica habitual pueden sugerir causalidad entre la administración del fármaco y su nefrotoxicidad:
- Exposición al agente, en este caso un fármaco y dependiendo de éste, la duración de su exposición, que puede ser puntual tras la administración de una sola dosis o prolongada y/o repetida en el tiempo.
- Mecanismo lesional compatible con el efecto producido por medicamento sospechado.
- Exclusión de otras causas posibles de nefropatía.
Conocer las poblaciones de riesgo es esencial en cuanto a la prevención y el diagnóstico precoz de la nefrotoxicidad. Los principales factores de riesgo están estrechamente relacionados con la reducción de la reserva funcional renal (glomérulos que carecen de capacidad para incrementar su tasa de filtración ante necesidades tanto fisiológicas como patológicas), una concentración mayor a nivel tubular de fármacos con potencial neurotóxico y cuando los mecanismos lesionales son sinérgicos y aumentan así el grado de daño renal. Ejemplos de ello son el efecto vasoconstrictor asociado al uso de algunos diuréticos y fármacos que administrados juntos compiten con el transportador responsable de la secreción tubular como es la ciclosporina. También puede ocurrir un daño sinérgico con la asociación de: cisplatino y un aminoglucósido, vancomicina y piperacilina-tazobactam, ciclosporina y simvastatina o metotrexate y penicilinas, salicilatos o sulfamidas2.
Fisiopatología implicada en la nefrotoxicidad
El riñón recibe el 25% del gasto cardíaco. Cuenta con una gran superficie endotelial que se encuentra en contacto directo y prolongado con la sangre y todas las sustancias que se transportan a través del torrente sanguíneo, como pueden ser los fármacos.
Pese a que se realizan estudios de seguridad previos a la comercialización de los fármacos, a menudo algunos efectos secundarios son detectados solo después de su puesta en el mercado y comienzan a ser utilizados por la población (estudios postautorización o de farmacovigilancia).
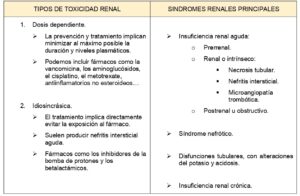
La nefrotoxicidad puede ocurrir por mecanismo dosis – dependiente o idiosincrásica y hay diferentes síndromes renales descritos (Tabla 1).
La Farmacogenética es la ciencia genómica que estudia las acciones e interacciones entre los fármacos en cada persona en función de sus genes, nos explicaría porqué algunos pacientes tienen una predisposición genética a ciertos efectos secundarios relacionados con algunos medicamentos. Uno de los mecanismos conocidos involucra a los transportadores moleculares que se encuentran en el túbulo contorneado proximal. Disponer de esta información puede resultarnos útil al decidir prescribir ciertos fármacos potencialmente tóxicos y elegir así la mejor manera de hacer un seguimiento de estos pacientes. Además, en el futuro, pueden convertirse en dianas terapéuticas específicas, con la creación de medicamentos con estructuras que permitan una menor concentración en la región tubular2.
Implicaciones clínicas, diagnóstico de la nefrotoxicidad y biomarcadores
La manifestación más clara de nefrotoxicidad es la IRA, caracterizada por la presencia de alteraciones del flujo urinario (oliguria o poliuria), alteraciones hidroelectrolíticas y ácido-base (hipernatremia, hiperpotasemia y acidosis metabólica) y alteraciones de las pruebas de función renal (aclaramiento de creatinina y agua libre, osmolaridad urinaria y plasmática, excreción fraccionada de sodio o potasio y biopsia renal)1,4.
A efectos epidemiológicos, la mayor parte de los estudios sobre nefrotoxicidad consideran únicamente la cifra de creatinina sérica, lo que obstaculiza un análisis preciso y completo de la magnitud real del problema. Por este motivo, actualmente se investiga la correlación de ciertos biomarcadores con la función renal, lo que podría permitir una identificación más temprana del fracaso renal y, por lo tanto, mejoraría el pronóstico de los pacientes. Todavía no existen estudios de alta calidad que demuestren los beneficios reales de la determinación de dichos marcadores, pero es cierto que algunos resultados son prometedores (Tabla 2).
Fármacos nefrotóxicos
Dentro del campo de la anestesiología, muchos de los fármacos utilizados son inactivos tras producirse su biotransformación. En cambio, hay otros que son eliminados vía urinaria como metabolitos activos y que pueden provocar fallo renal en el período postanestésico5.
Por ello, es importante realizar un análisis completo del arsenal farmacológico con el que cuentan los anestesiólogos para emplear en su práctica clínica diaria, con el objetivo de que tengan en cuenta las posibilidades más inocuas y efectivas en su manejo.
Posteriormente, se exponen también otros fármacos utilizados habitualmente y que, aun no siendo fármacos anestésicos, sí que es frecuente su uso perioperatorio o en unidades de cuidados críticos.
Se excluyen de esta revisión ciertos agentes que pese a ser una posible causa de IRA, no son considerados nefrotóxicos. Un ejemplo son los diuréticos del asa, que pueden ocasionar deshidratación, inhiben el sistema renina-angiotensina-aldosterona, causan vasodilatación a nivel de la arteriola eferente, reducen la presión intraglomerular y provocan así un empeoramiento de la función renal en pacientes en situaciones de riesgo (como puede ser un paciente séptico, deshidratado o con estenosis de la arteria renal).
- Anestésicos inhalados
Dentro de este grupo, los que contienen compuestos fluorados son los que potencialmente pueden ser directamente nefrotóxicos. El flúor es un gas que puede provocar disfunción renal cuando su concentración es mayor a 50 uM. Interfiere en el metabolismo del calcio e impide la formación de ATP, y con ello, reacciones esenciales para el buen funcionamiento celular.
El flúor influye en el descenso de las concentraciones de calcio debido a la formación de precipitados insolubles junto con este ion. Se ha observado en estudios post mortem que el flúor puede causar vasodilatación, degeneración hepática, necrosis tubular renal, lesión glomerular y edema cerebral o pulmonar, así como engrosamiento de periostio, calcificación de ligamentos y disminución del espacio de la médula ósea.
También se han reportado algunos casos de nefrotoxicidad con la utilización de sevoflurano y desflurano. Dicha toxicidad se atribuye al compuesto A. Algunos estudios afirman que la exposición a sevoflurano durante más de 2 horas y manteniendo CAM por encima de 1,25, provoca a nivel renal lesión glomerular y tubular por el compuesto A. Dicho compuesto reactivo se obtiene del metabolismo tras la degradación del sevoflurano en presencia de la cal sodada. El llamado compuesto B no parece guardar relación con la nefrotoxicidad.
Tras la biotransformación de los anestésicos inhalados, los productos no volátiles son eliminados principalmente por el riñón, pero, sin embargo, los efectos en el sistema nervioso central son dependientes de la excreción pulmonar. Debido a esto, una función renal disminuida no alterará la respuesta a estos anestésicos6.
- Anestésicos intravenosos
El tiopental, inhibidor del ácido gamma aminobutírico disminuye la respuesta al glutamato y provoca depresión de la excitabilidad neuronal. Sólo un 0,3% se elimina a través del riñón. En pacientes sensibles a los barbitúricos o en dosis altas puede causar depresión circulatoria o anemia hemolítica aguda que puede llevar a IRA.
El etomidato, hipnótico no barbitúrico, es excretado por orina en un 75% y no se ha demostrado nefrotoxicidad tras su uso.
El propofol, un alquifenol muy liposoluble que cuenta con una eliminación bifásica y la ketamina, que se elimina un 4% sin metabolizar, tampoco se ha demostrado toxicidad renal con su utilización7.
- Anestésicos locales
Algunos autores describen que la lidocaína, bupivacaína y tetracaína producen apoptosis celular en el túbulo renal proximal cuando hay exposición a estos fármacos durante más de 48h8.
- Coadyuvantes opioides
La morfina y el fentanilo, que se metabolizan casi de manera completa en el hígado, y el remifentanilo, mediante esterasas plasmáticas, con una vida media de 3-4 minutos, cuentan con una administración segura en pacientes con insuficiencia renal.
La meperidina, en cambio, no es recomendable su utilización en insuficiencia renal, ya que su acumulación produce excitación del sistema nervioso central, pudiendo llegar a producir convulsiones9.
- Relajantes neuromusculares
La succinilcolina se metaboliza por pseudocolinesterasas. Se debe tener en cuenta que su administración aumenta la concentración del potasio sérico en torno a 0,5 mEq/L, llegando hasta 7 mEq/L en pacientes politraumatizados, quemados o con alteraciones neurológicas. En los pacientes con insuficiencia renal que se encuentren en terapia de depuración extrarrenal, se recomienda que la succinilcolina no se utilice si no han sido dializados en las 24 horas previas a la intervención quirúrgica.
El rocuronio es eliminado por el riñón en un 30%, no presenta metabolitos activos y no se acumula en insuficiencia renal10.
- Agonistas alfa-adrenérgicos
La clonidina, uno de los fármacos más utilizados en el ámbito de la anestesiología de este grupo, no ha demostrado repercusión clínica significativa en la función renal. Por otro lado, aunque según ficha técnica no es necesario ajustar la dosis de dexmetomidina en pacientes con insuficiencia renal, se debe tener precaución durante su administración en pacientes con hipotensión, enfermedad renal aguda o crónica, enfermedad cerebrovascular o enfermedad cardíaca (incluida la insuficiencia cardiaca), debido a la posibilidad de efectos hipotensores, que pueden empeorar estas condiciones.11
- Benzodiacepinas
El diazepam aumenta su fracción libre en pacientes que presentan insuficiencia renal crónica, así como hipoalbuminemia o enfermedad hepática, aumentando así el riesgo de presentar mayor grado de depresión del sistema nervioso central tras su administración. El midazolam se excreta principalmente en orina en forma de metabolitos conjugados y en un porcentaje menor al 0,5% en su forma inalterada, por lo que no se ve alterado su efecto en pacientes con fallo renal. No hallamos bibliografía que asocie las benzodiacepinas con el daño renal secundario a su uso12.
- Inhibidores de la ciclooxigenasa 2
Incluidos en este grupo, los Antiinflamatorios no esteroideos (AINES) son fármacos utilizados ampliamente en todo el mundo y considerados una de las principales causas de nefrotoxicidad por fármacos. El principal factor de riesgo es la hipovolemia, que debido a su mecanismo de acción inhibe las prostaglandinas, causando vasoconstricción de la arteriola aferente.
Son pacientes susceptibles a presentar daño renal tras el uso de estos fármacos: los sépticos, la presencia de insuficiencia cardíaca descompensada, cirrosis, deshidratación o el uso concomitante de otros agentes que actúan sobre la hemodinámica renal (ciclosporina, contraste yodado, inhibidores del sistema renina-angiotensina-aldosterona).
Los AINES tienen la capacidad de causar lesiones en prácticamente cualquier compartimiento renal. La mayor parte de los efectos secundarios renales se observan en todas las subclases de este grupo de fármacos. Sin embargo, un estudio reciente mostró que la incidencia del síndrome nefrótico podría estar más relacionada con el uso del tipo no selectivo, especialmente cuando durante más de 15 días y hasta 2 años después de la exposición a la droga. Las medidas preventivas implican elegir otras opciones para la analgesia en pacientes con mayor riesgo de IRA, mantenerla durante el tiempo mínimo posible y corregir la hipovolemia cuando está presente.
Si su exposición es continua y prolongada en el tiempo pueden dar lugar a fallo renal crónico. En cuadros de acidosis láctica secundaria al tratamiento con metformina en los que se administran AINES aumenta el riesgo de producir IRA5,13.
- Vancomicina
Antibiótico ampliamente utilizado contra grampositivos. Representa, como causa de IRA, un 5 a 15% de los pacientes, dependiendo de diferentes factores de riesgo específicos, tales como dosis diaria mayor de 4g, tiempo de tratamiento superior a 14 días, y alta concentración sérica, aunque hay casos incluso a nivel terapéutico (15 a 20 mg/L). La vancomicina administrada vía oral, por ejemplo, para el tratamiento de enterocolitis por C. Difficile, debido a su baja absorción, no se considera una causa de toxicidad renal.
El mecanismo lesional no está claro, pero algunos estudios experimentales sugieren la producción de isquemia tubular debido al estrés oxidativo. Recientemente, se ha demostrado la formación de cilindros de vancomicina, especialmente con altas concentraciones plasmáticos, y con un aumento temprano de la creatinina en comparación con otros agentes nefrotóxicos.
La asociación con fármacos potencialmente nefrotóxicos también es un factor de riesgo bien determinado. Por razones que no están bien descritas, la combinación con piperacilina-tazobactam provoca, de manera sinérgica daño renal, algo inesperado debido a la ausencia toxicidad del fármaco utilizado solo14.
Como prevención de la aparición de nefrotoxicidad en pacientes con factores de riesgo, se está sustituyendo la vancomicina por otros antibióticos con un espectro de acción similar, como son el linezolid y la daptomicina. En los casos en los que no es posible interrumpir el uso del tratamiento, la medida preventiva más eficaz es controlar los niveles séricos. Después de finalizar la terapia, la función renal tiende a volver a los niveles basales14.
- Aminoglucósidos
El incremento del uso en las últimas décadas de esta clase de antibióticos, a pesar de la alta incidencia de toxicidad renal descrita, se debe a la aparición de bacterias gramnegativas multirresistentes.
Este grupo de fármacos se filtran en el glomérulo, con reabsorción parcial en el túbulo contorneado proximal. Dentro de la célula tubular, hay una conexión con los fosfolípidos de membrana, con pérdida de síntesis proteínas y reducción de la función mitocondrial, con la consiguiente muerte celular, que ocurre en mayor proporción con moléculas más catiónicas, como es la gentamicina.
Sus efectos adversos más graves son toxicidad a nivel renal y ocular, con una incidencia de hasta el 50% de IRA no oligúrica en pacientes de alto riesgo, a menudo acompañados de hipopotasemia e hipomagnesemia. Varios factores influyen en la capacidad de generar daño renal, como es la isquemia renal concomitante, una alta concentración plasmática del antimicrobiano y la administración de múltiples dosis diarias.
Debido a la alta prevalencia de toxicidad renal, la recomendación KDIGO (Kidney Disease Improving Global Outcomes) es evitar los aminoglucósidos cuando exista otra opción antimicrobiana menos tóxica, que por desgracia no es a menudo posible. En estos casos, deben llevarse a cabo medidas específicas para minimizar el daño, como la corrección de la hipopotasemia y la hipomagnesemia antes de la administración, intervalos cortos de tiempo de uso (<10 días, preferiblemente), evitar su empleo en pacientes hipovolémicos, administrar preferiblemente una única dosis al día, y la dosis ajustada de acuerdo con el nivel plasmático. Los niveles plasmáticos valle elevados respecto a su rango tóxico están relacionados con el incremento de la incidencia de nefrotoxicidad y deben corregirse aumentando los intervalos entre las administraciones del fármaco.
Después de la interrupción del tratamiento con un aminoglucósido, el paciente puede continuar presentando un empeoramiento de la función renal durante días, debido a un mecanismo de aclaramiento renal tubular lento. A pesar de esto, el pronóstico es generalmente bueno, con un retorno a la función renal basal en la mayoría de los casos después de que su administración se haya interrumpido. Sin embargo, algunos autores sugieren daño irreversible e hiperfiltración crónica de los glomérulos restantes como mecanismo compensador que trata de alcanzar la recuperación de la función renal15.
- Antineoplásicos
Los derivados del platino son agentes quimioterapéuticos ampliamente utilizados para el tratamiento de diversos tipos de cáncer, como los del tracto digestivo y los pulmones. El riesgo de IRA tras su uso se evaluó en una cohorte de 6 años que incluyó a más de 800 pacientes, con una incidencia acumulada del 34%; sin embargo, no hubo casos de progresión a la enfermedad renal terminal16.
El cisplatino también tiene un efecto vasoconstrictor y además de reducir la tasa de filtrado glomerular, causa hipofosfatemia, glicosuria e hipomagnesemia (tardía en más del 40% de los casos). Como profilaxis en pacientes de alto riesgo, se recomienda reducir la dosis del medicamento, realizar una corrección absoluta o relativa de la hipovolemia previamente y reemplazar el medicamento por carboplatino u oxaliplatino, cuando sea posible16.
- Metotrexato
Se trata de un inmunosupresor frecuentemente utilizado en el tratamiento de enfermedades autoinmunes que está relacionado con IRA cuando la dosis de administración es alta (generalmente como quimioterapia contra neoplasias hematológicas y sarcomas), con una incidencia de hasta el 12%. Se ha objetivado la formación de cristales en el tubo distal, que causa inflamación local y necrosis a través de la formación de radicales libres de oxígeno. Los principales factores de riesgo para que se produzca este deterioro renal son las interacciones tóxicas con otras drogas (sulfamidas, betalactámicos, salicilatos), la dosis utilizada, la presencia previa de ascitis o derrame pleural, y las características clásicamente asociadas con la nefrotoxicidad.
Las medidas preventivas incluyen altas dosis de ácido fólico e hidratación intravenosa intensiva, preferiblemente con una solución isotónica de bicarbonato, para corregir la posible hipovolemia y para alcalinizar la orina; estas medidas son eficaces para reducir la cristalización de los fármacos a nivel renal. La concentración plasmática de la droga se puede medir con objetivos específicos dependiendo del protocolo utilizado. En los casos en los que la lesión ya está establecida tenemos la opción de la hemodiálisis intermitente o continua17.
- Anfotericina B
Antifúngico utilizado para el tratamiento de infecciones micóticas graves y potencialmente mortales. Cuenta con tres presentaciones disponibles en el mercado, desoxicolato, liposomal y complejos lipídicos. La principal diferencia entre ellas es el grado de toxicidad renal que producen, siendo el primero el más tóxico, con tasas de hasta el 80%. El mecanismo de lesión implica lesión tubular directa a través del aumento de la permeabilidad de la membrana celular e isquemia, que es inducida por la vasoconstricción de la arteriola aferente, que explica por qué la hipotensión, el uso de inhibidores del sistema renina-angiotensina-aldosterona y un bajo volumen intravascular efectivo son factores de riesgo importantes.
Las manifestaciones clínicas más comunes son hipopotasemia, hipomagnesemia, alteraciones de la concentración urinaria y acidosis metabólica además de una reducción del flujo sanguíneo renal. Estas manifestaciones comienzan, en general, después de una semana desde el inicio del uso del fármaco. En pacientes con un alto riesgo de nefrotoxicidad evolucionan rápidamente, con un aumento importante de la creatinina sérica. En estos casos, se recomienda cambiarla por otras formulaciones menos tóxicas u otras clases diferentes de agentes antifúngicos, particularmente equinocandinas y voriconazol. En los casos en los que no hay alternativa al uso de anfotericina desoxicolato, se recomienda aumentar el tiempo de infusión, con una adecuada prehidratación (500 a 1000 ml), seguimiento y corrección posterior de las alteraciones hidroelectrolíticas como medidas preventivas del desarrollo de IRA. Aunque la recuperación de la función renal es común después de algunas semanas tras la interrupción del fármaco, la incidencia de IRA grave se estima en torno al 10% y se asocia con un mayor riesgo de mortalidad18.
- Polimixinas (colistina)
Antibióticos usados para bacterias gramnegativas multirresistentes, asocian una incidencia de IRA de hasta el 60%, a menudo acompañada de hipopotasemia e hipomagnesemia. El mecanismo lesional implica un aumento de la permeabilidad de la pared celular y el consiguiente edema y lisis celular, sobre todo en el túbulo contorneado proximal.
A pesar del buen pronóstico renal después de la interrupción del tratamiento, a menudo esto no ocurre debido a la necesidad de completar ciclos largos para alcanzar tratamiento adecuado de la infección. En algunos de estos casos la evolución a la lesión renal es tan grave que requiere terapia de reemplazo renal. No existe un tratamiento específico para este tipo de nefrotoxicidad, por lo que la recomendación es controlar y corregir los trastornos hidroelectrolíticos y priorizar el tratamiento de la infección, ajustando en todo momento la dosis de colistina según la función renal18.
- Contraste yodado
La lesión renal aguda por contraste yodado se define por un aumento en la creatinina sérica de al menos 0.3 mg/dl a las 48 horas o 50 % por encima de la basal durante los siguientes siete días o por reducción de volumen urinario de 0,5 ml/kg/h durante 6 horas. Sin embargo, esta definición no comprende el llamado daño subclínico que se caracteriza por una lesión estructural sin elevación de la creatinina. Cuando existe afectación renal, la pérdida del filtrado glomerular se compensa por nefronas intactas de manera que no se eleva la creatinina. Sin embargo, la reparación completa y la vuelta a la condición basal no está garantizada.
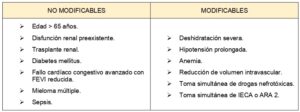
Este deterioro ocurre en menos del 1% de la población general sana, en más del 5% de pacientes con insuficiencia renal y si a ello se asocia diabetes se describen cifras cercanas al 20 %. La incidencia de lesión renal aguda en pacientes con cáncer es mayor que en la población general. Se han identificado factores de riesgo para presentar nefropatía inducida por contraste yodado (Tabla 3).
Todos los medios de contraste se eliminan únicamente por filtración glomerular. La excreción extrarrenal constituye menos del 1% de la función renal normal. Se ha demostrado que aproximadamente el 100% de los medios de contraste se excretan dentro de las primeras 24 horas después de la administración en pacientes con función renal suficiente. Por el contrario, en pacientes con función renal reducida, la semivida de eliminación puede aumentar hasta 40 horas o más.
Aunque el mecanismo de la lesión renal aguda inducida por contraste no se entiende completamente, los datos de modelos animales indican que varios factores intervienen en el impacto de la hiperosmolalidad en la función renal, incluyendo:
- Efecto diurético que estimula un mecanismo de retroalimentación túbulo-glomerular, que conduce a una menor tasa de filtración glomerular y un empeoramiento de la función renal.
- Reducción del flujo sanguíneo renal debido a alteraciones de la vasoconstricción mediadas por adenosina, endotelina y óxido nítrico.
- Morfología alterada de los eritrocitos que conduce a una disminución de la perfusión capilar.
En las guías KDIGO, se recomienda retrasar la exposición repetida durante 48 h en pacientes sin factores de riesgo para lesión renal aguda inducida por contraste y durante 72 h en aquellos con diabetes mellitus o ERC preexistente. Si se desarrolla una disfunción renal aguda después de la administración de contraste, la exposición repetida preferiblemente debe retrasarse hasta que el nivel de creatinina sérica haya regresado al valor basal.
Las medidas de prevención aconsejables para evitar la nefrotoxicidad asociada al contraste yodado son las siguientes:
- Una correcta hidratación (sería la medida más relevante).
- Reducción de eventuales nefrotóxicos concomitantes.
- Recomendación de utilización de contraste isosmolar.
Un muy reciente estudio (Preserve) ha demostrado que, entre los pacientes con alto riesgo de complicaciones renales sometidos a angiografía, no hubo beneficio con bicarbonato sódico intravenoso sobre cloruro sódico intravenoso o de acetilcisteína oral sobre placebo para la prevención de muerte, necesidad de diálisis o disminución persistente de la función renal a los 90 días o para la prevención de la lesión renal aguda asociada al contraste19.
- Hierbas medicinales
En los últimos años, ha habido un crecimiento a nivel mundial en el uso de tratamientos alternativos, incluyendo hierbas medicinales. Desafortunadamente, muchas plantas contienen sustancias tóxicas para el riñón.
Desde 1993 varios informes documentan la existencia de una enfermedad grave en la población infantil rápidamente progresiva que llevó a la enfermedad renal terminal en mujeres que habían tomado píldoras dietéticas que contenían en su composición hierbas chinas. Esta llamada nefropatía de hierbas chinas se caracterizó por una fibrosis extensa del intersticio renal por un agente tóxico que se cree que es ácido aristolóquico. Alrededor del 50% de los pacientes con enfermedad renal terminal debido a la nefropatía de hierbas chinas también desarrollaron cánceres uroteliales, mientras que otros debutaron con enfermedad cardíaca valvular.
Es de especial interés preguntar específicamente a los pacientes sobre el uso de medicamentos alternativos, sobre todo si presentan datos de insuficiencia renal inexplicable por otras causas. Debemos tener en cuenta que los pacientes a menudo no consideran terapias alternativas cuando se les pregunta acerca de los fármacos que toman habitualmente durante, por ejemplo, en la visita preanestésica20.
Conclusiones
La investigación biomédica da lugar a la aparición de fármacos cada vez más eficaces con diferentes mecanismos de acción. Estos tratamientos cuentan con diversos efectos secundarios, algunos ya conocidos y otros en estudio, siendo la nefrotoxicidad uno de los más comunes y con mayor morbimortalidad.
Dado que, hasta ahora, la tecnología no ha creado medicamentos perfectos exentos de efectos adversos, la prioridad en los casos de nefrotoxicidad se basa en el conocimiento de las poblaciones de riesgo, el diagnóstico precoz, y la adopción de medidas que puedan minimizar el daño renal.
El pronóstico de los pacientes con daño renal asociado a fármacos mejorará con la aplicación temprana de medidas básicas como la corrección y ajuste de las dosis según la función renal, la minimización de los fármacos no esenciales y el estudio de las interacciones tóxicas.
Debe evaluarse reemplazar los fármacos nefrotóxicos por otros similares y menos dañinos, reducir la duración del tratamiento cuando sea posible, controlar tanto los niveles séricos como la corrección de la hipovolemia y los trastornos hidroelectrolíticos, así como investigar otras causas posibles de enfermedad renal para poder obtener un diagnóstico certero y orientar mejor el manejo terapéutico posible.
Bibliografía
- Kane-Gill SL, Goldstein SL. Drug-induced acute kidney injury: a focus on risk assessment for prevention. Crit Care Clin. 2015;31(4):675-84. (PubMed)
- Perazella MA. Pharmacology behind common drug nephrotoxicities. Clin J Am Soc Nephrol. 2018;13(12):1897-908. (PubMed)
- Awdishu L, Mehta RL. The 6R’s of drug induced nephrotoxicity. BMC Nephrol. 2017;18(1):124. (BMC)
- Griffin BR, Faubel S, Edelstein CL. Biomarkers of drug-induced kidney toxicity. Ther Drug Monit. 2019;41(2):213-26. (PubMed)
- Caires RA, Silva VT, Burdmann E, Coelho FO, Costalonga EC. Drug-induced acute kidney injury. In: Ronco C, Bellomo R, Kellum JA, Ricci Z, eds. Critical care nephrology. 3rd ed. Philadelphia: Elsevier; 2019. p.214-21. (HTML)
- Conzen PF, Kharasch ED, Czerner SF, Artru AA, Reichle FM, Michalowski P, Rooke GA, Weiss BM, Ebert TJ. Low-flow sevoflurane compared with low-flow isoflurane anesthesia in patients with stable renal insufficiency. Anesthesioly 2002; 97: 578-84. (PubMed)
- Withington DE, Decell MK, Al Ayed T. A case of propofol toxicity: further evidence for a causal mechanism. Paediatr Anaesth 2004; 14: 505-8. (PubMed)
- Lee HT, Xu H, Siegel CD, Krichevsky IE. Local anesthetics induce human renal cell apoptosis. Am J Nephrol 2003; 23: 129-39. (HTML)
- Tuncer S, Bariskaner H, Yosunkaya A, Kilic M, Dogan N, Otel- cioglu S. [The effects of sufentanyl and remifentanyl in the iso- lated perfused rat kidney]. Agri 2004; 16: 56-61. (HTML)
- Della Rocca G, Pompei L, Coccia C, Costa MG, Cecchini V, Vilardi V, Pietropaoli P. Atracurium, cisatracurium, vecuronium and rocuronium in patients with renal failure. Minerva Anestesiol 2003; 69: 605-11, 612, 5. (HTML)
- Chuanyao T, James CE. Adrenergic Agonists α2. Med Clin North Am 1994; 1: 51. (PubMed)
- Bolon M, Boulieu R, Flamens C, Paulus S, Bastien O. [Sedation induced by midazolam in intensive care: pharmacologic and pharmacokinetic aspects]. Ann Fr Anesth Reanim 2002; 21: 478-92. (PubMed)
- Bakhriansyah M, Souverein PC, van den Hoogen MWF, de Boer A, Klungel OH. Risk of nephrotic syndrome for non-steroidal anti-inflammatory drug users. Clin J Am Soc Nephrol. 2019;14(9):1355-62. (PubMed)
- Balci C, Uzun Ö, Arici M, Hayran SA, Yüce D, Ünal S. Nephrotoxicity of piperacillin-tazobactam combined with vancomycin: should it be a concern? Int J Antimicrob Agents. 2018;52(2):180-4. (PubMed)
- Molitoris BA. Manifestations of and risk factors for amino- glycoside nephrotoxicity. UpToDate. 2017. Available from: https://www.uptodate.com/contents/ manifestations-of-and-risk-factors-for-aminoglycoside-nephrotoxicity.
- Malyszko J, Kozlowska K, Kozlowski L, Malyszko J. Nephrotoxicity of anti- cancer treatment. Nephrol Dial Transplant. 2017;32(6):924-36. (HTML)
- Howard SC, McCormick J, Pui CH, Buddington RK, Harvey RD. Pre- venting and managing toxicities of high-dose methotrexate. Oncologist. 2016;21(12):1471-82. (PubMed)
- RigattoMH, OliveiraMS, Perdigão-NetoLV, LevinAS, CarrilhoCM, Tanita MT, et al. Multicenter prospective cohort study of renal failure in patients treated with colistin versus polymyxin B. Antimicrob Agents Chemother. 2016;60(4):2443-9. (PubMed)
- Andreucci M, Solomon R, Tasanarong A. Side effects of radiographic contrast media: pathogenesis, risk factors, and prevention. Biomed Res. Int. 2014;2014:741018. (PMC)
- Cosyns JP, Jadoul M, Squifflet JP, Wese FX, Van Ypersele de Strihou C. Urothelial lesions in Chinese herbs nephropathy. Am J Kidney Dis 1999;33:1011–1017. (PubMed)