Fuentes A (1), Plasencia J (2), Mouhaffel N (3), García -Medina N (3)
(1) FEA en Anestesiología y Reanimación. Hospital de Terrassa. Consorci Sanitari de Terrassa.
(2) FEA en Cardiología. Hospital de Terrassa. Consorci Sanitari de Terrassa.
(3) MIR en Anestesiología y Reanimación. Hospital de Terrassa. Consorci Sanitari de Terrassa.
Introducción
El término de síndrome de Takotsubo (STK) fue introducido por primera vez en la literatura médica en Japón en 1990. En occidente los primeros casos publicados datan de finales de la década de los noventa. Desde el año 2005 esta entidad ha sido más reconocida y estudiada, pero continúa siendo un tipo de cardiomiopatía infradiagnosticada(1).
Su aparición en el periodo perioperatorio puede pasar desapercibida o manifestarse con una clínica diferente a la habitual en el paciente no quirúrgico. En el intraoperatorio suele presentarse con cuadros de hipotensión, shock o arritmias.
Presentamos un caso de STK medio ventricular, que se expresó intraoperatoriamente en forma de hipotensión y arritmias graves, en una paciente con factores predisponentes previos y con un probable desencadenante farmacológico intraoperatorio (administración de fármacos adrenérgicos).
Caso clínico
Paciente de 72 años, sin alergias conocidas propuesta para histerectomía laparoscópica por carcinoma de endometrio. Con antecedentes de obesidad, dislipemia, hipertensión arterial, diabetes mellitus tipo 2, accidente vascular cerebral (AVC) y trastorno de ansiedad con claustrofobia.
La evaluación preoperatoria mostró una analítica general, electrocardiograma (ECG) y radiografía de tórax normales, y un ecocardiograma transtorácico (ETT) con signos de cardiopatía hipertensiva (hipertrofia septal basal).
Se realizó la inducción anestésica con midazolam 2 mg, fentanilo 100 mcg, propofol 180 mg y rocuronio 60 mg. Se utilizó monitorización estándar con ECG, tensión arterial incruenta, pulsioximetría y capnografía. Se realizó mantenimiento anestésico mediante técnica balanceada con sevofluorano. La paciente presentó hipotensión arterial progresiva que se agravó con la instauración del neumoperitoneo (con visión directa de entrada de los trócares, sin evidenciarse lesión vascular), pasando de cifras tensionales de 120/70 mmHg a cifras de 60/40 mmHg, sin variaciones significativas en la frecuencia cardiaca que osciló entre 65 y 75 latidos por minuto (l.p.m).
Se infundieron 2 bolos de efedrina de 6 mg cada uno y fluidoterapia sin respuesta hemodinámica, por lo que se administró un bolo de fenilefrina de 100 mcg. A los pocos segundos, presentó en la pantalla del ECG extrasístoles ventriculares multifocales frecuentes que se transformaron en una taquicardia ventricular autolimitada y posteriormente en una taquiarrítmia supraventricular a 160 l.p.m. Se administró un bolo de labetalol de 10 mg sin respuesta, pasando a la administración de dos bolos espaciados de esmolol de 500 mcg/kg en 1 minuto, reduciéndose así la frecuencia cardiaca hasta los valores basales de 65 l.p.m. Posteriormente, se administró una dosis de carga de amiodarona de 300 mg.
Dada la gravedad de los trastornos del ritmo cardiaco y la inestabilidad hemodinámica se decidió suspender la intervención.
La paciente fue extubada sin complicaciones y pasó a la unidad de reanimación para completar el estudio.
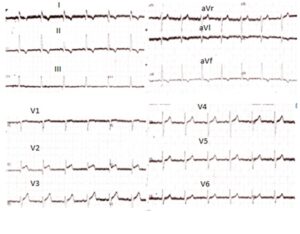
Se realizó un ECG de 12 derivaciones (figura 1) que mostraba elevación del segmento ST de 2 mm en V2 y V3 y T negativas en derivaciones de miembros.
En la analítica se apreciaba una hemoglobina de 11.3 g/dL, hematocrito 36,6 % , ionograma y función renal normales. Troponina T 58.89 ng/L (0 – 14) con pico máximo posterior de 179,1 ng/L y Creatin kinasa 30.6 UI/L (valores normales).
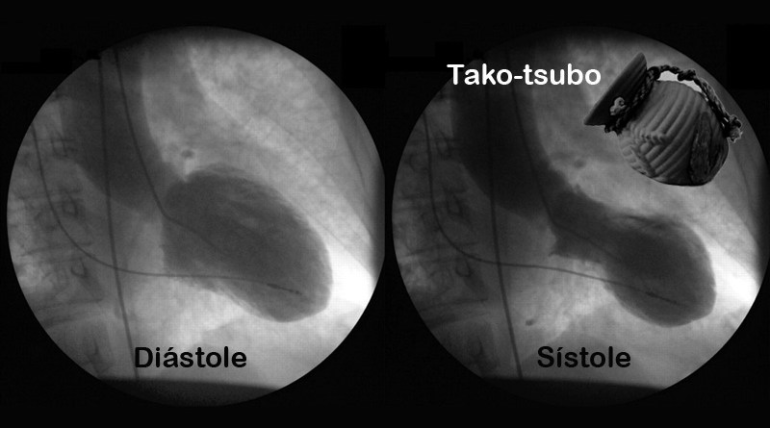
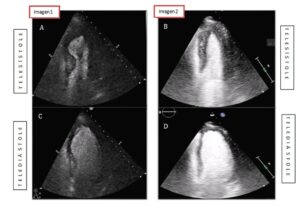
Ante la sospecha inicial de síndrome coronario agudo con elevación del segmento ST (SCACEST) se solicitó un ETT urgente al servicio de cardiología (figura 2, imagen 1, A y C), que informaba de discinesia septal (flecha) y anterior en segmento medio, con una hipercontractilidad del resto de segmentos, manteniendo una función sistólica global preservada (Anexo, material adicional, vídeo, imagen izquierda).
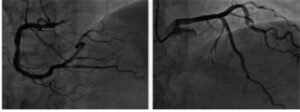
Se activó el código de infarto agudo de miocardio (IAM) y se trasladó al centro de referencia para realizar una coronariografía urgente, que no mostró ningún tipo de lesión (figura 3).
Se inició tratamiento antiagregante con ácido acetilsalicílico, betabloqueantes e inhibidores de la enzima convertidora de la angiotensina, permaneciendo la paciente asintomática y siendo trasladada a la planta de hospitalización.
La presunción diagnóstica inicial fue de IAM sin lesiones coronarias obstructivas (MINOCA, del acrónimo en inglés).
A los 7 días se repitió el ETT que mostró una marcada mejoría de la función ventricular segmentaria, con práctica normalización de ésta, quedando un ligero movimiento anómalo y contracción post-sistólica focal a nivel del septo anterior medio. Persistía una función sistólica global preservada (figura 2, imagen 2, B y D) (Anexo, material adicional, vídeo, imagen derecha).
Ante los hallazgos de la segunda ETT se orientó el caso como síndrome de Takotsubo medio ventricular en el contexto perioperatorio.
La paciente permaneció asintomática pudiendo ser intervenida un mes después, mediante histerectomia total y anexectomia bilateral laparoscópica, sin incidencias ni complicaciones.
Discusión
Hasta un 10% de los pacientes con IAM con elevación del segmento ST no presentan lesiones coronarias obstructivas (2).
El diagnóstico de MINOCA es funcional e incluye causas como el IAM tipo II, la disección, el embolismo o el espasmo coronarios, la miocarditis y el STK (2).
El STK hace referencia a un síndrome caracterizado por una disfunción transitoria del ventrículo izquierdo (VI) sin evidencia de enfermedad coronaria obstructiva (3,4).
La incidencia del STK se estima que es alrededor del 1.7%-2.2% de todos los pacientes con sospecha de síndrome coronario agudo (SCA) y que son finalmente diagnosticados de STK(5).
En cuanto a la fisiopatología del STK, es compleja e involucra al eje “sistema nervioso central –corazón”, el cual todavía no es del todo comprendido. Tanto los estresores emocionales como físicos actúan sobre este eje produciendo en última instancia una liberación de catecolaminas(5).
La excesiva estimulación adrenérgica y los niveles altos de catecolaminas producen un daño directo de los miocitos y causan una disfunción microvascular transitoria (6,7).
Los niveles plasmáticos de catecolaminas en casos de STK son de dos a 3 veces superiores a los casos de SCA, hecho que sugiere que sea el mecanismo primario subyacente (7). Estos niveles elevados producen disfunción transitoria y reversible del VI.
En el periodo perioperatorio diferentes factores pueden favorecer un estado hipercatecolaminérgico: estrés por miedo/ansiedad a la cirugía, maniobras que provocan estimulación del sistema simpático, un inadecuado plano anestésico, la administración exógena de catecolaminas, cuadros de anafilaxia (síndrome de Kounis), hipovolemia, acidosis o el uso de ergotamínicos (4, 7).
Aparece con mayor frecuencia con la anestesia general que con las técnicas locorregionales o de sedación(4), y es más frecuente en mujeres que en hombres.
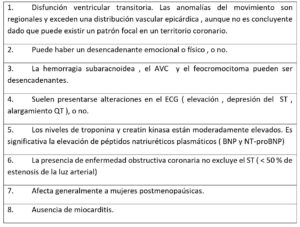
En cuanto al diagnóstico, hay diferentes guías. En este artículo hemos seguido los criterios diagnósticos internacionales de Takotsubo (tabla 1) (1,2).
La presentación clínica del STK en el periodo perioperatorio será más frecuentemente en forma de arritmias, insuficiencia cardiaca, hipotensión, shock o parada cardiorrespiratoria(7).
Los biomarcadores como los péptidos natriuréticos plasmáticos (BNP y NT-proBNP) aumentan mucho más que los niveles de troponinas (cuyos valores pico son inferiores a los que se presentan en el SCA) y parecen de más utilidad en el apoyo diagnóstico del STK(5,9).
La prueba de imagen de primera línea es la ecografía (transtorácica o transesofágica) que nos informa de forma rápida de la función ventricular y de las posibles alteraciones regionales de la movilidad de la pared del VI. Además, nos puede informar de la presencia de una obstrucción dinámica del tracto de salida del VI y/o insuficiencia mitral, lo que puede condicionar el manejo terapéutico y los resultados pronósticos (8).
El tratamiento es sintomático de las posibles complicaciones que vayan apareciendo; en caso de necesidad de soporte inotrópico, el levosimendán podría ser una buena alternativaen determinadas situaciones (9,10).
En el caso presentado, se dieron factores predisponentes para la aparición del STK, como la morbilidad preexistente (postmenopausia, cardiopatía hipertensiva), el estrés físico y emocional (trastorno de ansiedad), el estrés provocado por la propia intervención (cirugía laparoscópica) y probablemente una causa desencadenante farmacológica determinante (el uso de efedrina y fenilefrina), por la cronología en la aparición de las arritmias graves.
La clínica, los hallazgos ecocardiográficos y angiográficos, así como la discreta elevación de los biomarcadores de daño miocárdico, son compatibles con el STK.
Se trata de la variante medio ventricular, la segunda en frecuencia de presentación después de la apical, donde la aquinesia se confina a los segmentos medios quedando preservados los segmentos apicales (8).
En nuestro caso el uso de beta bloqueantes consiguió revertir la taquiarritmia debido a un probable estrés farmacológico adrenérgico. También creemos que el cese del neumoperitoneo de la laparoscopia contribuyó a estabilizar hemodinámicamente a la paciente.
A pesar de que el STK es un proceso reversible, durante la fase aguda la inestabilidad eléctrica y hemodinámica exponen a los pacientes a un riesgo elevado de complicaciones, que pueden ocurrir hasta en un 20 % de los casos (9), alcanzando tasas de morbimortalidad superiores o al menos similares a los pacientes con síndrome coronario agudo (10).
La cardiomiopatía de Takotsubo inducida por el estrés perioperatorio (comorbilidad, factores anestésicos y quirúrgicos) sigue siendo una condición poco conocida, potencialmente letal y su manejo en este contexto puede suponer un desafío.
Creemos que el STK se ha de integrar dentro del diagnóstico diferencial de las posibles causas de un deterioro clínico súbito en el periodo perioperatorio (sobre todo si se presentan hipotensión y arritmias graves).
Anexo. Material adicional
Bibliografía
1- Ghadri JR, Wittstein IS, Prasad A, Sharkey S, Dote K, Akashi YJ et al. International Expert Consensus Document on Takotsubo Syndrome (Part I): Clinical Characteristics, Diagnostic Criteria, and Pathophysiology. Eur Heart J. 2018;39(22):2032-2046. doi:10.1093/eurheartj/ehy076 (PubMed)
2- Yamel Ache, Carlos Guamán, Lorena Viñole, Gustavo Vignolo. Infarto agudo de miocardio sin lesiones coronarias obstructivas – MINOCA : un enigma para el cardiólogo clínico. Rev Urug Cardiol 2020; 35:77-86. doi.org/10.29277/cardio.35.1.11 (HTML)
3- Agarwal S, Sanghvi C, Odo N, Castresana MR. Perioperative takotsubo cardiomyopathy: Implications for anesthesiologist. Ann Card Anaesth. 2019;22(3):309-315. doi:10.4103/aca.ACA_71_18 (PubMed)
4- Agarwal S, Bean MG, Hata JS, Castresana MR. Perioperative Takotsubo Cardiomyopathy: A Systematic Review of Published Cases. Semin Cardiothorac Vasc Anesth. 2017 Dec;21(4):277-290. doi: 10.1177/1089253217700511 (PubMed)
5- Gupta S, Gupta MM. Takotsubo syndrome. Indian Heart J. 2018 Jan-Feb;70(1):165-174. doi: 10.1016/j.ihj.2017.09.005 (PubMed)
6- Hessel EA 2nd. Takotsubo cardiomyopathy and its relevance to anesthesiology: a narrative review. Can J Anaesth. 2016 Sep;63(9):1059-74. English. doi: 10.1007/s12630-016-0680-4 (HTML)
7- Jothin A, Raj JP, Thiruvenkatarajan V. A simple procedure in a complex patient: perioperative takotsubo cardiomyopathy. BMJ Case Rep. 2020 Dec 17;13(12):e233121. doi: 10.1136/bcr-2019-233121 (PubMed)
8- Citro, R, Okura, H, Ghadri, J, Izumi C, Meimoun P, Izumo M, et al. Multimodality imaging in takotsubo syndrome: a joint consensus document of the European Association of Cardiovascular Imaging (EACVI) and the Japanese Society of Echocardiography (JSE). J Echocardiogr 18, 199–224 (2020). https://doi.org/10.1007/s12574-020-00480-y (PubMed)
9- Ghadri JR, Wittstein IS, Prasad A, Sharkey S, Dote K, Akashi YJ, et al. International Expert Consensus Document on Takotsubo Syndrome (Part II): Diagnostic Workup, Outcome, and Management. Eur Heart J. 2018;39(22):2047-2062. doi:10.1093/eurheartj/ehy077 (PubMed)
10-Moscatelli S, Montecucco F, Carbone F, Valbusa A, Massobio L, Porto I, et al. An Emerging Cardiovascular Disease: Takotsubo Syndrome. Biomed Res Int. 2019;2019:6571045 doi.org/10.1155/2019/6571045. (PubMed)