Rodríguez Porras E (1), Serón Ardananz E (1), Guerrero Domínguez R (2)
(1) MIR Anestesiología y Reanimación. Hospital Universitario Virgen del Rocío, Sevilla.
(2) FEA Anestesiología y Reanimación. Hospital Universitario Virgen del Rocío, Sevilla.
Resumen
El síndrome de Anderman es una neuropatía sensitivo-motora desmielinizante progresiva hereditaria, de carácter autosómico recesivo, debida a una mutación del gen SLC12A6, encargada de la síntesis del cotransportador K-Cl que parece ser necesaria para el desarrollo y sustento del tejido nervioso. Estos pacientes presentan un fenotipo de facies dismórfica con hipertelorismo y braquicefalia, arreflexia generalizada, amiotrofia y contracturas musculares severas. Las comorbilidades asociadas y las peculiaridades anatómico-funcionales pueden condicionar el manejo perioperatorio suponiendo un reto para el anestesiólogo. A propósito de un caso realizaremos una revisión de este síndrome, remarcando los puntos que consideramos importantes, con el objetivo de que sirvan a otros anestesiólogos como referencia a la hora de enfrentarse a estos pacientes.
Presentación del caso
El síndrome de Anderman es una neuropatía sensitivo-motora desmielinizante progresiva hereditaria, de carácter autosómico recesivo, debida a una mutación del gen SLC12A6 (1). Se describió en la población franco-canadiense de Quebec, con una frecuencia de 1:2000 recién nacidos vivos, siendo excepcional en el resto del mundo. El gen SLC12A6 se encarga de la síntesis del cotransportador K-Cl, cuya función no es bien conocida, pero parece ser necesaria para el desarrollo y sustento del tejido nervioso. Los pacientes que presentan esta neuropatía suelen asociar agenesia del cuerpo calloso. En la exploración destacan arreflexia generalizada, amiotrofia y contracturas musculares severas, facies dismórfica con hipertelorismo y braquicefalia, así como retraso cognitivo (2).
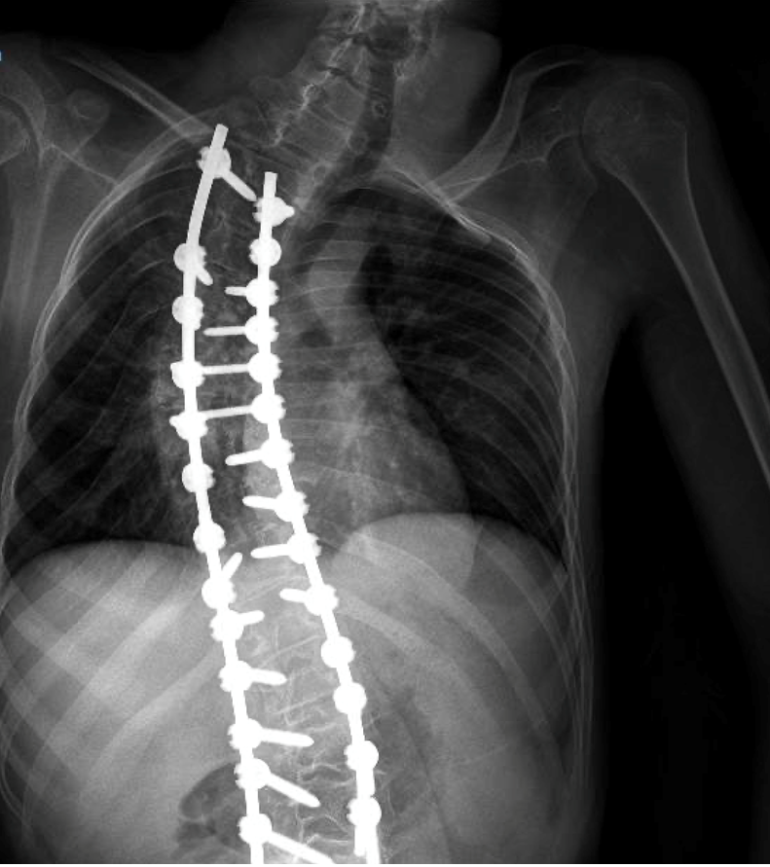
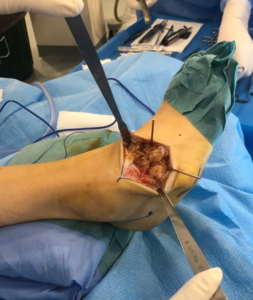
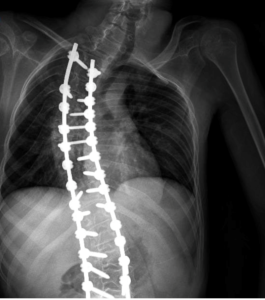
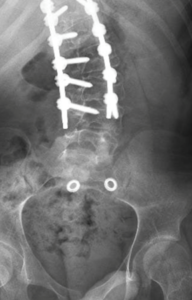
Presentamos el caso de un varón de 16 años de edad y 40Kg con diagnóstico de Síndrome de Anderman. Se programó para realizar cirugía electiva para remodelación de pie equino-varo bilateral (Imagen 1). Dentro de sus antecedentes personales presentaba síndrome de apnea-hipoapnea obstructiva del sueño en tratamiento con CPAP, ataxia cerebelosa y arreflexia generalizada, afectación de la deglución con episodios de atragantamiento, escoliosis secundaria a contracturas musculares, intervenida quirúrgicamente (imagen 2y 3) y deterioro de la función respiratoria asociada a escoliosis y atrofia muscular con mal manejo de secreciones.
A la exploración pudimos objetivar fascies dismórfica con limitación de la apertura bucal, rigidez articular con restricción de la extensión, flexión y lateralización de cuello. Dado los predictores de vía aérea difícil se preparó material adecuado.
A su llegada a quirófano fue monitorizado mediante electrocardiograma (ECG), frecuencia cardiaca (FC), presión arterial no invasiva (PANI), saturación periférica de oxígeno (spO2), índice biespectral (BIS), y temperatura (a través de sonda vesical termometrada). Se colocó manta térmica de cuerpo completo y calentador de fluidos como medidas contra la hipotermia. Previamente a la inducción suministramos Ranitidina 50 mg IV y metoclopramida 10 mg IV.
Tras preoxigenación procedimos a la inducción anestésica de secuencia rápida con 100 mcg de fentanilo, 130 mg de propofol y 60 mg de rocuronio. La intubación fue realizada con videolaringoscopio Glidescope con tubo nº 7 flexometálico. Tras comprobar la ventilación bipulmonar, se conectó a ventilación mecánica en modo control volumen (volumen tidal de 6ml/kg, PEEP de 5 mmH2O, y frecuencia respiratoria en torno a 12-14 para mantener un etCO2 de 35-40 mmHg)
El mantenimiento anestésico fue llevado a cabo con desflurano CAM 0.8-1, remifentanilo en perfusión continua (0,05-0,15 mcg/kg/min) y fentanilo en bolos (dosis total 300 mcg). Se administró metilprednisolona 80 mg junto con omeprazol 40 mg como profilaxis gástrica y 500 mg de ácido tranexámico para minimizar sangrado intraoperatorio.
Procedimos a rescate analgésico con paracetamol 1 g y dexketoprofeno 50 mg, así como ondansetrón 4 mg para profilaxis antiemética. Al finalizar la intervención, el bloqueo neuromuscular fue revertido con 200 mg de sugammadex y pudo ser extubado sin incidencias.
La intervención concluyó sin complicaciones, manteniendo spO2 por encima del 95% y estabilidad hemodinámica con presión arterial media entorno a +/- 20% de los valores basales (presión arterial inicial 125/75 mmHg, frecuencia cardiaca 75 lpm). También mantuvo normotermia entorno 36-36.5ºC durante toda la cirugía.
Posteriormente fue trasladado a la unidad de recuperación postanestésica, donde se realizó bloqueo epidural caudal con 15 ml de ropivacaína 0.3%. Durante su estancia hospitalaria no presentó incidencias quirúrgicas-anestésicas, con control óptimo del dolor y consiguiendo alta precoz al domicilio.
Discusión
En el abordaje del Síndrome de Anderman nos encontramos con una serie de consideraciones anatómico – funcionales que hacen peculiar el manejo perioperatorio de estos pacientes. Por ello lo aconsejable es realizar una individualización del abordaje anestésico.
PREOPERATORIO
Es recomendable realizar una evaluación anestésica exhaustiva para detectar las afectaciones extramusculares.
Desde el punto de vista respiratorio, se debe valorar la función respiratoria realizando pruebas funcionales respiratorias y radiografía de tórax, además de explorar si presentan o no apneas del sueño, o si ya son conocidas y realizan tratamiento con CPAP domiciliaria (importante indicar que deben traerse la máquina cuando ingrese).
Asimismo, es necesario realizar una minuciosa exploración de la vía aérea y detección de factores predictores de vía aérea difícil (fascies dismórfica, retrognatia, micrognatia, cuello corto, alteraciones en la movilización cervical…) con el objetivo de establecer un plan para el abordaje de la misma. Otro punto de gran importancia es la evaluación de la afectación de la musculatura deglutoria (si son capaces de deglutir líquidos/sólidos, cómo maneja secreciones), así como contabilizar los episodios de broncoaspiraciones en los últimos meses y si requirieron ingreso hospitalario. Esto es importante dado que tras la inducción anestésica aumentará el riesgo de producirse regurgitaciones y broncoaspiraciones, por lo que es primordial el ayuno y la profilaxis de las mismas.
Desde el punto de vista nutricional, se valorará si presentan desnutrición que precise de interconsulta a endocrinología para optimización. Esto es importante dado que el objetivo será reducir el riesgo de infección de herida quirúrgica entre otras complicaciones.
Estos pacientes presentan ya de base atrofia muscular con déficit de movilidad por lo que es crucial la profilaxis de trombosis venosa y la toma de medidas para evitar el empeoramiento de la misma (rehabilitación hospitalaria muscular, rehabilitación respiratoria para evitar empeoramiento de la mecánica ventilatoria y manejo de secreciones etc).
INTRAOPERATORIAMENTE
De cara a la monitorización, debe usarse ECG, FC, PANI, SpO2, monitorización del bloqueo neuromuscular y BIS para ajuste de dosis de hipnóticos. En función del tipo de intervención y las comorbilidades se podría valorar añadir monitorización avanzada de forma individualizada (presión arterial invasiva, monitorización del gasto cardiaco, oximetría cerebral…).
Debido a las alteraciones anatómicas de la vía aérea debe asumirse dificultades en su manejo, por lo que es preciso preparar el material y los dispositivos necesarios con anterioridad. Además, debido a las abundantes secreciones se recomienda la instauración de profilaxis de broncoaspiración y la realización inducción de secuencia rápida o intubación en paciente despierto y posición sentada con fibrobroncoscopio.
Hay que tener en cuenta que la respuesta a los fármacos usados comúnmente en anestesia es diferente, por lo que hay que tener en mente una serie de consideraciones. En primer lugar, no existen a priori motivos para recomendar un tipo de hipnótico más que otros, sino adecuarlos en función de la situación hemodinámica. De cara al mantenimiento es importante valorar en función de las comorbilidades específicas del paciente, pero parece razonable el empleo de TIVA con propofol por su potencial beneficio antiemético. Respecto a los bloqueantes neuromusculares (BNM), en los pacientes con denervación motora, como el caso previamente descrito, cabría esperar una mayor resistencia a los BNM no despolarizantes secundaria a la proliferación de receptores nicotínicos inmaduros fuera de la placa neuromuscular. Esto aumentaría presumiblemente la dosis requerida de BNM no despolarizantes y favorecería el desarrollo de una hiperpotasemia en caso de uso de la succinilcolina (3). Por ello es recomendable evitar BNM despolarizantes y sería de gran utilidad la monitorización del bloqueo neuromuscular.
POSTOPERATORIO
Estos pacientes presentan basalmente un riesgo elevado de broncoaspiración por afectación de la musculatura deglutoria. Por este motivo, es primordial realizar un plan anestésico-analgésico que minimice la aparición de náuseas y vómitos postoperatorios. La estrategia analgésica recomendable es la analgesia multimodal, empleando infiltración con anestesia local, analgesia multimodal intravenosa, bloqueos de nervios periféricos ecoguiados o bloqueo neuroaxial, si la cirugía y el paciente lo permiten. El objetivo es evitar o minimizar la administración de opioides, ya que dentro de sus efectos secundarios se encuentran las náuseas y vómitos.
A la hora de utilizar anestésicos locales, se recomienda escoger el perfil de fármaco menos neurotóxico y a las menores dosis teniendo en cuenta que los nervios desmielinizados van a requerir menor cantidad de fármacos para conseguir una impregnación óptima. Además, se precisa un ajuste de dosis dada la predisposición a un bloqueo más prolongado. Cabe destacar, en relación a los bloqueos de nervios periféricos, que deben ser realizados con abordaje ecoguiado evitando el uso de neuroestimulador dado que al ser nervios dañados presentarán un umbral de estimulación mayor. Por tanto, en caso de requerirse, se deberá intentar minimizar el tiempo de exposición a la misma para minimizar el riesgo de traumatización del nervio (4).
Teniendo en cuenta estas consideraciones y recomendaciones, en la medida de lo posible sería de elección una técnica anestésica locorregional exclusivamente. De esta manera se reducirían los riesgos de complicaciones por fármacos utilizados en la anestesia general y durante el manejo de la vía aérea.
En nuestro caso, se podría haber optado por el uso de catéter epidural como técnica anestésica y analgésica postquirúrgica, dada la escasa colaboración del paciente y presumibles dificultades técnicas por morfología de la columna del paciente y la instrumentación de la misma, optamos finalmente por una anestesia general con bloqueo epidural caudal, ajustando dosis.
Conclusión
Mediante este caso, con nuestra experiencia y dada la escasa literatura existente, exponemos el manejo anestésico perioperatorio aportando una serie de recomendaciones que puedan ser de utilidad para cualquier anestesiólogo.
Bibliografía
- Kılıç ET, Akçay ME, Akdemir MS, Atağ E, Gürsu O. Anesthetic management in corpus callosum agenesis. Anesth Essays Res. 2018;12(3):758–60. (PubMed)
- Andermann syndrome [Internet]. Medlineplus.gov. [citado el 14 de junio de 2021]. Disponible en: https://medlineplus.gov/genetics/condition/andermann-syndrome/
- Forés B, Manzano A, Urrengoetxea P, Aguilera L. Anestesia en el paciente con patología neuromuscular [Internet]. Gac Med Bilbao. 2006. [mayo 2021]. Disponible en: http://gacetamedicabilbao.eus/index.php/gacetamedicabilbao/article/viewFile/428/436
- Santos Martín L, Escudero Padial E. Anestesia locorregional en enfermedades del nervio periférico. Rev Elect AnestesiaR [Internet]. 5 de septiembre de 2016 [citado 21 de diciembre de 2021];9(1):4. Disponible en: http://revistaanestesiar.org/index.php/rear/article/view/80