Cocho Crespo S (1), Martínez-Almeida Castañeda I (1), del Rey de Cabo C (2)
(1) Licenciada especialista en anestesiología, reanimación y terapéutica del dolor. Hospital Clínico Universitario de Valladolid.
(2) Licenciada especialista en anestesiología, reanimación y terapéutica del dolor. Complejo Asistencial de Zamora.
Introducción
Nuestra paciente fue una mujer de 35 años, sin alergias conocidas, con un cuadro sindrómico no filiado genéticamente que incluía trombocitopenia congénita (Síndrome de plaqueta gris), anemia microcítica, retinitis pigmentaria y retraso psicomotor. Ingresó por derrame pericárdico e insuficiencia cardíaca de predominio derecho, detectándose insuficiencia mitral congénita masiva, comunicación interauricular (CIA) tipo ostium secundum con shunt izquierda derecha e insuficiencia tricuspídea que precisaba tratamiento quirúrgico.
La analítica previa a su llegada a quirófano incluía una hemoglobina de 6’5 gr/dL y una cifra de plaquetas de 16 x 103/L, la coagulación estaba en rangos normales. La radiografía de tórax mostraba un ensanchamiento paratraqueal derecho y un aumento del ángulo de la carina por crecimiento de la aurícula izquierda. También presentaba cardiomegalia y discreto aumento de la trama vascular relacionado con su descompensación cardíaca. El electrocardiograma estaba en taquicardia sinusal a 90 lpm, sin bloqueos ni alteraciones de la repolarización.
Material y Métodos
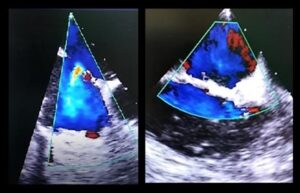
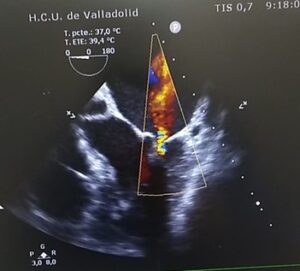
La paciente fue programada para sustitución valvular mitral por prótesis mecánica y cierre de comunicación interauricular (CIA). El ecocardiograma transesofágico intraoperatorio confirmó la existencia de comunicación interaricular con shunt izquierda derecha así como la insuficiencia mitral severa y tricuspídea moderada (Figuras 1 y 2). También presentaba un derrame pericárdico masivo, bien tolerado por la paciente debido a su cronicidad.
Se realizó una inducción anestésica con Etomidato 20 mg como inductor, Fentanilo 150 mcg y relajación neuromuscular con Rocuronio 60 mg. El mantenimiento se realizó con Sevofluorano a CAM de 2%. Precisó monitorización arterial invasiva pre-inducción e intubación orotraqueal con Airtraq por presentar la paciente apertura bucal limitada. La canalización del catéter venoso central en vena yugular interna derecha fue ecoguiada para reducir el número de pinchazos y evitar hematomas debidos al bajo recuento plaquetario. La colocación de catéter de arteria pulmonar fue desestimada dado el elevado riesgo de complicaciones hemorrágicas. Se inició la cirugía con esternotomía media, disección y canulación de grandes vasos, parada cardíaca con cardioplejia y entrada en circulación extracorpórea sin incidencias. La cirugía consistió en una sustitución valvular mitral por prótesis mecánica y reparación del anillo tricuspídeo. El defecto interauricular fue reparado con un parche de pericardio bovino. El corazón precisó de dos choques y un bolo de lidocaína intravenosa a 1mg/kg para recuperar el ritmo sinusal. También se administró 1 gramo de cloruro de calcio y 1’5 gramos de sulfato de magnesio para mejorar la respuesta contráctil tras la circulación extracorpórea. Se revirtió la heparinización sistémica con Sulfato de Protamina según tiempo de coagulación activado (TCA). En este momento, dados los antecedentes de la paciente y por no lograrse una hemostasia eficaz, se administró una dosis de desmopresina de 20 microgramos. Antes del cierre quirúrgico se realizó un estudio ecocardiográfico que objetivó normoposición de válvula mitral con apertura de ambos velos, mejoría de la insuficiencia tricuspídea, pasando a ser moderada, y corrección del defecto del tabique interauricular. Para el cierre quirúrgico precisó transfusión de dos concentrados de hematíes, dos bolsas de plasma fresco congelado y dos pools de plaquetas.
Resultados
El traslado a la Unidad de Reanimación lo realizamos con la paciente intubada, sedada, conectada a ventilación mecánica y con perfusión de Noradrenalina a dosis de 0’1 mcg/kg/min y Dobutamina a 5 mcg/kg/min. Se mantuvo estable, aunque con abundante débito por los drenajes, siendo el total de 5 litros durante toda su estancia. La extubación pudo realizarse de manera precoz en las primeras 6 horas postoperatorias y sin incidencias. Precisó otras tres transfusiones plaquetarias antes de maniobras invasivas: retirada de drenajes, electrodos de marcapasos y vía central, siendo dada de alta a la planta a los 7 días de la intervención con una cifra de plaquetas de 25 x 103/L.
Discusión
Entre las medidas y fármacos no transfusionales que podemos emplear para el abordaje de estos pacientes se encuentra la desmopresina. Se trata de un análogo de la vasopresina que induce la liberación de factor Von Willebrand de las células endoteliales5. Su efecto hemostático ha demostrado ser útil en el tratamiento o la prevención de episodios hemorrágicos en pacientes con enfermedad de von Willebrand, hemofilia A y defectos de la función plaquetaria, reduciendo el empleo de hemoderivados en pacientes con trastornos hemorrágicos hereditarios. Los pacientes con alteraciones de almacenamiento por lo general, pero no siempre, responden6, por lo que es interesante realizar una prueba de respuesta a desmopresina en el estudio preoperatorio. En el caso que presentamos, el estudio preoperatorio se realizó previamente en su hermano que presentaba un síndrome similar, infiriendo que podría existir una pequeña respuesta de corta duración a la desmopresina, de ahí que se reservase su administración para el momento de la hemostasia quirúrgica. La desmopresina puede provocar rubefacción, hipotensión, retención de líquidos, hiponatremia y posibles convulsiones. Además, su eficacia terapéutica disminuye tras la primera dosis (taquifilaxia).
La desmopresina puede administrarse:
-En infusión intravenosa continua: dosis de 0.3 μg/kg diluida a 30-50 mL en suero salino al 0.9%, e infundida durante 30 minutos.
-En inyección subcutánea en dosis de 0.3 μg/kg, una vez al día.
-En aerosol intranasal, disponible en presentación concentrada (150 μg por dosis) bajo la marca Stimate®, para administrarse en dosis de 300 μg para adultos (> 50 kg).
El ácido tranexámico se trata de un agente antifibrinolítico, al igual que el ácido epsilón-aminocaproico, los cuáles son útiles para estabilizar el coágulo. Ambos son análogos sintéticos de la lisina que inhiben competitivamente la unión del plasminógeno con la lisina en la superficie de fibrina, que previene la conversión de plasminógeno en plasmina. El ácido tranexámico es 10 veces más potente que el ácido aminocaproico y su dosis recomendada es de 10-15mg/Kg seguido de una infusión a 1-5mg/kg/h.
El calcio es indispensable para la activación de los factores de coagulación en las distintas fases, por lo que las guías recomiendan que deben mantenerse los niveles plasmáticos entre 1.1-1.3 mmol/L durante una trasfusión masiva6. Niveles bajos de calcio en plasma al ingreso se han asociado con mayor necesidad transfusional y mayor mortalidad, aunque no hay datos que demuestren que prevenir la hipocalcemia pueda reducir la mortalidad en pacientes con riesgo de hemorragia crítica.
La transfusión de plaquetas podría ser necesaria en caso de hemorragias graves o en paciente que no respondan a la desmopresina y cuando otros agentes no han sido eficaces. Como cualquier hemoderivado, conlleva riesgo de infecciones de trasmisión parenteral y reacciones alérgicas. Además la exposición a donantes múltiples puede contribuir al desarrollo de aloanticuerpos, siendo refractaria la trasfusión e imposibilitando una buena hemostasia. Por ello, la recomiendación basada en opiniones expertas es transfundir plaquetas compatibles con los aloanticuerpos en pacientes que vayan a ser expuestos a trasfusiones múltiples.7
Otros fármacos como el Factor VIIa recombinante (Novoseven®) tienen experiencia limitada en trastornos plaquetarios, por ello solo se emplea en el control de hemorragias no corregidas con trasfusión de plaquetas en pacientes con trombastenia de Glanzmann y trastornos de almacenamiento, no estando indicadas en el Síndrome de Plaqueta Gris.7
Se debería realizar un estudio preoperatorio exhaustivo en pacientes con defectos de la función plaquetaria y trazar un plan anestésico que adecúe el riesgo beneficio de realizar algunas técnicas. En este tipo de intervenciones, los procedimientos de monitorización invasiva como ecocardiograma transesofágico o la colocación de catéter de arteria pulmonar debe ser siempre sopesado por el riesgo hemorrágico al que se expone al paciente.
CONCLUSIONES
La transfusión profiláctica de plaquetas, los agentes antifibrinolíticos como el ácido tranexámico y la desmopresina han demostrado ser eficaces para conseguir un efecto hemostático postquirúrgico incluso en cirugías con un elevado riesgo hemorrágico, como la cirugía cardíaca.
Es fundamental un abordaje multidisciplinar conjunto de cirujanos cardíacos, cardiólogos, hematólogos y anestesiólogos para lograr unos resultados quirúrgicos óptimos minimizando el riesgo de complicaciones en pacientes con Síndrome de plaqueta gris.
Bibliografía
- Carrascal, Y, Laguna, G, Blanco, M, Segura, B, Martínez-Almeida, I. Gray platelet syndrome: Management of perioperative bleeding in redo cardiac surgery. J Card Surg. 2020; 35: 457– 459. https://doi.org/10.1111/jocs.14354 (PubMed)
- Orsini S, Noris P, Bury L, Heller PG, Santoro C, Kadir RA et European Hematology Association – Scientific Working Group (EHA-SWG) on thrombocytopenias and platelet function disorders. Bleeding risk of surgery and its prevention in patients with inherited platelet disorders. Haematologica. 2017 Jul;102(7):1192-1203. doi: 10.3324/haematol.2016.160754. Epub 2017 Apr 6. PMID: 28385783; PMCID: PMC5566025. (HTML)
- Coppola A, Di Minno G. Desmopressin in inherited disorders of platelet function. Haemophilia. 2008 Jan;14 Suppl 1:31-9. doi: 10.1111/j.1365-2516.2007.01607.x. PMID: 18173692 (HTML)
- Gunay-Aygun M, Zivony-Elboum Y, Gumruk F, Geiger D, Cetin M, Khayat M et al. Gray platelet syndrome: natural history of a large patient cohort and locus assignment to chromosome 3p. Blood. 2010 Dec 2;116(23):4990-5001. doi: 10.1182/blood-2010-05-286534. Epub 2010 Aug 13. PMID: 20709904; PMCID: PMC3012593. (PubMed)
- Ozgönenel B, Rajpurkar M, Lusher JM. How do you treat bleeding disorders with desmopressin? Postgrad Med J. 2007 Mar;83(977):159-63. doi: 10.1136/pgmj.2006.052118. PMID: 17344569; PMCID: PMC2599976. (PubMed)
- González Guerrero C., Montoro Ronsano J.B. “Fisiopatología y tratamiento de la hemorragia crítica”. Servicio de Farmacia, Hospital de la Vall d’Hebrón de Barcelona, Spain. Farm Hosp. 2015;39(6):382-398 (Scielo)
- Sharathkumar A. A., Shapiro A.D. Trastornos de la función plaquetaria. Tratamiento de la hemofilia. World Federation of Hemophilia, 2008. No. 19 https://www1.wfh.org/publication/files/pdf-1148.pdf



Buenos días Sara, gracias por el artículo de una entidad tan poco frecuente. Mi pregunta es si usasteis tromboelastograma o ROTEM y que alteraciones mostró. Y por otro lado si el criterio para reintervenir por sangrado fue distinto de una cirugía cardíaca convencional, puesto que comentas que la paciente sangró mucho en el postoperatorio. Muchas gracias.