Jiménez García MJ, Martín Ventura S, López Coloma R
FEA Anestesiología y Reanimación Hospital universitario de Getafe, España.
Cómo citar este artículo: Jiménez García, M. J., Martín Ventura, S., & López Coloma, R. (2024). Cirugía por videotorascopía. Revista Electrónica AnestesiaR, 16(2). https://doi.org/10.30445/rear.v16i2.1191
Introducción
En las últimas dos décadas, los accesos quirúrgicos al tórax han evolucionado de forma constante, buscando una menor morbilidad y una recuperación funcional más rápida.
El término cirugía asistida por videotoracoscopia (VATS) describe procedimientos quirúrgicos torácicos mínimamente invasivos, ayudados de una videocámara, para evitar toracotomía abierta. La VATS ha permitido reducir considerablemente el dolor y la morbilidad asociados a la toracotomía clásica.
Los metaanálisis que analizan los dos abordajes muestran que, con videotocacoscopia, disminuyen la intensidad del dolor postoperatorio, las complicaciones perioperatorias, la estancia hospitalaria, la duración de los drenajes torácicos y el impacto en la calidad de vida comparado con la toracotomía. Estos beneficios son elementos esenciales en los programas de recuperación intensificada, tan ampliamente establecidos en otras cirugías y aún iniciándose en cirugía torácica, cuyo objetivo es facilitar una recuperación más rápida y mejor del paciente.
Todos estos efectos son más evidentes en pacientes frágiles y de alto riesgo, con poca tolerancia a la toracotomía y que serán, por lo tanto, los principales beneficiados.
En la actualidad, la VATS se considera de elección para la mayoría de los procedimientos torácicos.
Mediante VATS podemos realizar:
- Cirugía de resección pulmonar:
- No anatómica: bullectomías; resecciones atípicas.
- Anatómica: segmentectomía, lobectomía, bilobectomía, neumonectomía, resecciones más amplias…
- Otros procedimientos:
- Resección de masas mediastínicas (timomas, …)
- Cirugía traqueal
- Pleurodesis o abrasión pleural
- Derrames pleurales
- Simpatectomía torácica.
Procedimiento
La VATS generalmente implica una pequeña incisión (de unos 4 a 8 cm) para la cámara y hasta tres pequeñas incisiones adicionales para inserción de otros instrumentos. (Imagen 1)
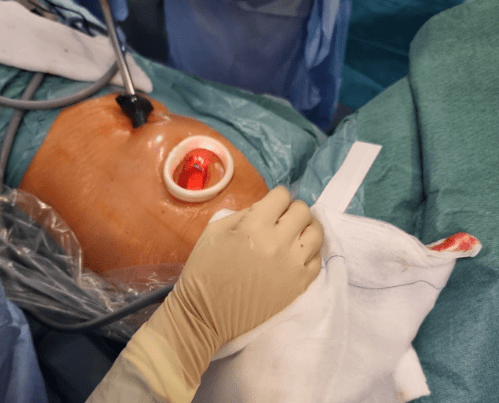
Se minimiza el dolor posoperatorio al evitarse el uso del separador de costillas, la sección de nervios intercostales y la división del tejido muscular.
Centrándonos en la lobectomía por VATS, ayudados por una cámara y a través de pequeñas incisiones, se reseca un lóbulo pulmonar con disección y posterior sección individualizada de las estructuras broncovasculares lobares.
Peculiaridades en cirugía torácica
La VATS requiere colapso pulmonar máximo del pulmón que vamos a operar para visualización quirúrgica óptima. Esto se consigue con dispositivos de aislamiento pulmonar que permitan ventilación unipulmonar (VUP). Estos dispositivos son los tubos de doble luz (TDL) y los bloqueadores bronquiales (BB).
Tubos de doble luz
Los tubos de doble luz son dos tubos unidos, uno bronquial (de color azul) curvado a nivel distal y otro traqueal (blanco), más corto. Cada uno con un balón de neumotaponamiento. Una conexión en Y permite su adaptación al respirador. Existen TDL izquierdos y derechos según a que bronquio vaya la rama bronquial.
Generalmente, realizamos el aislamiento pulmonar con TDL izquierdo, más fácil de colocar que el derecho (con una abertura que debe coincidir con el bronquio lobar superior derecho). Se clampa la luz traqueal o la luz bronquial, según el pulmón que deba colapsarse (derecho o izquierdo respectivamente).
Para seleccionar el tamaño del TDL, seguimos referencias en función de sexo y estatura. (Figura 1)
| Sexo | Estatura (cm) | Tamaño TDL (F) |
| Mujer | < 150* 150-160 >160 | 32 35 37 |
| Hombre | <160 160-170 >170 | 37 39 41 |
| Figura 1. Elección del tamaño del TDL | ||
Tras la inserción del TDL (mediante laringoscopia directa), comprobamos su correcta posición con fibrobroncoscopio flexible de tamaño adecuado (3,5 mm). La visión del bronquio lobar superior derecho, con forma de trébol, sirve como referencia anatómica que asegura la correcta colocación.
El tubo normoposicionado debe mantener el balón traqueal por encima de la carina y el bronquial visible en el bronquio principal, sin herniarse.
Bloqueadores bronquiales
Son dispositivos que también permiten el colapso pulmonar y ventilación unipulmonar (VUP). Se insertan dentro del bronquio principal del lado a intervenir, inflando el neumotaponamiento para la VUP. Permite el bloqueo lobar selectivo.
La colocación clásica es a través del tubo endotraqueal (TET), guiado con FBO. El TET debe tener el diámetro suficiente para introducir simultáneamente el FBO y el BB.
Se usa en:
- vía aérea difícil (VAD),
- imposibilidad de colocar TDL,
- paciente ya intubado,
- anormalidades de la vía aérea superior,
- necesidad de bloqueo lobar.
La calidad del colapso pulmonar con el BB es peor, pudiendo quedar aire retenido. Es más difícil la aspiración a su través por un menor diámetro y es más fácil su desplazamiento con la movilización.
Ventilación protectora
Nuestro objetivo es evitar lesión pulmonar aguda asociada a ventilación mecánica, tanto durante la VUP como en ventilación bipulmonar. La estrategia de ventilación protectora está basada en:
- Bajo volumen corriente (4-6 ml/kg en VUP y 6-8 ml /kg en VBP), que conllevará hipercapnia permisiva.
- Bajas presiones en vía aérea.
- Maniobras de reclutamiento alveolar al inicio de la VUP, siempre que aparezca hipoxemia y antes de extubar al paciente.
- PEEP óptima individualizada.
No hay evidencia a favor de la ventilación en un modo ventilatorio u otro.
Bloqueo neuromuscular profundo
Para evitar los movimientos del paciente durante la ligadura quirúrgica de rama de la arteria pulmonar, es preciso que exista un bloqueo neuromuscular profundo.
Se recomienda monitorización con TOF de dicho bloqueo y reversión completa del mismo antes de la extubación.
Reexpansión pulmonar
Tras finalizar el procedimiento quirúrgico, se aspira el pulmón colapsado y comienza a ventilarse con aumentos progresivos de presión inspiratoria hasta 20-30 cm H20, o hasta la presión mínima necesaria para eliminar las atelectasias de forma completa sin provocar daño pulmonar ni crear fugas en las suturas.
Durante la reexpansión pulmonar, el cirujano debe comprobar la ausencia de fugas de aire significativas en la línea de grapas.
Monitorización intraoperatoria
- Monitorización estándar: ECG (2 derivaciones II y V), pulsioximetría, capnografía, curvas de flujo/volumen (atrapamiento de aire, autoPEEP…), presión arterial no invasiva, BIS, temperatura. Recomendable la monitorización con TOF.
- Al menos un acceso venoso periférico de gran calibre. En lobectomía o resección pulmonar mayor, canalizamos 2 accesos venosos periféricos.
- Presión arterial invasiva: en lobectomías o resecciones amplias, así como en resecciones menores con riesgo elevado de sangrado (adherencias o afectación del hilio), o en pacientes con riesgo de inestabilidad hemodinámica por patologías preexistentes.
- Muy raramente necesitaremos acceso venoso central.
- La monitorización básica se aumentará en función del procedimiento a realizar y/o de las características del paciente.
Posición quirúrgica
La posición habitual es decúbito lateral contralateral al lado que vamos a intervenir. El paciente descansa sobre el costado encima de un rodillo torácico inflable (para abrir los espacios intercostales), con la pierna declive en ligera flexión, y la proclive en extensión, con almohadillado entre ellas.
El brazo declive queda estirado y el proclive apoyado en pernera, en abducción y con flexión del codo. Colocamos un rodete bajo la cabeza para evitar la compresión del pabellón auricular y protegemos la zona ocular para evitar cualquier presión. Colocamos cintas de sujeción a nivel de la pelvis.
El cambio de posición es manejado por Anestesia con cuidado para evitar desplazamientos de dispositivos de vía aérea, monitorización y accesos vasculares. Comprobaremos la simetría del pulso radial para descartar compresión de la arteria axilar.
Tras la colocación en decúbito lateral, es obligado comprobar nuevamente la correcta posición del TDL/BB con FBO flexible antes del inicio de la cirugía.
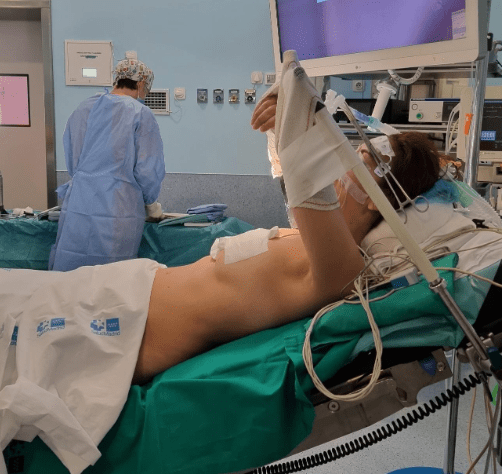
Otra posición quirúrgica posible es con el paciente semisentado, con los brazos cruzados anterior y superiormente para abordajes axilares en simpatectomía torácica, procedimiento en el que necesitaremos VUP secuencial de ambos pulmones. (Imagen 2).
Profilaxis antibiótica
En pacientes no alérgicos a la penicilina, usaremos cefazolina 2 g 30-60 minutos antes de la incisión quirúrgica. Repetimos dosis si la cirugía dura más de 3 horas y/o existe sangrado intraoperatorio > 1500 ml. En alérgicos a penicilina, usaremos teicoplanina, o bien gentamicina más clindamicina dependiendo del procedimiento.
Además, realizaremos profilaxis tromboembólica con medidas mecánicas en cirugía oncológica pulmonar.
Técnica anestésica
La elegida es la anestesia general usando agentes anestésicos de corta duración de acción que permitan la extubación al final de la intervención. Generalmente, usamos un protocolo anestésico multimodal (OLA) ahorrador de opioides, y con frecuencia asociamos anestesia regional.
El mantenimiento se realiza indistintamente con anestésicos inhalados o propofol intravenoso, en función de las características del paciente y de la cirugía. (Figura 2)
| PROPOFOL | ANESTÉSICOS INHALADOS (SEVO-DESFLURANO) |
| Menor incidencia NyVPO No contaminación ambiental No interfiere vasoconstricción pulmonar hipóxica (VPH) No induce inmunosupresión (importante en neoplasias) | Disminuyen respuesta inflamatoria pulmonar local Broncodilatadores Inhibición muy leve de VPH Favorecen inmunosupresión ¿? |
| Figura 2. Características de los anestésicos empleados | |
Fluidoterapia
Buscamos un balance neutro de líquidos. Entre 2-6 ml/kg/h de cristaloides intraoperatorios.
Un exceso puede llevar a edema pulmonar (pulmón susceptible por respuesta inflamatoria al trauma quirúrgico), y un déficit puede dañar la función renal.
Es importante una adecuada hidratación preoperatoria y la rápida reintroducción de ingesta oral.
Analgesia
Realizamos analgesia multimodal para minimizar el uso de opioides. Utilizamos dosis bajas de adyuvantes intravenosos (AINEs, corticoides, ketamina, lidocaína, dexmedetomidina, …). Si no usamos anestesia regional, 30-40 minutos antes de extubar al paciente, administramos rescate con cloruro mórfico intravenoso.
En lobectomías o resecciones mayores, con riesgo alto de reconversión a toracotomía y casos en los que debamos evitar opiodes y/o AINEs, colocaremos un catéter epidural torácico a nivel de T5-T6. Se usa intraoperatoriamente (bolos levobupivacaína 0,375% + fentanilo 5 mcg/ml), y en el postoperatorio lo conectamos a una PCA epidural con perfusión continua (3-5 ml) más bolos administrados por el paciente (ropivacaína 0,150% + fentanilo 5 mcg/ml, o ropivacaína 0,2% sin fentanilo). Generalmente se retira a los 2-3 días, a la vez que los drenajes pleurales.
En otros casos (bullectomías, resecciones atípicas…) realizamos bloqueo del erector espinal del lado a intervenir guiado con ecografía, previo a la inducción, a nivel T5. Administramos 20 ml de anestésico local, pudiendo también dejar un catéter para continuar analgesia postoperatoria.
También es útil la infiltración de los puertos de VATS, u otros bloqueos ecoguiados de la pared torácica (nervios intercostales, serrato anterior…).
Sangrado
Si no hay incidencias, el sangrado durante la VATS es mínimo.
Duración
La duración de la cirugía por videotoracoscopia puede ir desde 15 minutos o menos (en biopsias pulmonares) hasta varias horas en resecciones pulmonares amplias, dependiendo de la dificultad técnica del procedimiento, de la tolerancia del paciente a la VUP, etc.
Una vez finalizado el procedimiento quirúrgico, el paciente se coloca de nuevo en decúbito supino. Se aspiran secreciones y, tras confirmar que no existe relajación neuromuscular residual, procederemos a la extubación en el quirófano.
Complicaciones intraoperatorias
Hipoxemia durante la VUP
El establecimiento de la VUP con colapso del pulmón proclive genera un shunt intrapulmonar final de solo un 20-30 % aproximadamente, debido a distintos motivos:
- El pulmón declive está mejor perfundido por la gravedad.
- La manipulación quirúrgica deriva sangre al pulmón no intervenido.
- La VPH es un mecanismo de compensación que modula el flujo sanguíneo a las regiones hipóxicas. Va a reducir el flujo en el pulmón no ventilado en un 40-50 % durante la VUP, lo que modera el grado de hipoxemia.
Consideramos hipoxemia una Sat02 menor de 90%, aunque puede individualizarse.
Manejo de la hipoxemia en VUP
- Aumentar Fi02 al 100 %
- Comprobar normoposición TDL / BB con FBO
- Aspirar a través de la luz del pulmón ventilado (secreciones/sangre)
- Optimizar el gasto cardiaco
- Maniobras de reclutamiento alveolar titulando PEEP óptima
- Presión positiva continua en pulmón no ventilado mejora la oxigenación. En VATS debe ser menor a 2 cm H20 para no interferir con la visión quirúrgica.
- Oxigenación apneica de bajo flujo en pulmón no ventilado.
- Si continuamos con hipoxemia, reexpansión pulmonar y ventilación intermitente. Podemos intentar bloqueo selectivo lobar si es posible.
- También se puede realizar ligadura precoz de arteria pulmonar del pulmón no ventilado acabando con el shunt.
Desgarro vascular/hemorragia intraoperatoria
Daremos soporte vasoactivo necesario hasta que la hemorragia sea controlada quirúrgicamente.
Colapso pulmonar no óptimo
Maniobras que favorecen el colapso pulmonar:
- Fi02 al 100% previo a VUP genera atelectasias reabsortivas eliminando nitrógeno.
- Inflado de balón del TDL/BB con paciente en apnea para exhalación pulmonar completa.
- Compresión manual por parte del cirujano.
- Aspiración intermitente del pulmón no ventilado.
Observaciones
El abordaje por VATS ha supuesto un importante hito en la cirugía torácica permitiendo la cirugía en pacientes que nunca hubieran sido candidatos a ella mediante abordaje con toracotomía abierta. La menor morbilidad postoperatoria, la disminución de la intensidad del dolor postoperatorio, la reducción del tiempo para los drenajes torácicos, y la estancia hospitalaria de menor duración han hecho posible que se planteen y se lleven a cabo programas de recuperación intensificada en cirugía torácica.
La cirugía torácica por VATS tiene unas peculiaridades en las que el papel del anestesiólogo es esencial. La videotoracoscopia requiere un colapso pulmonar total para que la visión quirúrgica sea adecuada y esto obliga al uso de dispositivos de aislamiento pulmonar y a ventilación unipulmonar por parte de Anestesia. Asimismo, es importante la estrategia de ventilación protectora, tanto en unipulmonar como en bipulmonar. Además, para facilitar una recuperación más rápida del paciente, es fundamental el adecuado control del dolor postoperatorio.
En la actualidad, la VATS es la técnica de elección para la mayoría de los procedimientos torácicos.
Bibliografía
- Garutti I, Cabañero A, Vicente R, Sánchez D, Granell M, Fraile CA, Real Navacerrada M, Novoa N, Sánchez-Pedrosa G, Congregado M, Gómez A, Miñana E, Piñeiro P, Cruz P, Gala F, Quero F, Huerta LJ, Rodríguez M, Jiménez E, Puente-Maestu L, Aragón S, Osorio-Salazar E, Sitges M, López Maldonado MD, Ríos FT, Morales JE, Callejas R, González-Bardancas S, Botella S, Cortés M, Yepes MJ, Iranzo M, Sayas J. Recomendaciones de la Sociedad Española de Cirugía Torácica y de la Sección de Cardiotorácica y Cirugía Vascular de la Sociedad Española de Anestesiología, Reanimación y Terapéutica del Dolor, para los pacientes sometidos a cirugía pulmonar incluidos en un programa de recuperación intensificada. Rev Esp Anestesiol Reanim. 2022;69:208-41 DOI: 10.1016/j.redar.2021.02.005
- Granell-Gil M, Murcia-Anaya M, Sevilla S, Martínez-Plumed R, Biosca-Pérez E, Cózar-Bernal F,. Garutti I, Gallart L, Ubierna-Ferreras B, Sukia-Zilbeti I, Gálvez-Muñoz C, Delgado-Roel M, Mínguez L, Bermejo S, Valencia O, Real M, Unzueta C, Ferrando C, Sánchez F, González S, Ruiz-Villén C, Lluch A, Hernández A, Hernández-Beslmeisl J, Vives M, Vicente R. Guía clínica en el manejo perioperatorio para la cirugía de resección pulmonar por videotoracoscopia (Sección de Anestesia Cardiaca, Vascular y Torácica, SEDAR; Sociedad Española de Cirugía Torácica, SECT; Asociación Española de Fisioterapia, AEF) Rev Esp Anestesiol Reanim. 2022;69:266-301 DOI: 10.1016/j.redar.2021.03.005
- Le Guen M; Fischler M. Anestesia en cirugía torácica. EMC-Anestesia-Reanimacion 2016;42(2)1-16[Artículo E -36-570-A-10]
- Stanke H, Von Dossow V, Karsten J. Preoperative evaluation in thoracic surgery: limits of the patien’s functional operability and consequence for perioperative anaesthesiologic management, Curr Opin Anesthesiol 2022, 35:61-68 DOI: 10.1097/ACO.0000000000001086
- Sentürk M, Sertac Bingül E, Turhan Ó. Should fluid management in thoracic surgery be goal directed? Curr Opin Anaesthesiolo 2022, 35:89-95 DOI: 10-1097/ACO.0000000000001083
- Karamnov S, ED Slinger PD, Nussmeier NA. Anesthesia for video-assisted thoracoscopic surgery (VATS) for pulmonary resection. UpToDate. Oct 27, 2022. https://www.uptodate.com/contents/anesthesia-for-video-assisted-thoracoscopic-surgery-vats-for-pulmonary-resection?csi=885c894d-5f8b-4c70-b35a-ed3cf5271306&source=contentShare
- Ma M, Slinger PD, ED Hines R, Nussmeier NA. One lung ventilation: General principles. UpToDate. Oct 20, 2022. https://www.uptodate.com/contents/one-lung-ventilation-general-principles?csi=7ba63f31-565e-4dcc-9d0b-366bc9bd6786&source=contentShare