López Coloma R, Grande Fernández A, Pérez Domínguez H
FEA Servicio de Anestesiología HU de Getafe, España
La cirugía torácica abierta está indicada para tratar procesos malignos intratorácicos, diagnosticar masas/nódulos sospechosos, manejar traumas torácicos, infecciones pulmonares, o fístulas broncopleurales.
Incluye:
- Segmentectomía, resección en cuña, bullectomía.
- Lobectomía, bilobectomías, lobectomía con segmentectomía.
- Neumonectomía.
- Neumonectomía extrapleural (linfadenectomía mediastínica, resección de pericardio ipsilateral, hemidiafragma, pleura visceral/parietal).
- Resección de masas mediastínicas.
Es fundamental la estrecha comunicación anestesiólogo/cirujano durante la evaluación preoperatoria, el manejo anestésico intraoperatorio, y la analgesia postoperatoria. La mayoría de procedimientos requieren aislamiento/separación pulmonar, ventilación unipulmonar (VUP) intraoperatoria y manejo de la vasoconstricción pulmonar hipóxica secundaria (VPH).
Procedimiento
Evaluación preoperatoria
Precisa valoración anestésica estándar, evaluación del riesgo cardiaco, pulmonar, riesgo de fragilidad y riesgo analgésico. La disnea y la debilidad preoperatoria se asocian a mayor incidencia de ventilación mecánica (VM) postoperatoria. La invasión local de estructuras es factor de riesgo de omalgia y déficits neurológicos por compresión del plexo braquial. Ambos pueden empeorar con la colocación intraoperatoria del paciente. El edema facial o de extremidades superiores sugiere síndrome de vena cava superior, secundario a masas grandes o adenopatías mediastínicas, pudiendo afectar al acceso vascular y/o control de vía aérea (VA). El dolor torácico pleurítico basal y el dolor crónico preoperatorio metastásico afectan a la eficacia del manejo analgésico postoperatorio.
Son intervenciones con riesgo cardiaco intermedio (3-5%), salvo la neumonectomía (> 5%). El thoracic revised cardiac risk index (ThRCI), un índice diseñado para estratificar este tipo de cirugías, incluye cuatro ítems:
- Historia de cardiopatía isquémica (1.5 puntos).
- Historia de enfermedad cerebrovascular (1.5 puntos).
- Insuficiencia renal crónica (IRC, creatinina > 2mg/dL) (1 punto).
- Neumonectomía (1.5 puntos).
Scores > 2.5 en este índice implican un mayor riesgo de eventos cardiacos mayores y menor supervivencia a largo plazo. La hipoxia, hipercapnia y redistribución vascular pulmonar asociada a VUP producen disfunciones de ventrículo derecho (VD) de hasta un 25% e hipertensión pulmonar (HTP). Enfermedades concomitantes con disfunción ventricular o HTP basal (EPOC, enfermedades intersticiales, obesidad – SAOS) pueden causar disnea postoperatoria. Estos pacientes requieren pruebas adicionales al EKG (ecocardiograma, función de VD, criterios de HTP, coronariografía en enfermos coronarios).
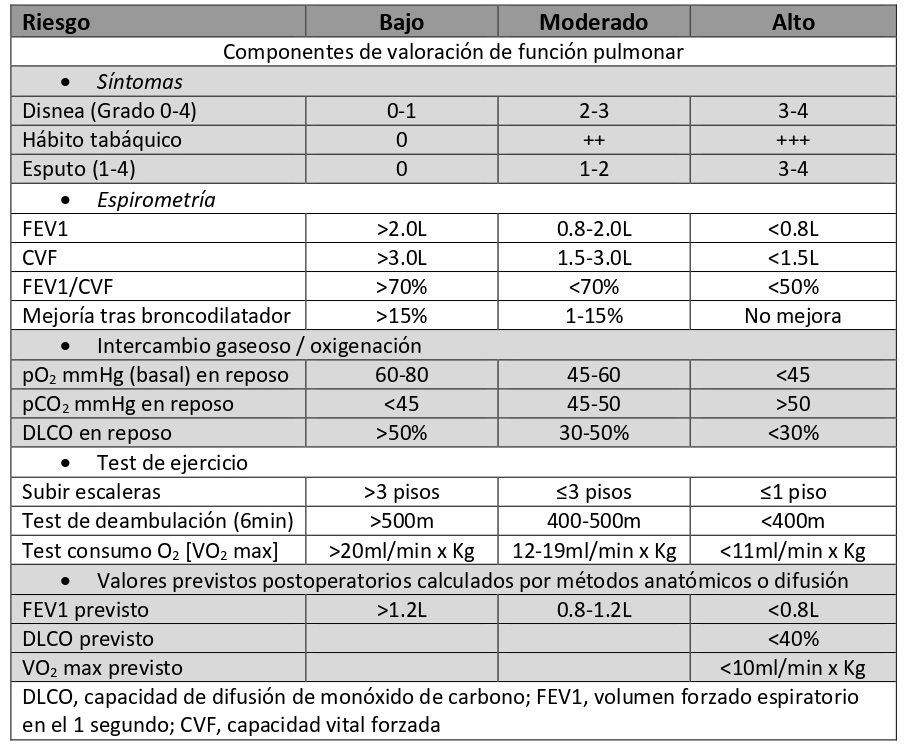
El riesgo pulmonar se evalúa a través de síntomas (disnea, hábito tabáquico, esputo), test de función respiratoria actuales (FEV1, FVC, FEV1/FVC, DLCO) y previstos postoperatorios, calculados por métodos anatómicos, de imagen o de perfusión (FEV1pr, DLCOpr, VO2 pr); gasometría arterial, y tests cardiopulmonares si los resultados previos son límites (subir escaleras, SatO2 durante ejercicio, test de deambulación, test de consumo de O2 [VO2 max]) (Tabla 1).
La incidencia de complicaciones postoperatorias pulmonares (CPP) tras la cirugía torácica es muy alta (30-50%). Incluye (criterios EPCO) atelectasias, neumonía, empiema, embolismo pulmonar, fístula bronco-pleural y todos los estadios de fallo respiratorio.
Las escalas de riesgo pulmonar (ARISCAT, LAS VEGAS) infraestiman su incidencia en estas cirugías. El abandono del tabaco > 8 semanas disminuye la incidencia de CPP.
Las pruebas de imagen aportan información sobre el árbol traqueo-bronquial y alteraciones de VA (cirugías previas, radioterapia) El derrame pleural afecta a la oxigenación durante la VUP. El derrame pericárdico es causa de hipotensión, e incluso parada cardiaca durante la inducción anestésica.
La fragilidad es factor de riesgo independiente de morbi-mortalidad tras cirugía de resección pulmonar. No existe un método diagnóstico estandarizado. Edad avanzada, índice de masa corporal (desnutrición/obesidad), reducción de función pulmonar, pérdida de masa muscular y disfunción cognitiva son factores de fragilidad descritos.
La IRC preoperatoria se asocia con fallo renal agudo, complicaciones pulmonares y mortalidad tras cirugía de resección pulmonar. El índice de Lee es de aplicación recomendable.
El riesgo analgésico es clave. El dolor se asocia a complicaciones relacionadas con inmovilización, atelectasias e infección. Hay factores de riesgo del paciente (edad < 60 años, mujer, consumo previo de opioides), y del procedimiento (toracotomía de larga duración, drenaje endotorácico > 4 días). Más del 25% de los pacientes desarrollan dolor crónico (> 30% neuropático).
El algoritmo de manejo intraoperatorio en función del riesgo se resume en la tabla 2.
El impacto de protocolos de recuperación intensificada (ERAS) en cirugía torácica abierta es controvertido (evidencia insuficiente). El asesoramiento preoperatorio, la normotermia, la fluidoterapia guiada por objetivos (FGO), el menor uso de opioides, la deambulación precoz, etc. deberían a priori acelerar la recuperación, reducir la morbilidad y propiciar el alta precoz del paciente.
Control de VA
Requiere casi siempre aislamiento o separación pulmonar, para conseguir una VUP efectiva que permita realizar el procedimiento. De elección, se utilizan tubos de doble luz (TDL) para conseguir «aislamiento». Los bloqueadores bronquiales (BB) proporcionan separación cuando los TDL no son recomendables como primera opción (VA difícil, VM postoperatoria).
En la VA normal es recomendable el TDL izquierdo. El derecho se reserva para casos en los que el izquierdo está contraindicado (es más difícil de colocar adecuadamente, incluso con fibroscopio). El tamaño del TDL depende del diámetro traqueal/bronquio principal izquierdo, medido en pruebas de imagen (TAC, ecografía).
En la VA difícil conocida/imprevista, el objetivo es asegurar la VA con un TET simple y, posteriormente, valorar la indicación de VUP (absoluta, relativa de alta, o baja prioridad). En este escenario, sobre todo si el bronquio a colapsar es el izquierdo, la mejor alternativa es usar un BB por dentro del TET. Colapsar el bronquio derecho con un BB es más difícil: es más ancho y el taponamiento menos efectivo. Intercambiar un TET por un TDL tiene un alto riesgo de pérdida de VA (en torno al 30%).
Debe estar disponible un fibroscopio flexible de tamaño adecuado y un dispositivo de CPAP para aplicar al pulmón no ventilado en caso de hipoxemia intraoperatoria.
Posición quirúrgica e incisión
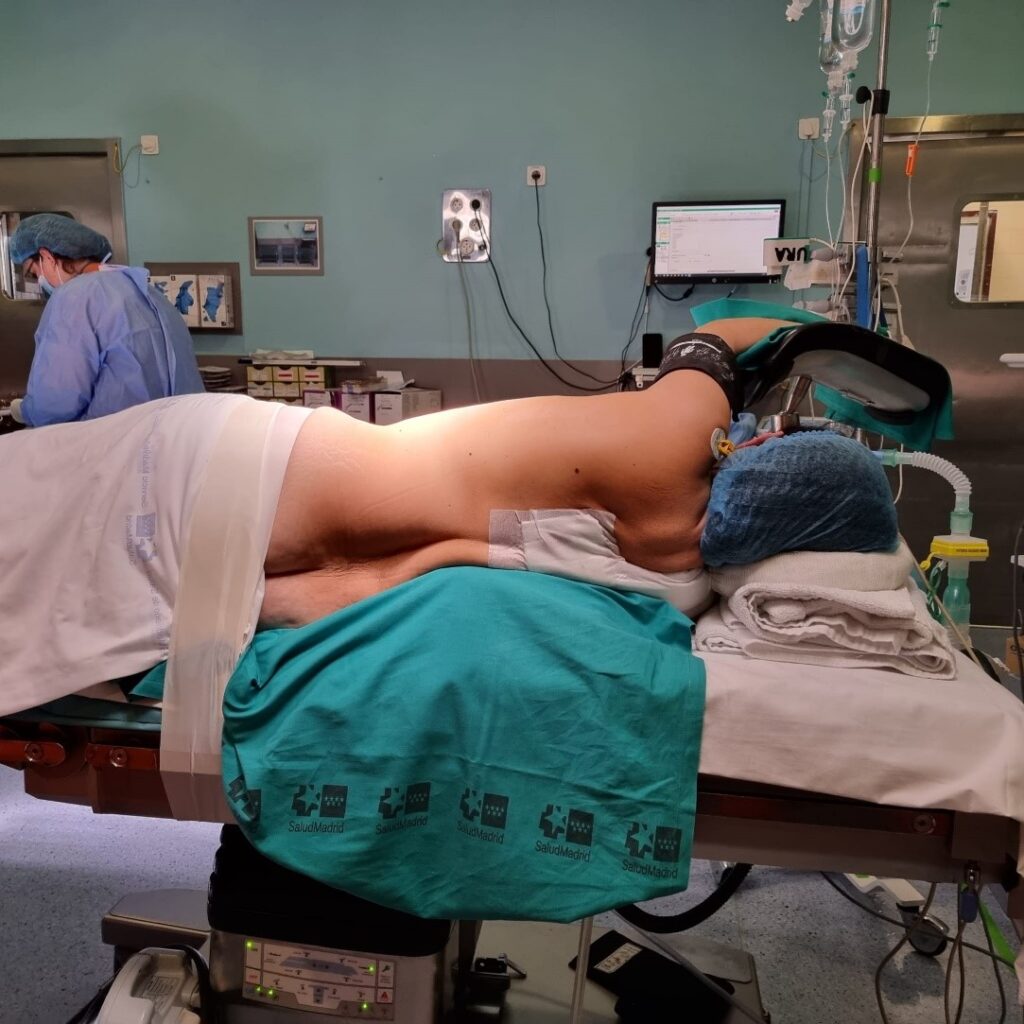
Decúbito supino en incisiones anteriores (esternotomía media, incisión cervical, toracotomía anterior, o anterior bilateral transesternal). Brazos pegados al cuerpo y un rodillo bajo las escápulas, para exponer mejor el mediastino superior.
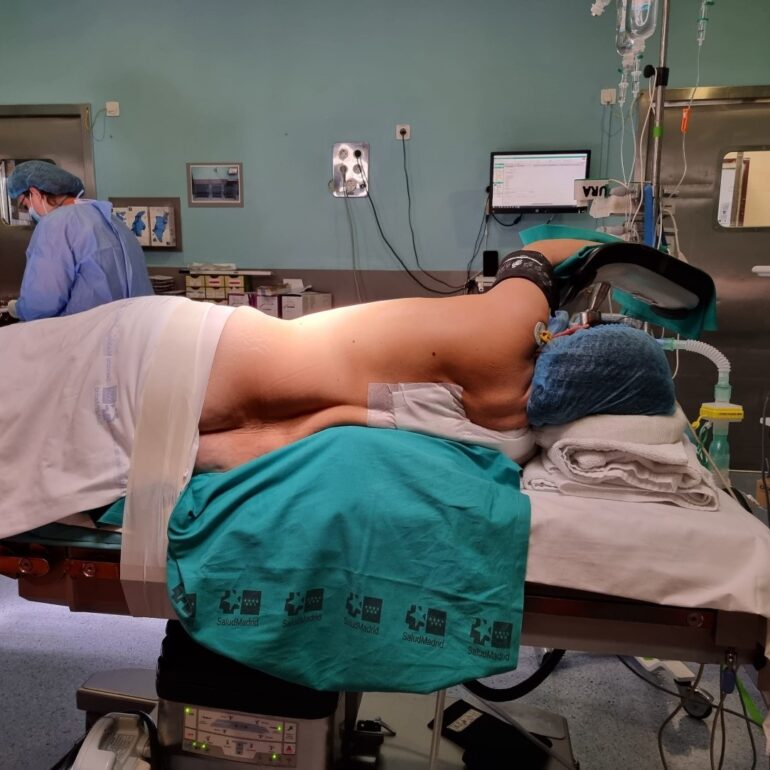
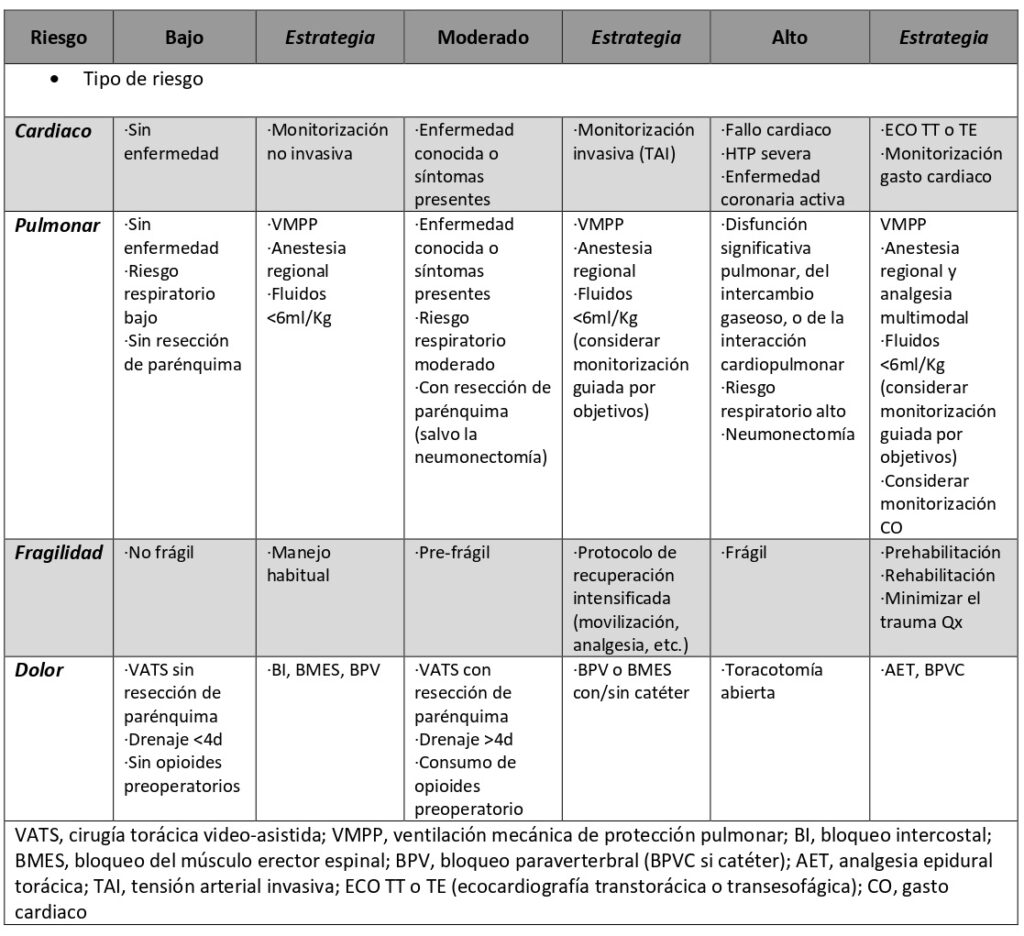
Decúbito lateral en incisiones laterales (toracotomía posterolateral y sus variantes) (Imagen 1). Brazo declive extendido en ángulo recto y axila apoyada en un rodillo hinchable, lo que facilita la exposición quirúrgica del hilio pulmonar y minimiza la lesión del plexo braquial.
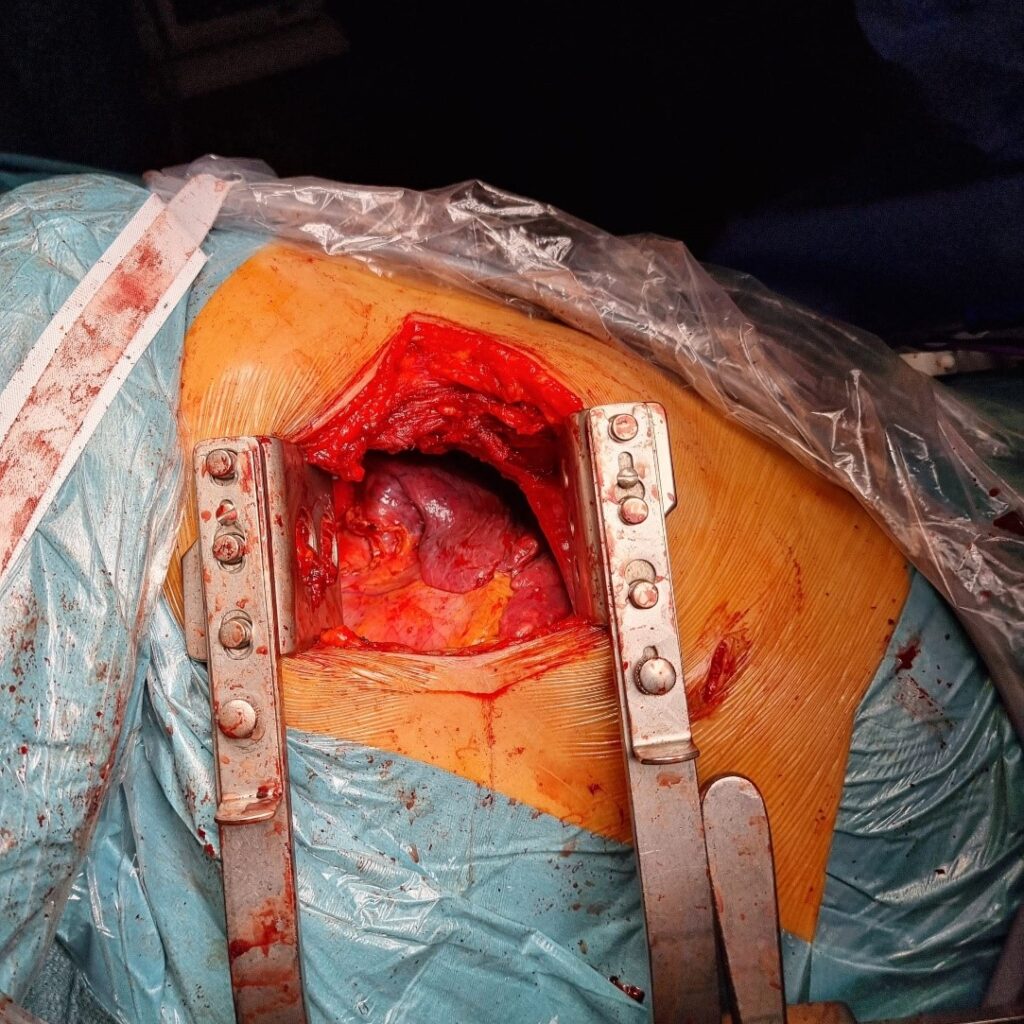
Brazo proclive apoyado sobre un soporte a nivel del hombro (Imagen 2). Importante: tras el cambio de posición, comprobar la correcta colocación del dispositivo de aislamiento pulmonar. El rodillo se deshincha al finalizar la intervención, facilitando el cierre. Pierna inferior flexionada y superior extendida sobre ella, con una almohada entre ambas. Una cinta adhesiva asegura la cadera del paciente a la mesa.
Profilaxis antibiótica
Cefazolina 2 g 30-60 minutos antes de la incisión. Repetir dosis si > 3 h de cirugía. Continuar con 1 g/8h hasta completar 24 h. En alérgicos a penicilinas o derivados: clindamicina 900 mg 30-60 minutos antes de la incisión, y gentamicina en dosis única en función del peso. Continuar con clindamicina 900 mg/6h hasta completar 24 h.
Técnica anestésica y analgésica
Se recomienda combinar técnicas regionales preoperatorias, con una anestesia general. La inducción anestésica es habitualmente intravenosa, con propofol 1-2 mg/Kg, lidocaína 1 mg/Kg, fentanilo 1-3 mcg/Kg y rocuronio 0.6 mg/Kg. El uso de atropina 0.01 mg/Kg es recomendable, si no está contraindicada, para minimizar las secreciones y mejorar la visibilidad con el fibroscopio, posterior a la intubación.
El mantenimiento anestésico puede ser intravenoso o inhalatorio, en función de las indicaciones generales del paciente (hiperreactividad bronquial, antecedentes de náuseas y vómitos, etc.). Los efectos broncodilatador, antiinflamatorio, y la rápida eliminación de los halogenados son una ventaja en pacientes seleccionados, aunque se han asociado con peor supervivencia oncológica a largo plazo, con resultados contradictorios vs. TIVA en la mortalidad al año y en la incidencia de CPP.
El sevoflurano a concentración habitual (CAM 1) tiene escasa repercusión sobre la VPH. Debemos evitar el N2O.
Se puede realizar una anestesia multimodal combinada, con dexmedetomidina a dosis 0.1 mcg/Kg/h, lidocaína entre 1 y 1.5 mg/Kg/h y/o ketamina en bolo 0.25-0.5 mg/Kg (las secreciones asociadas a intubación con TDL suelen ser mayores, por lo que en ocasiones es preferible evitar perfusiones de ketamina incluso a bajas dosis). La combinación de lo anterior con analgésicos convencionales (paracetamol, dexketoprofeno, metamizol) y corticoides (dexametasona 0.1 mg/Kg) permite minimizar el uso de opioides. Es necesario un bloqueo neuromuscular profundo intraoperatorio, incluso a costa de utilizar perfusión de rocuronio a dosis ajustable al TOF, y asegurar la ausencia de bloqueo residual al finalizar la cirugía con sugammadex, para minimizar el riesgo de CPP.
Monitorización
De rutina: electrocardiografía (EKG II y V), pulsioximetría (SatO2), tensión arterial no invasiva (TA), profundidad anestésica (BIS), bloqueo neuromuscular (TOF), temperatura (Tª), curva de capnografía continua (etCO2), presiones/volúmenes intermitentes de VA, distensibilidad, fuga en el circuito y analizador de gases. El gradiente PaCO2/etCO2, habitual en pacientes con patología pulmonar previa, suele agravarse durante la VUP.
La tensión arterial invasiva (TAI) y la diuresis son necesarias en cirugías > 2-3h (evitable en resecciones en cuña o lesiones periféricas). La TAI permite reconocer precozmente la inestabilidad hemodinámica secundaria a compresión cardiaca y/o de los grandes vasos, a hemorragia, hipoxia, hipercapnia, o a presiones elevadas en vía aérea y tomar muestras arteriales en pacientes de riesgo de desaturación durante la VUP (comparación de valores basales en ventilación bipulmonar, valores durante la VUP, y tras la resección pulmonar y reexpansión del pulmón no ventilado).
Los sistemas de monitorización hemodinámica avanzada (variación del contorno de la curva de TAI) no se consideran útiles a tórax abierto, durante la VUP, ni en la VATS. En ausencia de enfermedad cardiovascular, y si el acceso venoso periférico es adecuado, no se recomienda el uso de catéteres venosos centrales (pobre predictor del volumen intravascular y la respuesta a fluidos).
La ecocardiografía transesofágica está indicada en la HTP moderada-severa, la disfunción de VD, enfermedad valvular significativa, o si se prevé clampaje de la arteria pulmonar (disfunción aguda de VD). Permite diagnosticar urgentemente causas agudas de inestabilidad hemodinámica (hipo, o hipervolemia, isquemia miocárdica, compresión tumoral del corazón, o embolismo intracardiaco).
El catéter de arteria pulmonar no se usa de rutina, salvo en casos establecidos de disfunción de VD o HTP.
Prevención de hipotermia con sistemas de calentamiento de fluidos y mantas de calor por debajo de la cintura.
Fluidoterapia
Basada en la administración de cristaloides balanceados, con normovolemia como objetivo, y test de respuesta a volumen (100-250ml). La FGO optimiza el gasto cardiaco y la entrega tisular de O2 y permite evitar abordajes restrictivos o liberales, que presentan peores resultados.
La terapia restrictiva facilita la extubación precoz y menores CPP, a expensas de menor perfusión tisular y mayor riesgo de lesión renal aguda.
La terapia liberal se asocia a lesión pulmonar aguda, con mayor riesgo por cada 500 ml de incremento en la fluidoterapia perioperatoria, especialmente por encima de los 3L en las primeras 24h.
Los coloides se reservan para reemplazar pérdidas de sangre equivalentes, evitando soluciones de hidroxi-etil-almidón. La albúmina es controvertida, no ha demostrado ser superior a la expansión con cristaloides, y debería usarse únicamente en pacientes críticos seleccionados, hipoalbuminémicos, o necesidad de rápida expansión de volumen.
El umbral transfusional es de Hb ≥8g/dL.
En pacientes normovolémicos es preferible tratar la hipotensión con vasoconstrictores.
Analgesia
En el preoperatorio inmediato, se recomienda colocar un catéter epidural torácico a nivel T5-T7, o bien un catéter paravertebral eco-guiado ipsilateral a la cirugía. Se consiguen niveles adecuados de analgesia intraoperatoria con bolos epidurales de bupivacaína 0.25% (5ml/45-60min mientras esté estable hemodinámicamente), y de analgesia postoperatoria con PCA de bupivacaína 0.125% (infusión mínima 5ml/h + bolos). La analgesia paravertebral requiere mayores concentraciones y volúmenes (bupivacaína 0.5% y 0.25% para analgesia intra y postoperatoria respectivamente).
Pueden contraindicarse abordajes neuroaxiales con catéter por anormalidades de la hemostasia. La trombocitopenia, y/o tratamientos crónicos antiagregantes o anticoagulantes, pueden afectar al momento/seguridad de la técnica. En caso de estar ambos contraindicados, una alternativa es la inyección intratecal de cloruro mórfico 1-2 mcg/Kg, junto a abordajes relativamente seguros, como los bloqueos regionales eco-guiados de la pared torácica (bloqueos intercostales, bloqueo del musculo erector espinal con/sin catéter, bloqueo del serrato anterior, bloqueos pectorales, BRILMA). Valorar la analgesia incisional postoperatoria (catéter incisional o interfascial).
Sangrado
En todas las resecciones pulmonares abiertas se debe cruzar sangre, incluidas las segmentectomías. Si se objetivan anticuerpos irregulares, al menos deberían estar disponibles dos unidades de concentrado de hematíes compatibles . El sangrado profuso es infrecuente, pero el impacto del potencial sangrado pulmonar, o de los vasos bronquiales durante la disección, es grande. Sangrado habitual < 500ml, mayor en reintervenciones y procesos inflamatorios. Vigilar el sangrado por el drenaje endotorácico en el postoperatorio.
Duración
Tiempo quirúrgico aproximado 2-4 h, similar en la neumonectomía.
Complicaciones intraoperatorias específicas
La cirugía torácica abierta requiere VUP, con riesgo de lesión pulmonar aguda. Se minimiza usando estrategias de ventilación pulmonar protectora, tanto en ventilación bipulmonar como unipulmonar:
- Volumen tidal bajo (6-8 ml/Kg bipulmonar, 4-6 ml/Kg unipulmonar).
- Presiones bajas en VA (meseta < 30 cm H2O).
- Frecuencia respiratoria para mantener etCO2 próximos a los valores basales (hipercapnia permisiva).
- Reclutamiento y PEEP individualizada (5-8 cm H2O, que se mantendrá en el pulmón ventilado durante la VUP).
- Limitación de driving pressure a 15 cm H2O.
- Concentraciones de O2 mínimas que permitan una SatO2 > 90% (FiO2 60-100%)
El manejo de la hipoxemia durante la VUP puede requerir concentraciones mayores de O2, mejorar la hemodinamia del paciente, revisar la adecuada colocación del TDL/BB, aspirar secreciones del pulmón ventilado o aplicarle broncodilatadores, uso de CPAP en el pulmón no ventilado entre 5 y 10cm H2O, o necesidad de ventilación bipulmonar.
Tras la intervención, y previo al cierre, se deben aspirar las secreciones de la tráquea y el bronquio principal, y reexpandir el pulmón colapsado (salvo en la neumonectomía), descartando la presencia de fugas en el bronquio/parénquima intervenido.
Conviene medir el tiempo de clampaje, por el potencial atelectrauma y biotrauma proporcional. Puede realizarse una fibroscopia final para comprobar el muñón bronquial, y el resto de bronquios.
Es preferible la extubación precoz. El uso posterior de CPAP o gafas nasales de alto flujo se reserva para pacientes seleccionados (SAOS, pacientes hipoxémicos respectivamente). En pacientes con reserva respiratoria limitada, inestables hemodinámicamente, tras sangrados importantes, hipotérmicos, o tras resecciones complejas o que incluyan pared torácica puede requerirse VM postoperatoria. En este caso, es preferible intercambiar el TDL por un TET simple con un intercambiador, salvo que exista riesgo de edema facial o laríngeo, y peligro de pérdida de vía aérea. Si el periodo de VM postoperatoria previsto es breve (1-2 h), es preferible dejar el TDL, o llevarse ambas luces a la tráquea.
La morbilidad perioperatoria es considerable, son relativamente frecuentes las arritmias (10-20%, especialmente en la neumonectomía) y el síndrome de distrés respiratorio. Precisan profilaxis tromboembólica por riesgo de TVP y TEP (medias de compresión intermitente, y HBPM a iniciar a partir del 2º día postoperatorio). Pueden existir morbilidad coronaria, fallo ventricular derecho, y otras complicaciones, como fístula broncopleural, quilotórax, enfisema subcutáneo, o lesiones neurológicas quirúrgicas (nervio frénico, laríngeo recurrente) o posturales (plexo braquial).
Bibliografía
- Starke H, von Dossow V, Karsten J. Preoperative evaluation in thoracic surgery: Limits of the patient’s functional operability and consequence for perioperative anaesthesiologic management. Curr Opin Anaesthesiol 2021; 35:61-68. (PubMed)
- Fiore JF Jr, Bejjani J, Conrad K, Niculiseanu P, Landry T, Lee L,et al. Systematic review of the influence of enhanced recovery pathways in elective lung resection. J Thorac Cardiovasc Surg 2016; 151:708. (PubMed)
- Batchelor TJP, Rasburn NJ, Abdelnour-Berchtold E, Brunelli A, Cerfolio R, González M, et al. Guidelines for enhanced recovery after surgery after lung surgery: Recommendations of the Enhanced Recovery After Surgery (ERAS®) Society and the European Society of Thoracic Surgeons (ESTS). Eur J Cardiothorac Surg 2019; 55:91. (PubMed)
- Raphael J, Regali LA, Thiele RH. Hemodynamic monitoring in thoracic surgical patients. Curr Opin Anaesthesiol 2017; 30:7. (PubMed)
- Şentürk M, Sertaç Bingül E, Turhan O. Should fluid management in thoracic surgery be goal directed? Curr Opin Anaesthesiol 2021; 35:89-95. (PubMed)
- De La Gala F, Piñeiro P, Reyes A, Simón C, Vara E, Rancan L, et al. Postoperative pulmonary complications, pulmonary and systemic inflammatory responses after lung resection surgery with prolonged one-lung ventilation. Randomized controlled trial comparing intravenous and inhalational anaesthesia. Br J Anaesth 2017; 119:655. (PubMed)
- Lohser J, Slinger P. Lung injury after one-lung ventilation: A review of the pathophysiologic mechanism affecting the ventilated and collapsed lung. Anesth Analg 2015; 121:302. (PubMed)
- Yao S, Mao T, Fang W, Xu M, Chen W. Incidence and risk factors for acute lung injury after open thoracotomy for thoracic diseases. J Thorac Dis 2013; 5:455. (PubMed)
- Park M, Ahn HJ, Kim JA, Yang M, Heo B, Choi J et al. Driving pressure during thoracic surgery: A randomized controlled trial. Anaesthesiology 2019; 130:385. (PubMed)
- Park SK, Yoon S, Kim BR, Choe S, Bahk J, Seo J. Pre-emptive epidural analgesia for acute and chronic post-thoracotomy pain in adults: a systematic review and meta-analysis. Reg Anesth Pain Med 2020; 45:1006. (PubMed)