Nicolás Aller, Sofía Adonina(1) https://orcid.org/0000-0002-7888-2328;
Ferrer Cerón, Silvia (1); Gil Robles, Elsa(2); Cabero Pérez, José Alberto(3)
(1)Médico Licenciada Especialista en Anestesiología y Reanimación
(2)Graduada en Enfermería, adscrita al Servicio de Anestesiología y Reanimación
(3)Médico Interno Residente de Anestesiología y Reanimación
Complejo Asistencial Universitario de León, España
Cómo citar este artículo: Nicolás Aller, S. A., Ferrer Cerón, S., Gil Robles, E., & Cabero Pérez, J. A. (2024). Anestesia libre de opioides. Revisión de la técnica y aplicación en un caso de paciente adicto a opiáceos. Revista Electrónica AnestesiaR, 16(1). https://doi.org/10.30445/rear.v16i1.1183
Opioid-free anesthesia (OFA). Review of the technique and application in a case of a patient addicted to opioids.
Resumen
Introducción
Los opioides son la base clásica de la antinocicepción, pese a sus efectos indeseables conocidos: náuseas, vómitos, sedación, íleo, depresión respiratoria, hiperalgesia, tolerancia, dolor crónico postoperatorio, adicción y otros. La anestesia libre de opioides utiliza ketamina, magnesio, dexmedetomidina, lidocaína junto con fármacos coadyuvantes: antiinflamatorios no esteroideos, corticoides, bloqueantes beta-adrenérgicos… y, además, técnicas anestésicas locorregionales, lográndose antinocicepción intraoperatoria y analgesia postoperatoria para sustituir, en lo posible, a los opioides.
Método
Presentamos un caso de un paciente adicto crónico a narcóticos, que fue sometido a una operación de Miles. El manejo anestésico se realizó con un catéter epidural lumbar por el que se administraron bolos de levobupivacaína 0,25% durante el período intraoperatorio, junto con un protocolo de fármacos no-opioides. En primer lugar, como analgesia preemptiva, con objeto de prevenir la sensibilización periférica y central, una mezcla de antiinflamatorios no esteroideos, dexametasona y sulfato magnésico.
Posteriormente se utilizaron, durante la inducción y mantenimiento anestésico, una combinación de lidocaína, dexmedetomidina y ketamina, a dosis bajas. Como hipnótico, se empleó propofol; y rocuronio como bloqueante neuromuscular.
Resultado
La anestesia libre de opioides permitió un adecuado manejo anestésico, con estabilidad hemodinámica óptima y ningún efecto secundario reseñable.
Conclusión
La anestesia libre de opioides es muy adecuada en el manejo anestésico de pacientes adictos a opioides/opiáceos, consiguiéndose con ella resultados excelentes. Se requiere una amplia familiarización del anestesiólogo con la farmacología de las diversas fórmulas empleadas, así como su protocolización.
PALABRAS CLAVE: Anestesia libre de opioides, laparotomía de Miles, farmacodependencia, nocicepción, dolor, efectos adversos de opioides/opiáceos.
Introducción
La anestesia libre de opioides (ALO) —o en inglés Opioid Free Anaesthesia (OFA)— es una técnica en la que no se utilizan opioides sistémicos, ni por vía neuraxial ni intracavitaria, durante el período perioperatorio.
El desarrollo de estrategias multimodales para el control de la nocicepción intraoperatoria y del dolor agudo postoperatorio, junto con el uso de técnicas locorregionales y adyuvantes terapéuticos, permiten afrontar procedimientos quirúrgicos complejos con buenos resultados.
Esta técnica tiene múltiples beneficios demostrados en cuanto a la prevención de los efectos secundarios asociados a los opiáceos/opioides [ORAEs: opioid-related adverse events] [1]: depresión respiratoria y rigidez muscular, respiración obstructiva, náuseas, vómitos, temblores, íleo paralítico, retención urinaria, tolerancia y adicción a opiáceos, excesiva somnolencia y delirio, hiperalgesia, inmunodepresión, etc. [2].
Forma parte también de los protocolos de recuperación acelerada después de cirugía [ERAS: Enhanced Recovery After Surgery] (Fig. 1).
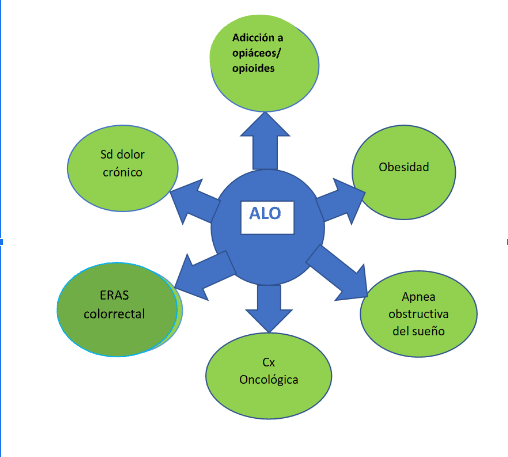
ALO: Anestesia libre de opioides; Sd: Síndrome; Cx: cirugía; ERAS: Enhanced Recovery After Surgery.
La adicción a narcóticos es un grave problema de salud pública a nivel mundial, que en EEUU se cobra alrededor de 50.000 fallecimientos por año debidos a sobredosis. Los opioides sintéticos (fentanilo, carfentanilo, heroína) son los principales responsables, pero también la comunidad médica contribuye mediante la sobreprescripción de fármacos opiáceos/opioides para el tratamiento del dolor agudo y crónico [3].
En pacientes quirúrgicos con farmacodependencia, el manejo del dolor agudo postoperatorio es complicado porque se acentúan los riesgos de cronificación del dolor, tolerancia e hiperalgesia inducida por opioides/opiáceos.
El plan anestésico, por lo tanto, debe ser multimodal, con una combinación de analgesia preemptiva [4] con gabapentinoides, analgesia regional/neuraxial y fármacos coadyuvantes no opioides [ketamina, magnesio, lidocaína, dexmedetomidina, antiinflamatorios no esteroideos (AINEs), fármacos beta-bloqueantes, etc.].
Los pacientes en tratamiento con metadona, opioide sintético, se consideran tolerantes a opiáceos/opioides y pueden tener una sensibilidad al dolor aumentada (sensibilización nociplástica). Dada la larga vida media de este fármaco (promedio: 20-35 h), se recomienda mantenerla preoperatoriamente con la pauta de dosificación habitual [5].
Metodología
Se realizó una búsqueda no sistemática, sin límites, en Medline/PubMed, Google Scholar y Cochrane Library, así como en la biblioteca virtual Scielo. Los términos empleados fueron: «opioid free anaesthesia» AND «opioid use disorder» AND «opioid addiction» OR «multimodal analgesia» OR «surgery» OR «Alpha-2 agonists» OR «ketamine» OR «lidocaine». Se procedió a una revisión de títulos y resúmenes principalmente revisiones sistemáticas y metaanálisis, seleccionando aquellos más significativos de los últimos veinte años.
Resultados
Se trataba de un paciente de 61 años, 172 cm de altura y 82 kg, índice de masa corporal (IMC) de 27,7; categorizado como ASA II en la escala American Society of Anesthesiologisth Physical Status, de evaluación del riesgo preanestésico. Había sido intervenido inicialmente por adenocarcinoma de recto, con resección y anastomosis término-terminal mediante laparoscopia, dos años atrás. Ahora presentaba una recidiva tumoral presacra y precisaba la realización de amputación abdómino-perineal clásica o interesfintérica (AAP-c) mediante laparotomía, en decúbito supino (Técnica de Miles modificada).
El paciente había sido consumidor de heroína por vía parenteral en su juventud, y llevaba varios años en tratamiento sustitutivo crónico con metadona 40 mg vía oral (vo) /diaria. Se suministró dicha medicación, en formato líquido, el mismo día de la intervención quirúrgica tal y como se recomienda [3], y se premedicó al paciente con lorazepam 1 mg vo 90 min antes y midazolam 0,02 mg/kg intravenoso (iv) al llegar al quirófano. No se realizó preparación mecánica intestinal en planta y sí profilaxis antibiótica.
Una vez informado del procedimiento anestésico-quirúrgico a realizar, se recabó su consentimiento.
Inicialmente se colocó un catéter epidural a nivel lumbar L4-L5, y tras la dosis-test (bupivacaína 0,5% con adrenalina, 3 cc), a los 10 min, se administró un primer bolo de levobupivacaína 0,25% de 5 cc, sin apreciar bloqueo motor o sensitivo drástico que indicaran colocación intradural. La intervención quirúrgica se realizó con monitorización hemodinámica invasiva mediante canalización de arteria radial izquierda y vena yugular interna derecha, con temperatura central mediante sonda vesical Foley con sensor incorporado, y monitorización cuantitativa del bloqueo neuromuscular mediante estimulación del nervio cubital y evaluación de la respuesta en el músculo aductor corto del pulgar mediante acelerometría con el monitor ToFscan© de Dräger.
El nivel de nocicepción intraoperatoria se evaluó mediante el índice pletismográfico quirúrgico (SPI: Surgical Pleth Index), que refleja la respuesta simpática al estímulo quirúrgico. El SPI se calcula a partir de la frecuencia (cardiaca) de pulso, latido a latido, y la amplitud fotopletismográfica del pulso.
Se empleó el módulo integrado en el monitor Carescape B650 de General Electric (GE HealthCare, Helsinki, Finlandia). Valores entre 20-50, o un incremento ≥10 (respecto al valor de referencia), representan una orientación para la dosificación de opioides intraoperatorios [6, 7].
Se suministró en la preinducción anestésica —y como analgesia preemptiva— una infusión intravenosa de sulfato magnésico a dosis de 40 mg/kg junto con dexametasona 0,1 mg/kg y AINEs (metamizol magnésico 2 g y dexketoprofeno 50 mg), durante 15 min.
Los fármacos ALO para inducción y mantenimiento se encontraban preparados y mezclados, según un protocolo que manejamos en nuestro hospital (aprobado por la comisión de calidad del Hospital de León), en las siguientes concentraciones: lidocaína 10 mg/mL, ketamina 1 mg/mL y dexmedetomidina 1 µg/mL (Fig. 2).
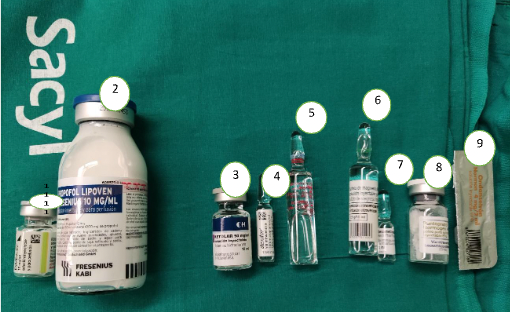
(1): Rocuronio (Esmeron, Schering-Plough®) 10 mg/ml, 5ml; (2): Propofol, Lipoven Fresenius®10 mg/ml, 50 ml; (3): Ketamina (Ketolar, Pfizer®) 50 mg/ml, 10 ml; (4): Dexmedetomidina (Dexdor, Orion Pharma®) 100 µgr/ml, 2 ml; (5): Lidocaína (Normon®) 50 mg/ml, 10 ml; (6): Sulfato de Magnesio (Genfarma®) 150 mg/ml, 10 ml; (7): Dexametasona (Kern-Pharma®) 4 mg/ml, 1ml; (8): Pantoprazol (Normon®) 40mg/vial; (9): Ondansetron (Normon®) 4mg, 2cc.
Durante la inducción anestésica se suministró un bolo intravenoso de 0,1 mL/kg de dicha dilución, junto con propofol 3 mg/kg y rocuronio 0,6 mg/kg. Se administró también atropina 0,01 mg/kg, que actuaba como antisialogogo.
Para el mantenimiento anestésico, se proporcionó propofol en perfusión continua a dosis aproximada de 3 mg/kg /h, adaptándose a los datos suministrados por el BIS (Bispectral Index Monitor Covidien®) para mantener una profundidad hipnótica en rango numérico entre 40 y 60.
La perfusión ALO se mantuvo en el siguiente rango de dosificación: lidocaína 1 mg/kg/h, ketamina 1,6 µg/kg/min, dexmedetomidina 0,1 µg/kg/h, muy por debajo este último de las dosis utilizadas en otras publicaciones [2]. También el bloqueante neuromuscular (rocuronio) se proporcionó en perfusión continua a dosis de 0,6 mg/kg/h para mantener 0 respuestas train-of-four (TOF), bloqueo neuromuscular profundo, en el monitor.
Unos treinta minutos antes del fin de la operación, se disminuyó la velocidad de la perfusión ALO a la mitad, y se detuvo al iniciar el cierre de la laparotomía. Durante el procedimiento quirúrgico se administraron también pantoprazol 40 mg iv, ondansetrón 0,1 mg/kg iv y paracetamol 15 mg/kg iv, así como bolos de levobupivacaína 0,25%, 10 cc cada 90 min, por el catéter epidural lumbar.
Se mantuvo estabilidad hemodinámica adecuada durante toda la intervención quirúrgica (Fig. 3) y óptimos parámetros analíticos en las gasometrías seriadas realizadas.
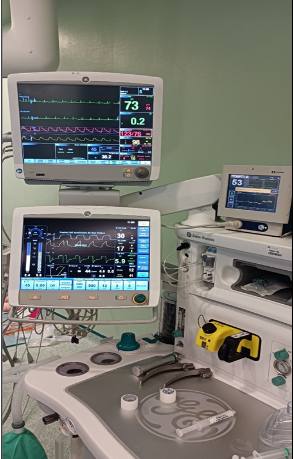
Monitor multiparamétrico General Electric Carescape® B650. Especificación de parámetros de arriba a abajo y de izquierda a derecha: frecuencia cardiaca (73 lpm). Variación ST (0,2). Tensión arterial invasiva 123/76 mm Hg. SpO2 98%. Variación de la presión de pulso 10%. Monitorización TOF (no operativa, se midió en un monitor independiente). SPI* (Surgical Pletismography Index) 45. Temperatura central 36,2 ̊C. En el lado derecho de la fotografía, Monitor de paciente EEG BIS™ Covidien (BIS 53).
*Indice Pletismográfico Quirúrgico (SPI, Surgical Pletismography Index) para estimar el nivel de nocicepción intraoperatoria. Este índice se basa en la frecuencia del pulso (lpm) y la amplitud fotopletismográfica del pulso, obtenidas a partir de un pulsioxímetro.
Finalizada esta, a las seis horas, se revirtió el bloqueo neuromuscular con sugammadex, 2 mg/kg hasta alcanzar un TOFr (T4/T1) eficaz ≥0,98, y el paciente fue extubado con un nivel 2 de sedación en la escala de Ramsay, y con capacidad ventilatoria adecuada; constatándose bloqueo motor nivel 1 en la escala de Bromage y bloqueo sensitivo metamérico T8 objetivado con pérdida de sensación de frío con alcohol, realizándose su trasladado a Reanimación.
El paciente presentó una evolución adecuada, sin efectos secundarios destacables, manteniéndose durante su estancia una perfusión epidural lumbar con levobupivacaína 0,125%, sin adición de opiáceos, a dosis continua de 6-8 ml/h, junto con la administración pautada de AINEs y ondansetrón 0,1 mg/kg iv. En todo momento, la analgesia postoperatoria fue adecuada; se objetivó una valoración analgésica en la Escala Visual Analógica (EVA) de 2-4 y el grado de satisfacción del paciente fue muy bueno.
Discusión
El tratamiento con opioides/opiáceos ha sido el estándar de la anestesia basada en opioides (ABO), para modular la respuesta hormonal al estrés quirúrgico durante y después de la cirugía. El concepto de anestesia y de analgesia multimodal sin opioides/opiáceos intenta contrarrestar los procesos fisiopatológicos implicados, tanto en la nocicepción intraoperatoria como en el dolor postoperatorio, suministrando fármacos anestésicos eficaces, con menos efectos adversos [8].
Actualmente, los opioides se intentan evitar en los protocolos ERAS, dado que su utilización interfiere con el alta precoz, prolonga la estancia y aumenta los costes hospitalario [9, 10]. Además, los opioides/opiáceos producen numerosos efectos secundarios ya nombrados, y tolerancia adquirida (aguda/crónica) por insensibilización del nociceptor periférico y/o central, y por inducción enzimática [citocromo P450, OATP (Organic Anion Transporting Polypeptide)] [11]; lo cual se traduce en una demanda in crescendo de los mismos para conseguir tanto el efecto antinociceptivo (intraoperatorio) como el analgésico (postoperatorio) deseado.
También inducen hiperalgesia/alodinia, un estado de disminución del umbral de respuesta a estímulos dolorosos, especialmente en pacientes tratados con opioides (remifentanilo) y/o adicción a opiáceos, dada su mayor neurosusceptibilidad al dolor nociplástico [12, 13].
A pesar de que el mecanismo de este efecto es multifactorial y no del todo comprendido, se supone la implicación del sistema glutamatérgico y la activación patológica del receptor de N-metil-D-aspartato (NMDA) y/o una disfunción del sistema gabaérgico (GABA), por lo que la anestesia basada en opioides (ABO) (por ejemplo neurolepto-anestesia/analgesia) aumentaría el riesgo de dolor agudo y/o crónico postoperatorio, de fenómenos de tolerancia adquirida (inducción enzimática), y de farmacodependencia e intoxicación (inhibición enzimática), así como de hiperalgesia opioide-inducida (dolor nociplástico) y de la denominada paradoja opioide: cuantos más opioides se administran en el intraoperatorio, más opioides se necesitan en el postoperatorio [14].
Los opioides/opiáceos deterioran tanto la inmunidad celular como la humoral en humanos. Están implicados en la supresión de la respuesta inmune y se cree que pudieran influir en la evolución de la cirugía oncológica, incluyendo un incremento del riesgo de infección y de metástasis [10, 14]. Sin embargo, en la actualidad no hay evidencia de clase I y los diferentes metaanálisis ad hoc ni confirman ni rechazan la capacidad de alterar los resultados en la cirugía oncológica [15, 16].
También es muy preocupante la avalancha de informes sobre adicción a narcóticos (opioides/opiáceos) y muertes ocasionadas por ellos, requiriéndose con urgencia el desarrollo de estrategias anestésicas opioid-less o directamente opioid-free [17].
En pacientes diagnosticados de trastorno por consumo de narcóticos, las publicaciones recientes recomiendan el uso de técnicas perioperatorias sin opiáceos/opioides, para el manejo de la nocicepción y del dolor, ya que mejoran su pronóstico y disminuyen el riesgo de recaída [2, 8].
El concepto de ALO maximiza los beneficios de múltiples fármacos que actúan de forma aditiva o sinérgica, mediante diferentes mecanismos de acción:
- análogos del GABA (gabapentina y pregabalina) que bloquean los canales de calcio voltaje-dependientes [12], estimulan la inhibición descendente nociceptiva e inhiben mediadores inflamatorios,
- bloqueo de los receptores NMDA (magnesio, ketamina, metadona),
- bloqueo de la respuesta inflamatoria (AINEs, COX-2, dexa/beta-metasona, lidocaína),
- y bloqueo simpático (alfa2-agonistas, betabloqueantes y anestesia neuroaxial).
Los AINEs y los corticoides reducen los mediadores inflamatorios generados en los tejidos lesionados [18].
El magnesio y la ketamina son antagonistas no competitivos del receptor NMDA, especialmente útiles cuando se combinan ambos, ya que disminuyen la hiperalgesia y la tolerancia a opiáceos, logrando mejor control del dolor postoperatorio en pacientes adictos a dichas sustancias; y además reducen las náuseas y vómitos postoperatorios.
La metadona también tendría propiedades antihiperalgésicas, al menos en teoría, a falta de estudios adicionales [9, 19].
También se emplea dexmedetomidina (agonista-alfa2 adrenérgico) que reduce la intensidad de la nocicepción intraoperatoria, del dolor postoperatorio y el consumo de opiáceos, así como la emesis postoperatoria. Además, está especialmente indicada en esta población, por su beneficio al prevenir el síndrome de abstinencia.
La lidocaína (anestésico local tipo amida, de corta duración y bloqueante de los canales de sodio) produce excelente analgesia cuando se administra por vía intravenosa, presenta efecto antihiperálgico y antiinflamatorio, aunque este uso es off-label, y previene el íleo paralítico.
El esmolol es un bloqueante ß-1 cardioselectivo, de corta duración, que atenúa la respuesta simpática (taquicardia, hipertensión) durante la utilización de la ALO [9].
El ondansetrón es un fármaco antagonista del receptor de serotonina 5-HT3 que se usa como antiemético, pero se ha descrito que los receptores 5-HT están involucrados en el procesamiento e integración de la nocicepción/dolor; y se estudian sus propiedades analgésicas [12].
Los bloqueos simpáticos, regionales y/o centrales, también contribuyen a un menor consumo de opioides perioperatorios [5, 9].
Se han publicado múltiples guías clínicas sobre la anestesia multimodal libre de opioides (OFA) o reducida de opioides [OLA: Opioid Less Anaesthesia] combinando los fármacos de diversas formas, en bolo, infusión continua, diversas dosis empleadas, etc. Todas ellas tienen en común el uso de un elevado número de fármacos, una clara reducción del consumo de opiáceos/opioides en el postoperatorio, y una dramática disminución de las náuseas y vómitos postoperatorios, así como del temblor post-anestésico [1].
Si bien, hay que tener en cuenta la posibilidad de incompatibilidad (farmacológica, farmacocinética y/o farmacodinámica) de la mezcla, de ahí que debería estandarizarse de forma individualizada [9]. Aunque muchas instituciones tienen su propio «cóctel», y algunos incluso se publican en la literatura científica, las pruebas sobre los beneficios de tales combinaciones de múltiples fármacos aún son escasas. Por lo que hay que ser prudentes, hasta obtener pruebas basadas en evidencia, de un balance positivo de beneficios sobre los riesgos. Además, tampoco están claramente definidas las dosis de cada uno de los fármacos incluidos [20].
Entre las interacciones medicamentosas (drug-drug interactions), la polimedicación incrementa el riesgo de secundarismos, de ahí que se sugiera minimizar la politerapia. El Mg y el bloqueo neuroaxial potencian el bloqueo neuromuscular del rocuronio. El Mg potencia a los hipnóticos (propofol). El bloqueo neuroaxial puede ocasionar hipotensión y bradicardia, efectos potenciados por el Mg; y la dexmedetomidina, bradicardia, hipotensión y sedación postoperatoria excesiva [2].
La metadona puede prolongar el intervalo QT predisponiendo a síncope cardiogénico, taquicardias ventriculares polimórficas (TdP: torsión de puntas o Torsades de Pointes) que puede llevar a fibrilación ventricular o muerte súbita. Se sugiere vigilar el intervalo QT del paciente en tratamiento con metadona, y debe suspenderse en caso de que provoque una duración del intervalo QTc > 500 ms. También se recomienda evitar fármacos concomitantes (ondansetrón, domperidona, pantoprazol, droperidol e incluso el propofol, pentobarbital y etomidato) que prolonguen el intervalo QT y evitar su prescripción en pacientes con un intervalo QT ligeramente prolongado (> 380 ms) o mejor, el intervalo QT corregido por frecuencia cardiaca (QTc > 450 ms con frecuencia de 75 lpm) [3, 12].
El bloqueo de receptores NMDA por Mg, ketamina y metadona puede ir más allá del efecto nociceptivo/dolor y afectar a sinapsis del sistema límbico, desenmascarando los desórdenes cognitivos o de conducta de la ketamina a «dosis subanestésicas». No obstante, no hemos encontrado ninguna complicación en nuestra experiencia, ya relativamente amplia, ni en la literatura revisada.
En el paciente de nuestro caso, empleamos un bloqueo neuroaxial [9] y el protocolo ALO que utilizamos habitualmente en nuestro hospital. Para un adulto, sin alergias a ninguno de los componentes, consiste en administrar antes de la incisión quirúrgica, una mezcla intravenosa de sulfato magnésico 40 mg/kg, metamizol 2 g, dexketoprofeno 50 mg y dexametasona 0,1 mg/kg. Simultáneamente administramos un bolo de levobupivacaína 0,25% de 10 cc por el catéter epidural lumbar [10]. A continuación, se preparó otro bolo iv de ondansetrón 0,1 mg/kg. El objetivo es la triada de Friedberg: prevenir la sensibilización central a las aferencias nociceptivas del dolor, eludir el retraso del despertar y evitar la emesis postoperatoria [21].
Para la inducción y mantenimiento anestésico, además de propofol a dosis habituales, se utiliza la mezcla ALO, que lleva lidocaína, dexmedetomidina y ketamina en las concentraciones y dosis ya referidas.
La velocidad de infusión puede aumentarse en caso de presentarse elevación del índice biespectral (BIS >65) o del SPI, con la utilización de la lidocaína a 1,5-3 mg/kg/h, como elemento limitante para no alcanzar niveles plasmáticos potencialmente tóxicos (dosis total de lidocaína 574 mg y 67 mg de levobupivacaína para 6 h de cirugía; dosis máxima recomendada de lidocaína: 3-5 mg/kg iv).
También se puede modular con bolos iv de esmolol, labetalol o urapidilo, que no fueron necesarios en este caso. Las dosis medias utilizadas de dexmedetomidina 0,1 µg/kg/h y ketamina 1,6 µg/kg/min son más bajas que las referidas en otras publicaciones [2]; pero optamos por ser más prudentes para aminorar efectos secundarios y excesiva sedación residual, circunstancia posible con el uso de agonistas ɑ-2 como la dexmedetomidina, que si bien puede obviarse en los protocolos ALO [22], preferimos utilizarla por su favorable perfil en este tipo de pacientes adictos a opiáceos/opioides [2].
La cirugía abdominal mayor se asocia con daño tisular regional y desórdenes de la homeostasia que conllevan una respuesta inflamatoria (SIRS: systemic inflammatory response syndrome) que facilita las complicaciones postoperatorias a través del desequilibrio inmunológico y el hipercatabolismo. La ketamina, dexmedetomidina, lidocaína y aminoácidos intraoperatorios, además de sus efectos antinociceptivos, han demostrado disminuir los marcadores pro-inflamatorios (IL-6, IL-8, Factor de necrosis tumoral: TFN-α) y aumentar los anti-inflamatorios: IL-10 [16, 23].
La anestesia intravenosa total (TIVA) pura (sin gas/vapor) presenta un alto riesgo de despertar intraoperatorio, incluso con dosificación target (biofase), por tanto se recomienda la ALO guiada por monitorización de la hipnosis (espectrograma-EEG: entropía, BIS o similar) y, si es factible, de la nocicepción (índice NOL, índice ANI, índice SPI, índice SSI, índice qNOX o similares).
El concepto de adecuación de la anestesia (AoA: adequacy of anaesthesia) refleja la intención de guiar la anestesia «personalizada» en función de tres parámetros: nivel de hipnosis, equilibrio nocicepción-antinocicepción y grado de bloqueo neuromuscular[7].
En nuestro caso, el SPI facilitó una técnica anestésica ALO adecuada (AoA) del paciente [24] y alcanzar el objetivo de proporcionar una medicina perioperatoria personalizada [9], ya que, al optimizar la dosificación de fármacos anestésicos, se mitiga el despertar intraoperatorio y los movimientos del paciente, se consigue mayor estabilidad hemodinámica y se minimiza la sobre-dosificación/acumulación, que se traduce en una educción anestésica más precoz y rápida [6, 9, 25].
Por otro lado, no hay modelos farmacológicos target para la utilización de la bomba farmacológica/ «cóctel» en perfusión continúa prolongada, y no se tiene seguridad sobre si la polifarmacia pudiera provocar interacciones farmacológicas de todo tipo, e incluso reacciones idiosincrásicas [9, 26].
Por otro lado, la tolerancia cruzada conlleva fenómenos de dependencia farmacológica (dolor nociplástico) y de toxicidad por incremento de metabolitos activos. Además, algunos fármacos actúan como ligando sobre diferentes receptores, p. ej.: la metadona (receptor: µ y NMDA).
Es llamativo que, en el caso presentado, se utilizaron tres fármacos (ketamina, Mg y metadona) con efecto sobre el receptor NMDA. Existe una tendencia creciente a considerar que todos los medicamentos pertenecientes a un mismo grupo terapéutico son idénticos y, por tanto, «no aportan ninguna ventaja» terapéutica debido al potencial fenómeno de la tolerancia cruzada. Sin embargo, aunque la combinación de fármacos en clínica no debe tomarse como norma, las excepciones son posibles pese a la escasa información farmacológica y clínica que poseemos al respecto [27].
La ALO puede mitigar los resultados adversos de la anestesia basada en opioides (ABO), pero quedan preguntas importantes sobre el impacto real en términos de analgesia y la mejora de los resultados quirúrgicos. El concepto de ALO se puede resumir como anestesia multimodal para suministrar ABO [15].
El papel de los fármacos opioides en el control de la nocicepción y del dolor ha sido y sigue siendo indispensable. Sin embargo, es evidente la necesidad de mejorar y avanzar hacia nuevas generaciones de opioides que tengan un mejor perfil de efectividad-seguridad. Las estrategias de investigación que se están siguiendo son prometedoras, ampliando el conocimiento del sistema opioide endógeno, que es ciertamente complejo. Continuamente se descubren nuevas moléculas con perfiles de afinidad más selectivos y nuevas formas de interactuar con el sistema opioide endógeno o de actuar a nivel de los receptores opioides periféricos. Somos optimistas y estamos seguros de que, en los próximos años, todas estas investigaciones empezarán a dar paso a fármacos opioides de nueva generación. Y se abrirá paso a nuevos y prometedores fármacos, algunos ya comercializados en España [28].
El carfentanil es un opioide sintético derivado del fentanilo. Es un agonista del receptor opioide µ con una potencia 10.000 veces mayor a la morfina y 30 veces mayor al fentanilo. Actualmente su uso se limita a animales o, en dosis pequeñas, para investigación; pero su uso como droga ilícita ha ido en aumento en el mundo en los últimos años [29, 30].
La oliceridina es un agonista del nociceptor opioide µ, que forma parte de ligandos sesgados; es decir, activa preferentemente una vía de señalización intracelular sobre otra. Al estimular selectivamente el acoplamiento de la proteína G y regular a la baja el reclutamiento de la β-arrestina, disminuye el desarrollo de ORAEs, en especial la depresión respiratoria y la emesis [31, 32].
La esketamina, enantiómero S(+) de la ketamina racémica, es un antagonista no competitivo del receptor NMDA, que se une con mayor avidez que el enantiómero levógiro [R(-)], produciendo un efecto más potente; lo que permite el uso de dosis más bajas, que resulta en menos incidencia de efectos psicoactivos (alucinaciones, pesadillas, ensoñaciones, agitación psicomotora) [anestésico disociativo], mientras se mantienen los efectos benéficos (analgesia, sedación) del fármaco.
La S-ketamina se utiliza por vía intranasal en psiquiatría para los trastornos depresivos mayores [33] y puede emplearse en combinación con otros fármacos para técnicas ALO [34] o ARO [ARO: anestesia reducida en opioides] [35], reduciendo el consumo de propofol en un 20% y con un efecto analgésico positivo, así como una hemodinámica más estable.
El fospropofol, profármaco del propofol, es un hipnótico en solución acuosa que aporta ventajas en cuanto a menos efectos indeseables, si bien su inicio de acción es más lento (4-13 min). Sus características farmacocinéticas/-dinámicas son diferentes a las del propofol. Debido a su formulación no produce dolor a la inyección iv, ni produce hiperlipidemia, y no favorece el sobrecrecimiento bacteriano [36].
El remimazolam actúa sobre los receptores GABA-alfa, como el midazolam, y tiene el metabolismo órgano-independiente mediante esterasas tisulares. Este fármaco tiene una mayor rapidez de acción que el midazolam (pico de acción entre 1 y 3 min) con una vida media de eliminación menor, lo que en teoría lo hace más seguro a efectos ansiolíticos y sedantes en intervenciones de escasa duración [37].
La betametasona, glucocorticoide sintético de acción prolongada (promedio: 36-72 h) y más potente que la dexametasona, actúa como inmunosupresor y antiinflamatorio, pero además presenta un efecto antiemético y analgésico, e incluso orexígeno [38].
Los inhibidores selectivos no competitivos de la ciclooxigenasa-2 (COX-2), se diferencian de los AINEs convencionales en que son inhibidores de la COX-1 y COX-2. Estas enzimas catalizan la conversión del ácido araquidónico a prostaglandina H2 y a tromboxanos. Mientras que la COX-1 produce prostaglandinas, que son beneficiosas para las funciones gástrica y renal, la inflamación causa un incremento en la síntesis de PG dependientes de la COX-2 que sensibiliza los nociceptores periféricos y produce hipersensibilidad local al dolor. Conjuntamente con este efecto, parece existir una COX-2 constitutiva a nivel de la zona dorsal de la médula que es expresada de forma transitoria tras una lesión o traumatismo en los correspondientes segmentos sensoriales de la médula. Este efecto facilitador es bloqueado por inhibidores COX-2 mientras que los inhibidores COX-1 son ineficaces [12].
En cuanto al manejo hemodinámico, disponemos del bloqueante de los canales de calcio clevidipino [39], utilizado por vía intravenosa; y el betabloqueante landiolol, de vida media ultra corta, 4 minutos, con destacados efectos anti-isquémicos y anti-inflamatorios (disminución de IL-6), así como simpático-inhibitorios, sin afectar al inotropismo ni a la presión arterial [40].
Respecto al tratamiento del dolor crónico, numerosos ensayos clínicos, con hierba inhalada y con diversos aerosoles y comprimidos elaborados de manera sintética, muestran falta de evidencia que cualquier producto obtenido del cannabis funcione para el dolor neuropático crónico [41]. Por otro, el consumo (recreacional, medicinal) de fitocannabinoides y/o cannabinoides sintéticos presenta un aumento (>20%) de la emesis y el dolor tras la cirugía, que requieren tratamiento con más antieméticos y analgésicos, incluso con droperidol y opiáceos/opioides, respectivamente [42].
También el óxido nitroso, mezclado con oxígeno al 50-70%, es eficaz como sedante y ansiolítico para procedimientos quirúrgicos menores, principalmente en niños y embarazadas, con escasos efectos secundarios.
Todos ellos son fármacos que, de un modo u otro, sin duda iremos incorporando a nuestro arsenal ALO en los próximos años.
Conclusiones
Un concepto es importantes para entender la ALO: dolor, nocicepción y antinocicepción son conceptos neurofisiológicos diferentes [8]. La antinocicepción puede obtenerse interfiriendo con varios neuromediadores (serotonina, substancia P, norepinefrina, péptidos, y otros), no solo con las encefalinas u opioides, sino también con otros no-opioides. Entonces, los opioides/opiáceos no son esenciales para la anestesia general; de ahí, para los nihilistas, la técnica ALO y, para los estoicos, la anestesia reducida en opioides (ARO) [14].
El manejo de la nocicepción intraoperatoria y del dolor agudo postoperatorio, en el paciente tolerante a opiáceos, puede ser muy difícil [3].
La implementación de estrategias de anestesia y analgesia multimodal sin uso de opioides/opiáceos (ALO), combinadas con neuromonitorización nociceptiva e hipnótica y con técnicas de anestesia regional, obtiene muy buenos resultados y minimiza los efectos secundarios (ORAEs), aunque requiere del anestesiólogo tanto pericia técnica en bloqueos [9] como un conocimiento profundo de la farmacología de los medicamentos administrados [2].
Bibliografía
- Salome A, Harkouk H, Fletcher D, Martinez V. Opioid-Free Anesthesia Benefit-Risk Balance: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. J Clin Med. 2021;10(10):2069. https://doi.org/10.3390/jcm10102069
- Sultana A, Torres D, Schumann R. Special indications for Opioid Free Anaesthesia and Analgesia, patient and procedure related: Including obesity, sleep apnoea, chronic obstructive pulmonary disease, complex regional pain syndromes, opioid addiction and cancer surgery. Best Pract Res Clin Anaesthesiol. 2017;31(4):547-60. https://doi.org/10.1016/j.bpa.2017.11.002
- Scholzen E, Zeng AM, Schroeder KM. Perioperative Management and Analgesia for Patients Taking Buprenorphine and Other Forms of Medication-Assisted Treatment for Substance Abuse Disorders. Adv Anesth. 2019;37:65-86. https://doi.org/10.1016/j.aan.2019.08.002
- Woolf CJ and Chong MS. Preemptive analgesia–treating postoperative pain by preventing the establishment of central sensitization. Anesth Analg. 1993;77(2):362-79. https://doi.org/10.1213/00000539-199377020-00026
- Pozek JJ, Goldberg SF, Baratta JL, Schwenk ES. Practical Management of the Opioid-Tolerant Patient in the Perioperative Surgical Home. Adv Anesth. 2017;35(1):175-90. https://doi.org/10.1016/j.aan.2017.07.009
- Hung SC, Hsu WT, Fu CL, Lai YW, Shen ML, Chen KB. Does surgical plethysmographic index-guided analgesia affect opioid requirement and extubation time? A systematic review and meta-analysis. J Anesth. 2022;36(5):612-22. https://doi.org/10.1007/s00540-022-03094-z
- Gruenewald M, Harju J, Preckel B, Molnar Z, Yli-Hankala A, Rosskopf F, et al. Comparison of adequacy of anaesthesia monitoring with standard clinical practice monitoring during routine general anaesthesia: An international, multicentre, single-blinded randomised controlled trial. Eur J Anaesthesiol. 2021;38(1):73-81. https://doi.org/10.1097/EJA.0000000000001357
- Beloeil H. Opioid-free anesthesia. Best Pract Res Clin Anaesthesiol. 2019;33(3):353-60. https://doi.org/10.1016/j.bpa.2019.09.002
- Chia PA, Cannesson M, Bui CCM. Opioid free anesthesia: feasible? Curr Opin Anaesthesiol. 2020;33(4):512-7. https://doi.org/10.1097/ACO.0000000000000878
- Toleska M, Kuzmanovska B, Kartalov A, Shosholcheva M, Nancheva J, Dimitrovski A, et al. Opioid Free Anesthesia for Laparotomic Hemicolectomy: A Case Report. Pril (Makedon Akad Nauk Umet Odd Med Nauki). 2018;39(2-3):121-6. https://doi.org/10.2478/prilozi-2018-0050
- Martínez LM, Guevara J, Moreno L. ¿Conocemos todas las interacciones farmacológicas?: el transportador OATP1B1. Farm Comunitarios. 2018;10(4):29-32. https://doi.org/10.5672/FC.2173-9218.(2018/Vol10).004.06
- Gil Martín A, Moreno García M, Sánchez-Rubio Fernández J, Molina García T. Hiperalgesia asociada al tratamiento con opioides. Rev. Soc. Esp. Dolor. 2014;21(5):259-69.
- Nijs J, Lahousse A, Kapreli E, Bilika P, Saracoglu I, Malfliet A, et al. Nociplastic Pain Criteria or Recognition of Central Sensitization? Pain Phenotyping in the Past, Present and Future. J Clin Med. 2021;10(15):3203. https://doi.org/10.3390/jcm10153203
- Mulier J. Opioid free general anesthesia: A paradigm shift? Rev Esp Anestesiol Reanim. 2017;64(8):427-30. https://doi.org/10.1016/j.redar.2017.03.004
- Bugada D, Drotar M, Finazzi S, Real G, Lorini LF, Forget P. Opioid-Free Anesthesia and Postoperative Outcomes in Cancer Surgery: A Systematic Review. Cancers (Basel). 2022;15(1):64. https://doi.org/10.3390/cancers15010064
- Lisowska B, Jakubiak J, Siewruk K, Sady M, Kosson D. Which idea is better with regard to immune response? Opioid anesthesia or opioid free anesthesia. J Inflamm Res. 2020;13:859-69. https://doi.org/10.2147/JIR.S275986
- Olausson A, Svensson CJ, Andrell P, Jildenstal P, Thorn SE, Wolf A. Total opioid-free general anaesthesia can improve postoperative outcomes after surgery, without evidence of adverse effects on patient safety and pain management: A systematic review and meta-analysis. Acta Anaesthesiol Scand. 2022;66(2):170-85. https://doi.org/10.1111/aas.13994
- Malo-Manso A, Ramírez-Aliaga M, Sepúlveda-Haro E, Díaz-Crespo J, Escalona-Belmonte JJ, Guerrero-Orriach JL. Anestesia libre de opioides para cistectomía radical laparoscópica en obesidad mórbida. Rev Esp Anestesiol Reanim. 2022;69(7):433-6. https://doi.org/10.1016/j.redar.2021.03.007
- Mugabure Bujedo B. Metadona intraoperatoria: ¿una isla en la anestesia libre de opioides? Rev. Soc. Esp. Dolor. 2020;27(2):140-2. https://doi.org/10.20986/resed.2020.3789/2019
- Tauste-Hernández B, Cortiñas-Sáenz M, Fernández-Ginés FD, Expósito-López JM. Review of binary, ternary and quaternary mixtures for induction and maintenance of opioid free anesthesia. Farm Hosp. 2021;45(3):135-41. https://doi.org/10.7399/fh.11614
- Friedberg BL. Tríada de Friedberg, un camino hacia la anestesia libre de opioides y mejores resultados. Multidisciplinary Pain Journal. 2021;1:98-100. https://doi.org/10.20986/mpj.2021.1004/2021
- Toleska M and Dimitrovski A. Is an opioid-free anaesthesia possible without using alpha-2 agonists? Indian J Anaesth. 2020;64(5):428-31. https://doi.org/10.4103/ija.IJA_664_19
- Sarenac O, Lazovic R, Vukcevic B, Lazovic JR, Palibrk IG. Impact of Perioperatively Administered Amino Acids, Lidocaine, and Magnesium on Inflammatory Response and Pain Associated with Abdominal Surgery: A Prospective Clinical Study. Med Sci Monit. 2023;29:e939204. https://doi.org/10.12659/MSM.939204
- Goff J, Hina M, Malik N, McLardy H, Reilly F, Robertson M, et al. Can Opioid-Free Anaesthesia Be Personalised? A Narrative Review. J Pers Med. 2023;13(3):500. https://doi.org/10.3390/jpm13030500
- Ma D, Ma J, Chen H, Mu D, Kong H, Yu L. Nociception monitors vs. standard practice for titration of opioid administration in general anesthesia: A meta-analysis of randomized controlled trials. Front Med (Lausanne). 2022;9:963185. https://doi.org/10.3389/fmed.2022.963185
- Baek SY, Kim JW, Kim TW, Han W, Lee DE, Ryu KH, et al. Opioid-free anesthesia with a mixture of dexmedetomidine, ketamine, and lidocaine in one syringe for surgery in obese patients. J Int Med Res. 2020;48(10):300060520967830. https://doi.org/10.1177/0300060520967830
- Neira F and Ortega JL. Antagonistas de los receptores glutamatérgicos NMDA en el tratamiento del dolor crónico. Rev Soc Esp Dolor. 2004;11(4):48-60.
- Regueras E, Torres LM, Velázquez I. Nuevas estrategias y generaciones de analgésicos opioides: ¿qué se está investigando?. Multidisciplinary Pain Journal. 2023;3:14-23. https://doi.org/10.20986/mpj.2022.1030/2022
- Kiely E and Juhascik M. Fentanyl, Acetylfentanyl and Carfentanil in Impaired Driving Cases: A Review of 270 Cases. J Anal Toxicol. 2021;45(9):913-7. https://doi.org/10.1093/jat/bkab085
- Leen JLS and Juurlink DN. Carfentanil: a narrative review of its pharmacology and public health concerns. Can J Anaesth. 2019;66(4):414-21. https://doi.org/10.1007/s12630-019-01294-y
- Daksla N, Wang A, Jin Z, Gupta A, Bergese SD. Oliceridine for the Management of Moderate to Severe Acute Postoperative Pain: A Narrative Review. Drug Des Devel Ther. 2023;17:875-86. https://doi.org/10.2147/DDDT.S372612
- Kaye AD, Edinoff AN, Babin KC, Hebert CM, Hardin JL, Cornett EM, et al. Pharmacological Advances in Opioid Therapy: A Review of the Role of Oliceridine in Pain Management. Pain Ther. 2021;10(2):1003-12. https://doi.org/10.1007/s40122-021-00313-5
- González-Pinto A. Esketamina intranasal: un nuevo abordaje para el tratamiento de la depresión resistente al tratamiento. Psiquiatría Biológica. 2020;27(1):9-15. https://doi.org/10.1016/j.psiq.2020.01.001
- Hublet S, Galland M, Navez J, Loi P, Closset J, Forget P, et al. Opioid-free versus opioid-based anesthesia in pancreatic surgery. BMC Anesthesiol. 2022;22(1):9. https://doi.org/10.1186/s12871-021-01551-y
- Zhu T, Zhao X, Sun M, An Y, Kong W, Ji F, et al. Opioid-reduced anesthesia based on esketamine in gynecological day surgery: a randomized double-blind controlled study. BMC Anesthesiol. 2022;22(1):354. https://doi.org/10.1186/s12871-022-01889-x
- Telletxea S, Lauzirika Z, Etxebarria A, Ortega LF. Fospropofol: A new prodrug of propofol. Rev Esp Anestesiol Reanim. 2012;59(9):497-502. https://doi.org/10.1016/j.redar.2012.05.033
- Ilic RG. Fospropofol and remimazolam. Int Anesthesiol Clin. 2015;53(2):76-90. https://doi.org/10.1097/AIA.0000000000000053
- Aasboe V, Raeder JC, Groegaard B. Betamethasone reduces postoperative pain and nausea after ambulatory surgery. Anesth Analg. 1998;87(2):319-23. https://doi.org/10.1097/00000539-199808000-00015
- Xu B, Chen Z, Tang G. The Current Role of Clevidipine in the Management of Hypertension. Am J Cardiovasc Drugs. 2022;22(2):127-39. https://doi.org/10.1007/s40256-021-00494-6
- Kawaguchi M, Kawaraguchi Y, Yamamoto Y, Hayashi H, Abe R, Inoue S, et al. Effects of landiolol on systemic and cerebral hemodynamics and recovery from anesthesia in patients undergoing craniotomy. J Anesth. 2010;24(4):503-10. https://doi.org/10.1007/s00540-010-0931-4
- Mücke M, Phillips T, Radbruch L, Petzke F, Häuser W. Cannabis-based medicines for chronic neuropathic pain in adults. Cochrane Database Syst Rev. 2018;3(3):CD012182. https://doi.org/10.1002/14651858.CD012182.pub2
- Shah S, Schwenk ES, Sondekoppam RV, Clarke H, Zakowski M, Rzasa-Lynn RS, et al. ASRA Pain Medicine consensus guidelines on the management of the perioperative patient on cannabis and cannabinoids. Reg Anesth Pain Med. 2023;48(3):97-117. https://doi.org/10.1136/rapm-2022-104013