Grande Fernández A, Carrasco Pereira P, Alonso Ramos I, Iglesias Guitian R
F.E.A. Anestesiología y Reanimación del Hospital Universitario de Getafe
Cómo citar este artículo: Grande Fernández, A., Carrasco Pereira, P., Alonso Ramos, I., & Iglesias Guitian, R. (2024). Avances en el tratamiento quirúrgico de la hiperplasia benigna de próstata e implicaciones en el manejo anestésico perioperatorio. Revista Electrónica AnestesiaR, 16(6). https://doi.org/10.30445/rear.v16i6.1188
Introducción(1)
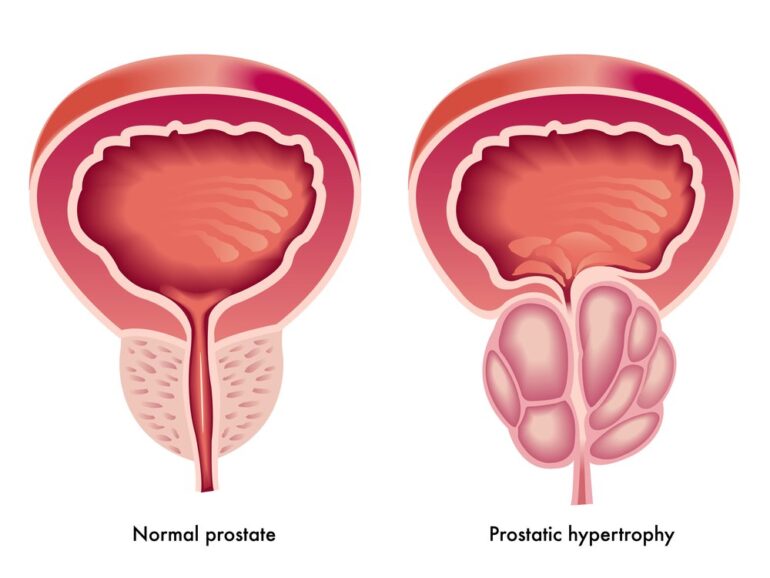
La Hiperplasia Benigna de Próstata (HBP) es una enfermedad muy común entre los hombres en todo el mundo. Su incidencia aumenta a medida que se envejece, siendo del 8% en la cuarta década de la vida y del 80% en la séptima década. Es importante destacar que, aunque los síntomas del tracto urinario inferior (LUTS) moderados o severos son más prevalentes a partir de los 70 años, ya en la cuarta década de la vida, la prevalencia es del 26%.
Materiales y métodos
Para la siguiente revisión de la literatura se ha realizado una búsqueda bibliográfica en PubMed y UpToDate con los siguientes criterios de búsqueda: “Hiperplasia benigna de próstata y anestesia”, “Síndrome post resección transuretral de próstata”, “Tratamiento de la hiperplasia benigna de próstata”, “Hiperplasia benigna de próstata y láser”.
Economía (1)
La HBP tiene un coste verdadero que se compone de tres elementos. En primer lugar, están los costes directos, tales como la medicación, procedimientos diagnósticos o terapéuticos, técnicas de imagen, consultas médicas y otros. En segundo lugar, están los costes indirectos o lost earnings, que se refieren a la disminución de la productividad. Por último, se encuentran los costes intangibles, como el dolor o el sufrimiento.
El coste anual del tratamiento de la HBP en los Estados Unidos es de 4000 millones de dólares y, en promedio, supone una pérdida de tiempo de trabajo de 7,3 horas al año. Es importante destacar que estos costes podrían aumentar en el futuro debido al envejecimiento de la población.
Factores de riesgo y patogénesis de la HPB (1)
La HBP se caracteriza por un aumento del número de células epiteliales y del estroma en el área periuretral y de la próstata debido a un aumento de la proliferación celular o una disminución de la apoptosis o muerte celular programada.
Aunque la causa exacta de la enfermedad es desconocida, se han descrito causas metabólicas, hormonales, inflamatorias y genéticas como posibles causas.
- Los factores metabólicos, como la obesidad y la diabetes, aumentan el riesgo de HBP. El síndrome metabólico también se ha relacionado con la HBP y los síntomas del tracto urinario inferior debido a la inflamación crónica.
- Los andrógenos, especialmente la dihidrotestosterona (DHT), han sido identificados como críticos en el desarrollo de la HBP en los hombres.
- La inflamación, ya sea sistémica o local, puede ser un desencadenante en el desarrollo de HBP. Los niveles elevados de citoquinas como IL-2, IFN alfa, IL-6, IL-8 e IL-15 en áreas de crecimiento prostático apoyan esta hipótesis. Se cree que la inflamación deriva de una activación autoinmune contra el tejido prostático que conduce a la producción de citoquinas y al crecimiento de la próstata.
- Estudios en gemelos indican una posible herencia autosómica dominante en la HBP.
Diagnóstico (2)(3)
Se realiza con el objetivo de evaluar los síntomas, descartar otras posibles causas de LUTS y valorar las complicaciones asociadas. Para ello, se utilizan dos escalas validadas como la AUA-SI (American Urological Association-Symptoms Index) y la IPSS (International Prostate Symptoms Score) para valorar los síntomas de almacenamiento y vaciado, así como la calidad de vida.
Además, se realiza un examen físico que incluye un tacto rectal para determinar el tamaño y la presencia de nódulos en la próstata, aunque esta prueba tiende a infraestimar el volumen de la próstata y tiene una baja sensibilidad en la detección del cáncer de próstata.
También se solicitan pruebas de laboratorio como el PSA, análisis de orina y bioquímica, y ecografía urinaria para descartar otras posibles causas de LUTS.
El PSA es un buen predictor del volumen prostático y del crecimiento prostático (evidencia 1b). El PSA basal puede predecir el riesgo de retención urinaria y de necesidad de cirugía (evidencia 1b). En consecuencia, solo se recomienda medir si el diagnóstico de cáncer cambia la actitud terapéutica o si ayuda para dirigir el tratamiento o la toma de decisiones.
Tratamiento médico de la HPB (1) (2) (4)
El objetivo del tratamiento es disminuir la gravedad de los síntomas y evitar o retrasar el avance de la enfermedad. Consta de tres niveles. La mayoría de los pacientes (54,8%) se tratan mediante medicación, un 35% se somete a seguimiento periódico, y solo un 1,1% se somete a tratamiento quirúrgico.
El primer nivel de tratamiento médico consiste en la vigilancia, la cual se realiza anualmente. Se inicia con educación y cambios en el estilo de vida. Esta etapa inicial implica educación y cambios en el estilo de vida, que incluyen la pérdida de peso, la reducción del consumo de líquidos por la noche o antes de viajes largos, la eliminación del consumo de alcohol y cafeína, la limitación del consumo de irritantes vesicales y diuréticos, el abandono del hábito tabáquico, la prevención de infecciones respiratorias, el aumento de la actividad física, la fisioterapia con ejercicios de Kegel, y la programación de vaciamientos regulares “by the clock” (cada 90-120 min) o técnicas de doble vaciado (un minuto o dos después del vaciado inicial).
Existen varios grupos terapéuticos utilizados en el tratamiento de la HBP:
Bloqueantes de los receptores alfa:
Suponen la primera línea de tratamiento. Producen relajación del músculo liso en la próstata y el cuello vesical, reduciendo la resistencia al flujo urinario. Los receptores alfa 1A adrenérgicos predominan en el tracto urinario inferior, mientras que los alfa 1B y 1D se encuentran en los vasos sanguíneos, sistema nervioso central y fosas nasales.
Los efectos aparecen después de una semana de tratamiento y son eficaces para reducir los síntomas urinarios (IPSS) y aumentar el flujo urinario.
Los efectos secundarios más comunes incluyen mareo, astenia, cefalea, hipotensión ortostática, rinitis y eyaculación retrógrada.
Los fármacos de primera generación son no selectivos y tienen mayores efectos secundarios cardiovasculares y gastrointestinales. Los de segunda generación, como terazosin y doxazosin, requieren dosificación por sus efectos cardiovasculares y el riesgo de hipotensión arterial. Los de tercera generación, como tamsulosina, alfuzosina y silodosina, son mejor tolerados y no requieren titular dosis. Sin embargo, los bloqueantes selectivos de los receptores alfa 1A como tamsulosina y silodosina, registran una mayor tasa de eyaculación retrógrada.
Es importante destacar que los bloqueantes de los receptores alfa pueden causar el síndrome del iris flácido intraoperatorio asociado a intervenciones de cataratas y caracterizado por la tríada de miosis intraoperatoria, prolapso del iris e iris flácido ondulante. Esto aumenta el riesgo de trauma del iris y de ruptura de la cápsula posterior durante la cirugía de cataratas. Por lo tanto, los oftalmólogos deben prestar especial atención a los pacientes que toman estos fármacos, aunque no existe evidencia de mejora con la suspensión preoperatoria de estos medicamentos.
Inhibidores de la 5-alfa reductasa:
Al inhibir la conversión de testosterona en dihidrotestosterona, estos compuestos inducen la apoptosis celular, lo que conduce a una reducción del tamaño de la próstata del 18-28% y una disminución del 50% en el nivel de PSA después de 6-12 meses de tratamiento. Más que reducir la intensidad de los síntomas, previenen la progresión de la HBP. Son más efectivos en próstatas más grandes y su efecto máximo se produce después de 6-12 meses de tratamiento.
La 5-alfa reductasa tipo 1 predomina en piel e hígado, mientras que la tipo 2 predomina en la próstata.
Dentro de estos fármacos destacan el finasteride que actúa en la tipo 2 y el dutasteride que actúa en los tipo 1 y 2.
Aunque los efectos adversos de estos compuestos se producen en menos del 5% de los pacientes, pueden resultar molestos e incluyen impotencia, disminución de la libido, trastornos de la eyaculación, ginecomastia y sensibilidad mamaria. Además, en algunos casos, estos efectos pueden persistir después de que se haya interrumpido el tratamiento, lo que se conoce como síndrome post-finasteride.
En pacientes con próstatas de gran tamaño, se ha observado que el tratamiento con finasteride durante 3 meses antes de la cirugía puede reducir el sangrado perioperatorio. Sin embargo, se requieren más estudios para confirmar estos hallazgos.
Inhibidores de la fosfodiesterasa 5:
Al inhibir la FDE5, estos compuestos aumentan los niveles intracelulares de GMPc, lo que resulta en la relajación del músculo liso del músculo detrusor, de la próstata y la uretra, mediada por la liberación de óxido nítrico. Además, se ha observado que estos medicamentos pueden reducir la inflamación crónica en la próstata y la vejiga. Se aprobaron inicialmente para el tratamiento de la disfunción eréctil, por lo que están especialmente indicados en hombres con síntomas de HBP y disfunción eréctil. Entre los efectos secundarios más frecuentes se incluyen cefalea, dispepsia, flushing, congestión nasal, dolor de espalda, mialgias y sinusitis.
Betabloqueantes:
Estos fármacos actúan estimulando los receptores beta 3 adrenérgicos presentes en el músculo detrusor, lo que produce su relajación y los convierte en una alternativa recomendable para tratar la vejiga hiperactiva. En comparación con los anticolinérgicos, estos medicamentos tienen la ventaja de no provocar sequedad bucal, aunque en algunos pacientes pueden aumentar la presión arterial.
Antimuscarínicos:
El músculo detrusor está inervado por fibras parasimpáticas que liberan acetilcolina, la cual actúa sobre los receptores muscarínicos en las células musculares lisas.
Existen cinco subtipos de estos receptores (M1-M5), de los cuales M2 y M3 se encuentran principalmente en el detrusor. Aunque M2 es más abundante, M3 tiene un papel más relevante en las contracciones de la vejiga.
Hay que tener en cuenta que estos fármacos pueden aumentar el riesgo de retención urinaria, por lo que se debe medir el residuo post-miccional y no se recomiendan si éste es mayor de 150 ml. Se usan para tratar la vejiga hiperactiva y los efectos secundarios más comunes incluyen sequedad de boca, congestión, dispepsia, visión borrosa, retención urinaria, cefalea, somnolencia y náuseas.
Fitoterapias o medicinas alternativas: (5)
En los últimos 20 años, el uso de estas terapias ha aumentado significativamente conviertiéndose en un negocio multimillonario. Se han descrito más de 30 componentes fitoterápicos para el tratamiento de la HBP y ya en 2008 suponían el segundo tratamiento más utilizado para la HBP solo por detrás de los bloqueantes de los receptores alfa.
Sin embargo, la producción de estos tratamientos no está estandarizada y su eficacia no ha sido bien testada en la literatura actual. Por lo tanto, no se ha demostrado claramente el beneficio de estos suplementos.
Aunque pueden ser de utilidad en pacientes con síntomas leves que rechacen el tratamiento farmacológico o que estén preocupados por los efectos secundarios sexuales de los tratamientos médicos, es importante que el paciente comprenda las limitaciones de estos productos.
Los más utilizados son: Saw palmetto (SABAL) (PERMIXON), Pygeum africanum (TADENAN), Secale cereal del polen de centeno (CERNILTON) y Hypoxis rooperi o patata silvestre africana.
Tratamiento quirúrgico de la HBP(6) (7)
Indicado en caso de fracaso del tratamiento médico o si el paciente desarrolla complicaciones como hematuria, litiasis vesicales, infecciones urinarias de repetición o retención urinaria.
Antes de la introducción de la RTUp, los pacientes con HBP se sometían a procedimientos quirúrgicos abiertos. La RTUp fue una innovación al demostrar que se podía resecar el tejido prostático mediante un cistoscopio, siendo posible la eliminación de la mayoría del adenoma cerca de la cápsula prostática de manera segura. En los últimos 15 años se ha avanzado aún más demostrando que se puede realizar una enucleación endoscópica del adenoma prostático, similar a la cirugía abierta.
Actualmente, la mayoría de las técnicas quirúrgicas se realizan a través de la uretra con un cistoscopio. El tejido prostático puede ser removido (resección), destruido (ablación) o comprimido.
La elección de la técnica quirúrgica se basa en el tamaño y la forma de la próstata, el riesgo de sangrado y la actitud del paciente ante los posibles efectos secundarios a nivel sexual, además de la experiencia y preferencia del urólogo.
El gold estándar sigue siendo la RTUp aunque en las guías de la asociación de urología de 2020 se renueva el foco en técnicas mínimamente invasivas (MISTs – Minimally Invasive Surgical Techniques).
Podemos clasificar las técnicas quirúrgicas en:
- MISTs – Minimally Invasive Surgical Treatments:
- WVTT. Rezum system.
- Prostatic urethral lift.
- Técnicas ablativas:
- RTUp monopolar y bipolar.
- Incisión transuretral de próstata.
- Vaporización transuretral de próstata.
- Fotovaporización selectiva de próstata (PVP, láser TURP).
- Enucleación transuretral.
- Aquablación.
- TUMT (Transurethral microwave thermotherapy).
- Prostatectomía simple.
- Experimental: embolización arterial prostática.
WVTT – Water vapor termal therapy – Transurethral Water Vapour Therapy – REZÜM System
La técnica implica la realización de una o varias inyecciones utilizando radiofrecuencia para generar energía térmica en forma de vapor de agua, lo que produce necrosis tisular y muerte celular en el tejido prostático. Es un procedimiento que no tiene impacto en la función sexual y se recomienda para pacientes con próstatas menores a 80 gramos. Además, puede realizarse con una mínima necesidad de anestesia y analgesia. No obstante, se requieren más estudios para comparar su eficacia con la técnica de referencia.
Prostatic urethral lift device – PUL – UroLift
Son pequeños implantes que se colocan en los lóbulos prostáticos, comprimiéndolos contra la cápsula prostática para modificar el lumen prostático. Esta técnica no afecta la función sexual del paciente y está indicada en próstatas de menos de 80 gramos sin lóbulo medio obstructivo. Sin embargo, se ha reportado una tasa de reintervenciones de hasta el 13%. Es necesario realizar más estudios comparativos para evaluar su efectividad frente a la técnica de referencia.
RTU de próstata (8) (9)
La resección transuretral de próstata (RTUp) es el gold standard debido a su eficacia a largo plazo y su nivel de seguridad. Se considera el tratamiento estándar para pacientes con próstatas de 30-80 gramos y síntomas moderados-graves secundarios a HBP, con evidencia 1A. Para llevar a cabo la RTUp, se utilizan dispositivos de electrocauterio vía endoscópica para hacer la resección del tejido prostático a través de la uretra. Sin embargo, debido a que se realiza resección de parte del cuello vesical y del esfínter interno, es posible que aparezca eyaculación retrógrada tras la RTUp. Además, debido a la resección inadvertida del esfínter externo, también es posible la aparición de incontinencia urinaria.
La técnica bipolar se ha comparado con la monopolar y se ha demostrado que no hay diferencias en cuanto a la eficacia, pero la técnica bipolar es superior en cuanto a la seguridad, con una menor estancia hospitalaria, menor riesgo de transfusión y menor incidencia de síndrome post-RTU. Además, requiere una menor curva de aprendizaje y proporciona una mayor satisfacción al paciente. La RTUp bipolar es comparable en resultados a corto, medio y largo plazo a la RTUp monopolar, pero con un perfil de seguridad perioperatorio más favorable, con evidencia 1A.
En 2015, los estudios ya demostraban un mayor beneficio económico a favor de la técnica bipolar. Por estas razones, se considera la RTUp bipolar como la evolución Darwiniana de la técnica de RTUp, reforzando su papel líder en el tratamiento quirúrgico de la HBP y siendo coronada como el nuevo gold estándar en el tratamiento quirúrgico de la HBP.
Incisión transuretral de próstata
Es una técnica endoscópica en la que se realiza una o varias incisiones longitudinales en la próstata utilizando electrocauterio. Se recomienda para tratar próstatas menores de 30 gramos. En comparación con la RTUp, la incisión transuretral tiene una eficacia similar en próstatas menores de 30 gramos, menos complicaciones, menor incidencia de transfusión, menor riesgo de eyaculación retrógrada, menor tiempo quirúrgico y una estancia hospitalaria más corta. Sin embargo, presenta una mayor tasa de reintervenciones a largo plazo, con evidencia 1A.
Prostatectomía simple
Está indicada para pacientes con próstatas de mayor tamaño, normalmente superiores a los 80-100 gramos. Puede realizarse a través de una incisión abierta o mediante cirugía laparoscópica. Es una técnica efectiva y duradera para el tratamiento de la HBP, pero también es la más invasiva en comparación con otras técnicas quirúrgicas (evidencia 1B).
Aunque presenta una eficacia similar a corto y medio plazo en pacientes con próstatas grandes en comparación con la RTUp bipolar y HoLEP (Holmium laser enucleation of the prostate), muestra un perfil de seguridad perioperatoria peor, con mayor estancia hospitalaria y tasa de complicaciones (evidencia 1A). A largo plazo, los resultados son similares a los obtenidos con HoLEP (evidencia 1B.
La recomendación actual es ofrecer la prostatectomía abierta en ausencia de RTUp bipolar o HoLEP en pacientes con síntomas moderados-graves y un tamaño prostático mayor de 80 gramos.
Las técnicas laparoscópica y robótica arrojan resultados similares, con menos pérdida de sangre, menor riesgo de transfusión, menor tiempo de estancia hospitalaria y menos complicaciones en comparación con la cirugía abierta. Sin embargo, estas técnicas requieren un mayor tiempo quirúrgico. No se han encontrado diferencias significativas entre la técnica laparoscópica y la robótica, por lo que la elección entre una u otra dependerá de la preferencia del cirujano y la disponibilidad de los equipos necesarios.
Vaporización transuretral – PVP – Photoselective vaporization of the prostate – Fotovaporización de la próstata (10)
Utiliza el láser KTP potassium-titanyl-phosphate o Greenlight laser de 532 nm. Se basa en una longitud de onda de láser que es absorbida selectivamente por la hemoglobina y los tejidos ricamente vascularizados, lo que produce ablación tisular y deja una fina capa de coagulación para la hemostasia. Esta técnica está indicada en pacientes con próstatas de 30-80 ml y utiliza suero salino como líquido de irrigación, lo que elimina el síndrome post-RTUp clásico.
En comparación con la RTUp, el láser KTP demuestra una mayor eficacia en seguridad gracias a sus propiedades hemostáticas, con un menor tiempo de cateterización y estancia hospitalaria (evidencia 1A). Sin embargo, presenta un mayor tiempo quirúrgico y tasa de reintervenciones. A pesar de estos beneficios, el láser KTP no proporciona ninguna muestra de tejido debido a la vaporización de la próstata durante el procedimiento.
Una ventaja del láser KTP es que puede ser realizado de forma frecuente como un procedimiento ambulatorio. Además, existe evidencia 2-3 de que el tratamiento con láser KTP es seguro en pacientes con tratamiento anticoagulante y antiplaquetario.
Enucleación transuretral (11) (12) (13) (14)
Se utiliza un láser pulsátil que es absorbido por el agua y los tejidos que la contienen para producir coagulación y necrosis tisular limitada a una profundidad de 400 mcg, lo que es suficiente para lograr una hemostasia adecuada. La técnica quirúrgica es similar a la de la prostatectomía, con la resección en bloque de los lóbulos prostáticos y morcelado para su extracción. Los principales tipos de láser utilizados son el láser Holmium:yttrium aluminium garnet (Ho:YAG) (HoLEP – Holmium láser enucleation of the prostate) y el láser Thulium (ThuLEP).
La técnica HoLEP ha sido la más estudiada en comparación con la RTUp y la prostatectomía abierta. Se puede utilizar en cualquier tamaño de próstata y reduce significativamente la pérdida de sangre y la duración de la hospitalización en comparación con la prostatectomía abierta.
En próstatas mayores de 100 gramos, HoLEP ha demostrado una menor estancia hospitalaria, menor tiempo de cateterización y menor sangrado perioperatorio, con una eficacia similar a la RTUp. En próstatas menores de 100 gramos, los resultados son comparables a la RTUp. Sin embargo, es importante tener en cuenta que HoLEP requiere un mayor tiempo quirúrgico y puede causar una mayor incontinencia urinaria de estrés en comparación con la RTUp. En cuanto a la tasa de eyaculación retrógrada y disfunción eréctil, HoLEP produce una tasa similar a la RTUp.
En pacientes anticoagulados o con medicamentos antiplaquetarios, no se han encontrado diferencias en la tasa de transfusión o complicaciones, aunque puede haber una mayor estancia hospitalaria debido a la duración prolongada de la irrigación vesical postoperatoria y un mayor riesgo de retención urinaria.
Una desventaja importante de la técnica HoLEP es la curva de aprendizaje, que puede requerir entre 14 y 60 casos para dominarla. La experiencia del cirujano es el factor más importante que afecta la tasa de complicaciones. Sin embargo, en manos entrenadas, el tamaño prostático no tiene un efecto significativo en la tasa de complicaciones.
El láser Thulium, por otro lado, tiene una longitud de onda de 2000 nm y, aunque tiene características de absorción similares en agua y tejidos que el Holmium, presenta mejores propiedades en tejido blando debido a que se trata de una onda continua. La profundidad de penetración es de 250 micras, lo que proporciona una mejor disección y coagulación que HoLEP. Sin embargo, a diferencia de la onda pulsada de HoLEP, no se puede utilizar en litotricia.
La evidencia científica afirma que:
- HoLEP demuestra una eficacia a medio y largo plazo similar a RTUp (1b).
- HoLEP demuestra un perfil de seguridad similar a RTUp a corto plazo (1a).
- HoLEP demuestra un mayor tiempo quirúrgico que RTUp pero con un mejor perfil perioperatorio (1a).
- ThuLEP demuestra una eficacia similar comparada con RTUp y HoLEP, en corto, medio y largo plazo. (1b)
- ThuLEP demuestra un perfil de seguridad similar a RTUp bipolar y HoLEP en corto y medio plazo.
- ThuLEP. (1b).
- ThuLEP parece ser seguro en pacientes con tratamiento anticoagulante o antiplaquetario (2b).
- ThuLEP muestra una eficacia y seguridad similar a HoLEP pero no está apoyado aún por RCTs.
Las guías de la Asociación americana de Urología establecen que la enucleación con láser (holmium o thulium) es el único tratamiento mínimamente invasivo de la HBP que es independiente del tamaño prostático.
Para el anestesista, hay varias ventajas notables en el uso de la técnica HoLEP. En primer lugar, se reduce la cantidad de líquido de irrigación utilizado, se disminuyen las presiones vesicales, y se mejora de la hemostasia traduciéndose en una menor absorción de líquido. Además, es irrelevante si el líquido conduce o no la corriente eléctrica, por lo que se puede utilizar suero salino como líquido de irrigación. En general, estas características hacen que la técnica HoLEP sea más segura y eficaz para los pacientes, especialmente aquellos con mayor riesgo de complicaciones osmóticas asociadas con la absorción de líquido.
Aquablation
Requiere anestesia general y utiliza una sonda transrectal y una pieza robótica transuretral para resecar la próstata. El procedimiento se guía mediante un mapa y utiliza un jet de agua a alta velocidad. Después del tratamiento, se realiza la hemostasia con un balón, diatermia o láser. Este método se utiliza en próstatas de 30-80 gramos y es similar en eficacia y seguridad a RTUp.
Sin embargo, aún existen algunas dudas en cuanto a determinar el mejor método de hemostasia después del tratamiento. Además, se necesita realizar más estudios para validar y comparar adecuadamente esta técnica con otras opciones disponibles. En términos de resultados, la hidroablación robótica de la próstata presenta mejores resultados en términos de la preservación de la eyaculación en comparación con otras técnicas.
TUMT – Transurethral microwave thermotherapy – Termoterapia transuretral con microondas
Esta técnica utiliza una sonda transuretral que produce necrosis coagulativa del tejido prostático. Presenta peores resultados que la RTUp con mayor tasa de reintervenciones.
Debido a esto, actualmente se encuentra en desuso a favor de otras MISTs.
TUNA – Transurethral needle ablation – Ablación transuretral con aguja
Presenta peores resultados que la RTUp, con una tasa de reintervención del 13% en 5 años. Actualmente no se recomienda en las guías de práctica clínica debido a la falta de suficiente evidencia científica que respalde su eficacia y seguridad.
Embolización arterial prostática
Es un procedimiento que se realiza mediante radiología intervencionista bajo sedación y anestesia local. Aunque presenta algunas desventajas como su duración, que suele ser mayor que la de la RTUp (122.2 min vs. 69.5 min), y el uso de radiación (50.8 min), se ha demostrado que puede ser beneficioso para pacientes con próstatas de mayor tamaño. Sin embargo, aún se necesitan más estudios para determinar su eficacia y compararla con otros tratamientos. En general, se considera que la embolización arterial prostática es menos efectiva que la RTUp en la mejora de los síntomas y los parámetros urodinámicos, aunque presenta ventajas en términos de pérdida sanguínea, tiempo de cateterización y hospitalización.
Síndrome post-RTU de próstata (15) (16) (17) (18)
En 1947, Creevy y Webb describieron un fenómeno en el que el agua destilada, al ser absorbida a través de los senos venosos abiertos durante la RTU, provocaba un proceso hemolítico que resultaba en fracaso renal. La incidencia de este fenómeno es del 1-7% en las RTUs, y del 10% cuando se incluyen formas leves. Muchos procedimientos transuretrales, histeroscópicos o percutáneos usan grandes cantidades de líquido de irrigación o distensión para mantener el campo quirúrgico libre de sangre y producir distensión del órgano. La absorción del líquido es multifactorial y conduce a alteraciones cardiovasculares, del SNC y metabólicas. Debido a los senos venosos presentes en el tejido prostático, es inevitable la absorción de líquido. La absorción intravascular comienza cuando la presión supera la presión venosa (10 mm Hg). En órganos huecos, depende del órgano, siendo intrauterino a 70 mm Hg y en vejiga con 15-25 mm Hg. La velocidad de absorción suele ser de 10-30 ml/min, aunque se han medido velocidades máximas de 120 ml/min con una media de 46 ml/min. Usualmente, las complicaciones aparecen cuando se produce la absorción de más de 1000 ml con síntomas graves con más de 2500 ml.
En cuanto a la monitorización, existen varios métodos para detectar la absorción de líquido de irrigación (LI) durante la RTUp:
- Uno de los métodos directos es medir la diferencia entre el volumen de LI infundido y el aspirado. Sin embargo, este método no es muy preciso debido al sobrellenado de las bolsas de LI (3-6%) y a la interferencia del sangrado y la orina durante la RTU. Por esta razón, se recomienda el uso de una bomba automática de LI con monitorización, según el Colegio Americano de Ginecología y Obstetricia y la Asociación Americana de Ginecología Laparoscópica.
- Otro método es añadir etanol al 1% al LI. Este método demuestra que la absorción se produce en más del 50% de los pacientes y constituye un problema en un 12% de los casos. El uso de etanol para la monitorización intraoperatoria de la absorción se inició en la década de los 80 por Hahn et al. Sin embargo, no se usa de forma rutinaria debido a que los LI con etanol no son muy atractivos para la industria farmacéutica al no existir ninguna patente. Otra razón podría ser el orgullo de los cirujanos.
La absorción de LI va a producir hipervolemia, hipoosmolaridad y toxicidad derivada de la composición del mismo.
Líquidos de irrigación
El líquido de irrigación ideal sería aquel que fuese isotónico, no conductor (eléctricamente inerte), no tóxico, transparente, no hemolítico, apirógeno, no alergénico, fácil de esterilizar, barato, no contaminante. Desgraciadamente no existe y cada líquido de irrigación, por su composición, dará lugar a una clínica diferente tras su absorción.
- Agua destilada: es eléctricamente inerte, barata y tiene buenas propiedades ópticas. Ha sido utilizada durante años por su excelente visibilidad. Sin embargo, produce hiponatremia dilucional con hemólisis, shock y fracaso renal. Debido a esto ha sido abandonada en favor de soluciones isoosmóticas o casi isoosmóticas.
- Glucosa 5.4%: se ha dejado de utilizar debido a que deja el instrumental quirúrgico pegajoso y puede aumentar los niveles de glucosa en pacientes diabéticos.
- Urea 1.8%: ya no se usa debido a sus efectos secundarios indeseables. El aumento de urea en plasma produce náuseas, vómitos, cefalea, taquicardia, hipertensión, alteraciones visuales, convulsiones y coma. Además produce diuresis osmótica y deshidratación.
- Glicina 1.5%: fue introducida en 1948 como LI y presenta ventajas como buena visibilidad con poca pegajosidad, bajo coste y ausencia de riesgo de alergia.
- La extrapolación de estudios en perros al metabolismo humano estima una dosis letal de glicina para 70 kg de 2.5-5.5 litros de glicina 1.5%. La glicina 1.5% contiene 1000 veces la concentración de glicina normal en el plasma. Es un líquido hipoosmótico (200 mosmol/kg), no conductor y no hemolítico.
- La glicina es un neurotransmisor inhibidor del SNC, especialmente de la médula espinal, tronco del encéfalo y retina. Además, tiene efectos tóxicos en corazón y riñones.
- Se metaboliza a amonio en el hígado. La hiperamonemia puede producir trastornos neurológicos como temblores y convulsiones.
- Produce secreción inapropiada de vasopresina, que empeora la hiponatremia al producir retención hídrica, y edema miocárdico que se acompaña de bradicardia y prolongación del QRS.
- Además, potencia la actividad del receptor NMDA, favoreciendo la actividad excitatoria cerebral, por lo que el tratamiento con magnesio puede ser eficaz en pacientes con temblores o convulsiones asociados a la absorción de glicina. Por último, la glicina también produce hiperoxaluria por el metabolismo del oxalato y glicolato, y puede causar fallo renal.
- Sorbitol 3.3%: es una solución hipoosmótica (165 mosmol/kg). Puede causar hiperglucemia y acidosis láctica, así como intoxicación acuosa. El sorbitol se metaboliza en el hígado a glucosa y fructosa, y posteriormente a CO2 y agua. Alrededor del 5-10% se excreta sin cambios en la orina.
- Manitol 3-5%: es una solución casi isoosmótica (275 mosmol/kg) que no penetra en las células ni se metaboliza, siendo completamente eliminado en la orina. Su uso puede provocar hiperosmolaridad y deshidratación.
- La excreción urinaria de manitol y en menor medida de glicina y sorbitol, produce diuresis osmótica. La pérdida de agua libre asociada puede aumentar los niveles de sodio en plasma, y la excreción de sodio puede corregir la sobrecarga de volumen.
- Cital: combinación de 2.7% sorbitol y 0.54% manitol. Es un líquido no electrolítico, hipoosmolar y caro. El sorbitol se metaboliza a fructosa, que puede inducir coma en pacientes con enfermedad hepática.
Clínica del síndrome post-RTU (19)
- Hipervolemia y coagulopatía por hemodilución. La expansión de volumen produce hipertensión y bradicardia refleja. Los pacientes con pobre función cardiaca pueden desarrollar edema pulmonar.
- Sintomatología neurológica secundaria a la hipo-osmolaridad más que a la hiponatremia, permitiendo el paso de agua hacia las células y produciendo edema cerebral. Una hiponatremia severa, asociada a la absorción de 2000-3000 ml, puede asociar confusión, desorientación, espasmos, convulsiones, hipotensión y trastornos visuales transitorios como disminución de la agudeza visual y visión borrosa.
- Disfunción cardiaca secundaria a hiponatremia: arritmias, hipotensión, edema pulmonar.
- Hipotermia, que enlentece el metabolismo y prolonga los efectos de los agentes anestésicos además de alterar la coagulación.
- El síntoma más precoz de hiponatremia asociado a la absorción de glicina son las náuseas que ocurren frecuentemente cuando la concentración de sodio baja 10 mEq/L. Típicamente requiere la absorción de al menos 1000 ml en mujeres y un volumen mayor en hombres.
En resumen, en fases iniciales aparecen náuseas y vómitos. Posteriormente letargia, bradicardia, hipertensión, desorientación, alteraciones visuales, cefalea, temblores, distensión abdominal, picores, confusión, hipotensión, convulsiones, disnea, cianosis, isquemia cardiaca y renal, y coma. La hiponatremia junto a la hipertensión originan un flujo de agua fuera del espacio intravascular hacia los pulmones produciendo edema pulmonar y shock hipovolémico.
Factores de riesgo del síndrome post-RTU
- Volumen de LI absorbido. 1000 ml de glicina en mujeres en histeroscopia se asocia con una disminución del sodio de 10 mEq/L, mientras que 3000 ml reducen 30 mEq/L. Los hombres sometidos a RTUp muestran reducciones menores de 6-8 mEq/L tras absorber 1000 ml y de 20 mEq/L tras 3000 ml. Probablemente debido a la mayor masa corporal y agua corporal total en hombres.
- Tipo de procedimiento.
- Introducción del LI a alta presión.
- Perforación visceral: perforación de la vejiga o útero produce extravasación de líquido a la cavidad peritoneal o retroperitoneal. La perforación de la cápsula prostática produce extravasación de líquido al espacio periprostático. La caída del sodio ocurre de forma más lenta cuando se produce extravasación que intravasación. Puede durar hasta 2-4 horas tras la cirugía y el grado de hiponatremia es aproximadamente un tercio del esperado cuando la absorción es intravascular.
- Tiempo quirúrgico: la absorción es mayor durante la segunda parte del procedimiento.
- Tipo de anestesia.
Tratamiento del síndrome post-RTU (20)
En primer lugar es necesario medir el sodio en plasma y la osmolalidad. La diferencia entre la osmolalidad medida y calculada (GAP osmolar) refleja la concentración de LI absorbido. El GAP osmolar (que normalmente es menor de 5-10 mosmol/kg) puede exceder los 30-60 mosmol/kg, debido a la acumulación transitoria de glicina, sorbitol o manitol.
Podemos clasificar a los pacientes en dos grandes grupos.
- Pacientes con hiponatremia asintomática: no es necesario el tratamiento. Si la función renal es adecuada, la excreción del exceso de agua y el metabolismo y excreción del LI corregirá rápidamente la hiponatremia. Si el paciente desarrolla congestión pulmonar, se puede administrar un diurético del asa.
- Pacientes con hiponatremia sintomática: el tratamiento óptimo varía en función de la concentración de sodio, la osmolalidad y el estado de la volemia.
- Pacientes con marcada hiponatremia y osmolaridad baja: el suero salino hipertónico disminuye el edema cerebral además de reemplazar la pérdida de sodio producida por la diuresis osmótica (causada por la glicina, el manitol o el sorbitol) que prolonga el periodo de hiponatremia, y que contribuye a la hipovolemia e hipotensión que se desarrolla 15-20 min tras finalizar la absorción del LI. Se administran 100 ml de SS 3% en bolo, que proporciona 51 mEq de sodio y aumentará la concentración de sodio de forma rápida en 2-3 mEq/L. Si los síntomas neurológicos no mejoran, se pueden administrar 1 o 2 bolos más en intervalos de 10 min. La corrección rápida es segura debido a que la extremadamente corta duración de la hiponatremia no da tiempo a desarrollar las adaptaciones cerebrales ante la hiponatremia crónica y el riesgo de desarrollar una desmielinización osmótica. Sin embargo, se recomienda no corregir más de 12 mEq/l en las primeras 24 horas.
- Pacientes con hiponatremia y osmolaridad normal o casi normal: no está establecido un tratamiento óptimo. Probablemente la hemodiálisis sea el tratamiento más seguro. Esta corrige rápidamente la hiponatremia, las alteraciones osmóticas, la expansión de volumen y elimina el LI y sus metabolitos. Se ha utilizado en pacientes sintomáticos con fracaso renal y en pacientes sintomáticos con hiponatremia y osmolalidad normal o casi normal.
Los diuréticos de asa no se deben administrar en pacientes sin sobrecarga de líquidos pues pueden contribuir a la reducción del volumen intravascular y pueden contribuir al desarrollo de hiponatremia.
Anestesia para cirugía de próstata
Merece la pena recordar que los niveles sensitivos de la vejiga y la próstata se corresponden con T11-L2, mientras que el pene y la uretra con L1-L2. Sin embargo, para evitar el disconfort de la distensión vesical se recomienda un nivel T9-T10 de bloqueo.
La anestesia intradural es ampliamente aceptada como la técnica anestésica de elección para RTUp por ser efectiva y eficiente. Sin embargo, la principal motivación clásica es la posibilidad de valoración de los cambios en el estado neurológico secundarios a la absorción de líquido de irrigación: síndrome post-RTUp. En los últimos años, con la introducción reciente de la tecnología láser para la resección endoscópica del tejido prostático el riesgo de síndrome post-RTU está siendo casi eliminado aportando al anestesista más opciones en el tipo de anestesia a administrar pudiendo emplear con mayor frecuencia la anestesia general.
Sin embargo cabe recordar otras ventajas de la anestesia regional respecto a la general:
- Menor incidencia de TVP.
- Menor pérdida sanguínea.
- Permite la evaluación intraoperatoria del estado neurológico del paciente.
- Permite la valoración de signos y síntomas de perforación vesical: bradicardia, hipotensión, inquietud, diaforesis, náuseas, dolor abdominal, disnea, dolor en el hombro, hipo.
- Permite la valoración de signos y síntomas de perforación extraperitoneal: dolor periumbilical, inguinal o suprapúbico. Intraperitoneal, menos frecuente, irritación diafragmática (dolor en abdomen superior, precordial, hombro o cuello).
- El bloqueo simpático producido por la anestesia regional aumenta la capacitancia del lecho venoso, disminuyendo el efecto del exceso de absorción de líquido de irrigación.
- Menor requerimiento de analgesia en el postoperatorio.
Dados los últimos avances en cirugía transuretral de próstata, la utilización de suero salino como líquido de irrigación es cada vez más frecuente ya sea en la RTU bipolar de próstata o en las nuevas técnicas con láser.
De esta forma, el síndrome post-RTU clásico ha perdido interés al utilizar con mayor frecuencia el suero salino como líquido de irrigación. Éste elimina el riesgo de hemólisis, hiponatremia e intoxicación por glicina. Sin embargo, se traduce en una mayor expansión del volumen plasmático debido a su distribución extracelular y la falta de diuresis osmótica.
Todo esto conduce a un nuevo síndrome post-RTU por absorción de suero salino que se caracteriza por el desarrollo de descompensación cardiaca y edema pulmonar, así como aumento de la concentración de cloro en plasma ya que el suero salino contiene una cantidad significativamente mayor de cloro (154 mmol/l) que la del plasma (100 mmmol/L). También puede aparecer acidosis hiperclorémica, que si no se compensa, produce estimulación del SNS y disminuye el filtrado glomerular en un 10-15% al inducir vasoconstricción renal. Además, se puede producir dolor abdominal y mareo.
La sintomatología de la absorción de líquido isoosmolar varía en función de la cantidad y velocidad de absorción. Por ejemplo, una infusión rápida de 1250 ml en 15 min puede ocasionar hinchazón en manos, distensión abdominal, disnea y cefalea. A medida que aumenta la absorción, pueden aparecer síntomas más graves, como insuficiencia cardiaca, edema pulmonar e incluso parada cardiaca.
Conclusión
La HBP es una enfermedad con una elevada prevalencia en varones y existen nuevas técnicas quirúrgicas desarrolladas en los últimos años que modifican el manejo anestésico de estos pacientes.
La utilización de suero salino, tanto en la RTU bipolar de próstata como en las técnicas con láser, disminuye el riesgo de síndrome post-RTU clásico sustituyéndolo por un nuevo síndrome post-RTU caracterizado por sobrecarga de volumen y acidosis hiperclorémica.
Bibliografía
- Vuichoud C, Loughlin KR. Benign prostatic hyperplasia: epidemiology, economics and evaluation. Can J Urol. 2015 Oct;22 Suppl 1:1-6. PMID: 26497338.
- Van Asseldonk B, Barkin J, Elterman DS. Medical therapy for benign prostatic hyperplasia: a review. Can J Urol. 2015 Oct;22 Suppl 1:7-17. PMID: 26497339.
- Cornu JN, Gacci M, Hashim H, Herrmann TRW, Malde S, Netsch C, et al. EAU Guidelines on Non-Neurogenic Male Lower Urinary Tract Symptoms (LUTS), incl. Benign Prostatic Obstruction (BPO). Edn. presented at the EAU Annual Congress Milan March 2023. ISBN 978-94-92671-19-6.
- McVary KT, O´Leary MP, Givens J. Medical treatment of benign prostatic hyperplasia. UpToDate. Sep 2021.
- Keehn A, Lowe FC. Complementary and alternative medications for benign prostatic hyperplasia. Can J Urol. 2015 Oct;22 Suppl 1:18-23. PMID: 26497340.
- Dornbier R, Pahouja G, Branch J, McVary KT. The New American Urological Association Benign Prostatic Hyperplasia Clinical Guidelines: 2019 Update. Curr Urol Rep. 2020 Jul 1;21(9):32. doi: 10.1007/s11934-020-00985-0. PMID: 32607874.
- McVary K, O´Leary MP, Chen W. Surgical treatment of benign prostatic hyperplasia (BPH). UpToDate. Oct 2021.
- Mamoulakis C, de la Rosette JJMCH. Bipolar transurethral resection of the prostate: Darwinian evolution of an instrumental technique. Urology. 2015 May;85(5):1143-1150. doi: 10.1016/j.urology.2015.01.003. Epub 2015 Feb 19. PMID: 25704995.
- Tang Y, Li J, Pu C, Bai Y, Yuan H, Wei Q, et al. Bipolar transurethral resection versus monopolar transurethral resection for benign prostatic hypertrophy: a systematic review and meta-analysis. J Endourol. 2014 Sep;28(9):1107-14. doi: 10.1089/end.2014.0188. Epub 2014 Jun 5. PMID: 24754254; PMCID: PMC4146489.
- Yu C, Argáez C. Bipolar versus Monopolar Transurethral Resection of the Prostate or GreenLight Laser Treatment: A Review of Clinical and Cost-Effectiveness [Internet]. Ottawa (ON): Canadian Agency for Drugs and Technologies in Health; 2017 Mar 1. Available from: https://www.ncbi.nlm.nih.gov/books/NBK470027/
- Das AK, Teplitsky S, Humphreys MR. Holmium laser enucleation of the prostate (HoLEP): a review and update. Can J Urol. 2019 Aug;26(4 Suppl 1):13-19. PMID: 31481144.
- Lerner LB, Rajender A. Laser prostate enucleation techniques. Can J Urol. 2015 Oct;22 Suppl 1:53-9. PMID: 26497344.
- Hanson RA, Zornow MH, Conlin MJ, Brambrink AM. Laser resection of the prostate: implications for anesthesia. Anesth Analg. 2007 Aug;105(2):475-9. doi: 10.1213/01.ane.0000270217.82825.1f. PMID: 17646508.
- Herrmann TR, Liatsikos EN, Nagele U, Traxer O, Merseburger AS. Guidelines on Lasers and Technologies. 2015. Available from: https://uroweb.org/eau-guidelines/discontinued-topics/lasers-and-technology
- Ortner G, Nagele U, Herrmann TRW, Tokas T. Irrigation fluid absorption during transurethral bipolar and laser prostate surgery: a systematic review. World J Urol. 2022 Mar;40(3):697-708. doi: 10.1007/s00345-021-03769-4. Epub 2021 Jun 30. PMID: 34191108.
- Clemente Ramos LM, Ramasco Rueda F, Platas Sancho A, Archilla Esteban J, Romero Cajigal I, Corbacho Fabregat C, et al. Síndrome de reabsorción post-resección transuretral (R.T.U.) de próstata: revisión de aspectos fisiopatológicos, diagnósticos y terapéuticos. Actas Urol Esp. 25 (1): 14-31, 2001.
- Hahn RG. The use of ethanol to monitor fluid absorption during transurethral resection of the prostate. Scand J Urol Nephrol. 1999 Oct;33(5):277-83. doi: 10.1080/003655999750017293. PMID: 10572987.
- Gravenstein D. Transurethral resection of the prostate (TURP) syndrome: a review of the pathophysiology and management. Anesth Analg. 1997 Feb;84(2):438-46. doi: 10.1097/00000539-199702000-00037. PMID: 9024044.
- Sterns RH, Emmett M, Forman JP. Diagnostic evaluation of adults with hyponatremia. UpToDate. Jun 2022.
- Emmett M, Istre O, Hahn RG, Sterns RH, Falcone T, Forman JP. Hyponatremia following transurethral resection, hysteroscopy, or other procedures involving electrolyte-free irrigation. UpToDate. Nov 2022.