Artículo original: Rüffert H, Bastian B, Bendixen D, Girard T, Heiderich S, Hellblom A, Hopkins PM, Johannsen S, Snoeck MM, Urwyler A, Glahn KPE; European Malignant Hyperthermia Group. Consensus guidelines on perioperative management of malignant hyperthermia suspected or susceptible patients from the European Malignant Hyperthermia Group. Br J Anaesth. 2021 Jan;126(1):120-130. (PubMed) (PDF)
López Herrero R (1), Velasco Villanueva D (2), Sánchez Quirós B (1)
(1) MIR Anestesiología y Reanimación. Hospital Clínico Universitario de Valladolid
(2) Adjunto Anestesiología y Reanimación. Hospital Clínico Universitario de Valladolid
Cómo citar este artículo: López Herrero, R., Velasco Villanueva, D., & Sánchez Quirós, B. (2023). Guías sobre el manejo perioperatorio de pacientes sospechosos o susceptibles de padecer Hipertermia Maligna del Grupo Europeo de Hipertermia Maligna . Revista Electrónica AnestesiaR, 15(3). https://doi.org/10.30445/rear.v15i3.1107
Introducción
La HM es una emergencia anestésica rara. Se estima que ocurre entre 1:10000 y 1: 150000 anestesias generales (1) pero estas estimaciones están sujetas a error por una variedad de razones (informes incompletos de sospechas a reacciones, falta de confirmación del diagnóstico, uso de base de datos para identificar casos). Se ha podido comprobar que el número de casos ha disminuido ligeramente por la reducción del uso de succinilcolina. La incidencia es mayor en poblaciones pediátricas y en varones en comparación con mujeres (2). Se desconocen las razones de la distribución por edad y sexo de las reacciones de HM. Presenta una mortalidad en torno al 4% (2), previa a la aparición del dantroleno la mortalidad era del 80% (3).
Los agentes desencadenantes incluyen los anestésicos inhalatorios (Sevoflurano, desflurano, halotano, isoflurano, metoxiflurano) y la succinilcolina (4) Existen pacientes que presentan un riesgo elevado a padecer un cuadro de HM si se exponen a agentes desencadenantes (tabla 1). Los pacientes susceptibles que se vayan a someter a una anestesia general precisan de unos cuidados especiales, una serie de precauciones y preparaciones perioperatorias para minimizar la probabilidad de desencadenar un cuadro de HM (5).

Resumen de las Guías
Objetivos
Realizamos una revisión de la guía clínica para el manejo perioperatorio de pacientes sospechosos o susceptibles de padecer HM publicada en British Journal of Anaesthesia en enero de 2021.
Material y métodos
Esta guía fue desarrollada por el grupo de trabajo europeo de la HM. Los expertos formularon directrices de acuerdo con la metodología GRADE (Grading of Recommendations, Assessment, Development and Evaluation). La clasificación GRADE se basa en la fuerza de recomendación: grado 1 (recomendación fuerte) y grado 2 (recomendación débil) y en la calidad de evidencia científica: a (alta), b (moderada) y c (baja).
Resultados
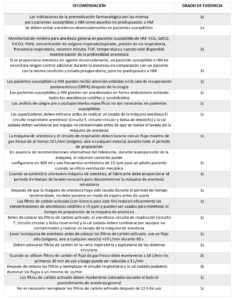
Un resumen de las recomendaciones traducidas en esta guía se presenta en la tabla 2.
Comentario
En esta guía se abordan todas las estrategias que deben tomarse en pacientes susceptibles a padecer HM que van a someterse a una anestesia.
Evaluación preoperatoria
Por razones de seguridad, siempre es recomendable realizar un diagnóstico de HM en personas con riesgo aumentado de padecer dicho cuadro (6). Sin embargo, la anestesia no debe rechazarse ni posponerse, independientemente de las pruebas diagnósticas definitivas de HM, si esto pusiera en riesgo la progresión de la patología quirúrgica. Si el riesgo aumentado de desarrollar HM no se puede excluir, entonces debe ser tratado como susceptible de padecer el cuadro. La evaluación anestésica debe incluir preguntas sobre antecedentes de rabdomiólisis, que es más común en predispuestos a HM que en la población general (7).
No hay evidencia de que el estrés psicológico pueda desencadenar síntomas asociados con HM. No es necesario administrar terapia ansiolítica previa a la intervención. El uso preoperatorio de dantroleno profiláctico por vía oral o intravenosa es innecesario y este asociado con aumento de los efectos secundarios del fármaco (8).
Elección de fármacos anestésicos
La anestesia regional o la local es una buena opción. La anestesia general será adecuada si se evitan los anestésicos volátiles y la succinilcolina (4).
Monitorización intraoperatoria
Si se proporciona anestesia sin agentes desencadenantes el paciente no necesitará ninguna monitorización adicional durante la anestesia en comparación con otro con la misma condición y preoperatorio, pero no predispuesto a HM. Se recomienda la monitorización de electrocardiograma, oximetría de pulso, presión arterial, temperatura corporal central y capnografía (9).
Atención postoperatoria
Aquellas personas predispuestas a padecer HM pueden recibir atención estándar en la unidad de recuperación postanestésica (URPA) después de la cirugía. No existe evidencia del manejo postoperatorio de estospacientes en unidades de cuidados intensivos. Además, las concentraciones de agentes volátiles en la URPA son demasiado bajas para desencadenar un evento de HM (10).
Cirugía ambulatoria
Los pacientes susceptibles pueden ser anestesiados de forma ambulatoria evitando todos los anestésicos volátiles y la succinilcolina (11).
Muestras de sangre
Los análisis de sangre pre o postoperatorios específicos no son necesarios. Sin embargo, la medición preoperatoria de creatinquinasa (CK), potasio y mioglobina pueden realizarse si existe antecedentes de elevación de CK en reposo, síntomas musculares (calambres y mialgias) o rabdomiólisis.
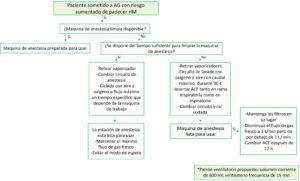
Preparación de la máquina de anestesia (Tabla 3)
La concentración de vapor más baja de anestésico volátil que puede inducir HM en humanos es desconocido por razones éticas. Aunque la concentración máxima segura de 5 ppm se definió arbitrariamente, este umbral es generalmente aceptado. No existe un protocolo universal que cubra todas las máquinas de anestesia. Actualmente existe una práctica estándar para la preparación de la máquina de anestesia. Existen dos formas tradicionales de obtener una máquina de anestesia libre de anestésicos volátiles:
-Uso de un aparato de anestesia limpio, que nunca haya estado expuesta a anestésicos volátiles. Rara vez es una opción debido a los requisitos de costes y almacenamiento.
-Limpiar la máquina de acuerdo con el fabricante o las recomendaciones de expertos. El tiempo necesario para lavar la estación de trabajo difiere de un modelo a otro (12). Las estaciones modernas parecen requerir un tiempo más prolongado para eliminar los agentes volátiles en comparación con las generaciones anteriores (13). Generalmente el fabricante proporciona información específica sobre cómo realizar la descontaminación.
Los vaporizadores deben retirarse antes de que se realice el lavado, ya que la mayoría son un depósito importante de anestésicos volátiles y de este modo también se evita su uso accidental.
El circuito respiratorio anestésico y la cal sodada deben cambiarse por otros no contaminados antes de realizar el lavado. La máquina de anestesia y el circuito deben lavarse con un flujo máximo de gas fresco de al menos 10 L/min con oxígeno, aire o cualquier mezcla, durante todo el periodo de preparación. Cada aparato de anestesia requiere una cantidad especifica de tiempo para eliminar agentes anestésicos volátiles por lavado con gas fresco que difiere ampliamente entre las máquinas de anestesia. Después de que haya sido enjuagada por el periodo de tiempo recomendado debe continuarse con el lavado y no debe configurarse el modo de espera antes de su uso (14).
En ausencia de recomendaciones específicas del fabricante (tabla 4), durante su preparación, el volumen corriente se puede establecer en 600 ml y la frecuencia respiratoria en 15 rpm para un paciente adulto (15).
Utilización de filtros de carbón activado para preparación de la máquina de anestesia
Los filtros de carbón activado no limpian la estación de trabajo de manera completa, pero absorben anestésico volátil residual en el circuito respiratorio. Los filtros disponibles en el mercado contienen 50 ml de carbón activado granular que disminuyen rápidamente, de forma segura y rentable la concentración de anestésico inhalatorio a menos de 5 ppm en menos de 2-3 minutos (16). Después de que el vaporizador se haya retirado, se realiza un lavado usando un flujo alto >10 L/min durante 90 segundos. Posteriormente se coloca un filtro en la rama inspiratoria y otro en la rama espiratoria y se reemplaza el circuito respiratorio y la cal sodada. La capacidad de un solo filtro colocado en la rama inspiratoria es suficiente para asegurar el límite de < 5 ppm. Sin embargo, por razones de seguridad los filtros deben colocarse en las ramas inspiratoria y espiratoria. Una vez que los filtros estén colocados se puede reducir el flujo de gas fresco (FGF) con un mínimo de 1L/min. Aunque el fabricante recomienda un FGF de 3 L/min, los nuevos datos muestran que un litro es suficiente para mantener las trazas de anestésicos volátiles a niveles seguros (17).
Los filtros deben mantenerse colocados durante todo el procedimiento anestésico. No hay publicaciones que evalúen la duración del filtro a largo plazo, pero hay indicios de que pueden garantizar la anestesia con concentraciones de volátiles por debajo de 5 ppm durante 12-24 horas (18). El fabricante recomienda cambiar los filtros cada 12 horas.
Para concluir consideramos que estas guías son necesarias ya que apenas se dispone de información acerca de las medidas que se deben de tomar en pacientes que pueden ser susceptibles a padecer un cuadro de HM.

Bibliografía
- Osenberg H, Davis M, James D, Pollock N, Stowell K. Malignanthyperthermia.Orphanet Journal of Rare Diseases. 2007;2: 21 (PubMed)
- Gupta PK, Hopkins PM. Diagnosis and management of malignant hyperthermia. British Journal of AnaesthesiaEducation. 2017;17: 249–54 (PDF)
- Britt BA, Kalow W. Malignant hyperthermia: a statistical review.Canadian Anaesthetists Society Journal. 1970;17: 293–315 (PubMed)
- Hopkins PM. Malignant hyperthermia: pharmacology of
triggering. Br J Anaesth 2011; 107: 48-56 (PubMed) - Wappler F. S1-leitlinie maligne hyperthermie: update 2018
[S1 guidelines on malignant hyperthermia: update 2018].
Anaesthesist 2018; 67: 529-32 (PubMed) - Hopkins PM, Rüffert H, Snoeck MM, et al. The European
Malignant Hyperthermia Group guidelines for the investigation of malignant hyperthermia susceptibility. Br J
Anaesth 2015; 115: 531-9 (PubMed) - Dlamini N, Voermans NC, Lillis S, et al. Mutations in RYR1
are a common cause of exertional myalgia and rhabdomyolysis. Neuromuscul Disord 2013; 23: 540-8 (PubMed) - Hackl W, Mauritz W, Winkler M, Sporn P,
Steinbereithner K. Anaesthesia in malignant
hyperthermia susceptible patients without dantrolene
prophylaxis: a report of 30 cases. Acta Anaesthesiol Scand
1990; 34: 534-7 (PubMed) - Litman RS, Smith VI, Larach MG, et al. Consensus state-
ment of the Malignant Hyperthermia Association of the
United States on unresolved clinical questions concerning
the management of patients with malignant hyperthermia. Anesth Analg 2019; 128: 652-9 (PubMed) - Heiderich S, Thoben C, Dennhardt N, et al. Low anaes-
thetic waste gas concentrations in postanaesthesia care
unit: a prospective observational study. Eur J Anaesthesiol
2018; 35: 534-8 (PubMed) - Litman RS, Joshi GP. Malignant hyperthermia in the
ambulatory surgery center: how should we prepare?
Anesthesiology 2014; 120: 1306-8 (PubMed) - Targ AG, Yasuda N, Eger EI. Solubility of I-653, sevo-
flurane, isoflurane, and halothane in plastics and rubber
composing a conventional anesthetic circuit. Anesth Analg
1989; 69: 218-25 (PubMed) - Kim TW, Nemergut ME. Preparation of modern anesthesia
workstations for malignant hyperthermia susceptible
patients: a review of past and present practice. Anesthe-
siology 2011; 114: 205-12 (PubMed) - Reber A, Schumacher P, Urwyler A. Effects of three
different types of management on the elimination ki-
netics of volatile anaesthetics. Implications for malignant
hyperthermia treatment. Anaesthesia 1993; 48: 862-5 (PubMed) - Petroz GC, Lerman J. Preparation of the Siemens KION
anesthetic machine for patients susceptible to malignant
hyperthermia. Anesthesiology 2002; 96: 941-6 (PubMed) - Dynasthetics. Prepare any anesthesia machine for sus-
ceptible patients in less than 90 seconds. Available from:
https://www.dynasthetics.com; Accessed 05 March 2022 - Sabouri AS, Lerman J, Heard C. Effects of fresh gas flow,
tidal volume, and charcoal filters on the washout of sevoflurane from the Datex Ohmeda (GE) Aisys, Aestiva/5,
and Excel 210 SE Anesthesia Workstations. Can J Anaesth
2014; 61: 935-42 (PubMed) - Bilmen JG, Gillies RI. Clarifying the role of activated charcoal filters in preparing an anaesthetic workstation
for malignant hyperthermia susceptible patients. Anaesth
Intensive Care 2014; 42: 51-8 (PubMed)