López Herrero R (1), Sánchez Quirós B (1), Velasco Villanueva D (2)
(1) MIR Anestesia y Reanimación. Hospital Clínico Universitario de Valladolid.
(2) Adjunto Anestesia y Reanimación. Hospital Clínico Universitario de Valladolid.
Cómo citar este artículo: López Herrero, R., Sánchez Quirós, B., & Velasco Villanueva, D. (2021). Electroencefalografía clínica para el anestesiólogo. Revista Electrónica AnestesiaR, 13(2). https://doi.org/10.30445/rear.v13i2.896
Introducción
La monitorización electroencefalográfica intraoperatoria es una práctica habitual en anestesiología para estimar la profundidad anestésica en el paciente adulto. Prys-Robert define ésta como el resultado de un equilibrio, en el sistema nervioso central (SNC), entre el efecto depresor de los fármacos anestésicos y el de los estímulos nociceptivos. Éstos contrarrestan la acción de los anestésicos y tienden a superficializarla.
En un primer momento, la principal indicación del electroencefalograma (EEG) era la detección precoz de lesiones isquémicas en el córtex cerebral (1). Posteriormente y secundario a la descripción del despertar intraoperatorio surgió un nuevo uso, la monitorización de la profundidad anestésica (componente hipnótico) (2). Existen diferentes monitores para medir la hipnosis como BIS®, Entropy®, SedLine® y otros. No existe ninguna superioridad entre ellos. En este artículo nos centraremos fundamentalmente en el uso del SedLine®.
El sistema de monitorización SedLine® es un método no invasivo que se fundamenta en un examen del registro electroencefalográfico obtenido por un sensor que se coloca en la región frontal del cuero cabelludo. Este sensor es una tira adhesiva fronto-temporal bilateral que consta de seis electrodos (un frontal superior, tres frontales inferiores, un temporal derecho y un temporal izquierdo) dispuestos de acuerdo con el sistema internacional 10–20 de colocación de electrodos del EEG, que en el caso del Sedline®-Masimo se ubican aproximadamente en las posiciones Fp1, Fp2, F7 y F8, con el electrodo de tierra en Fpz y el electrodo de referencia aproximadamente 1 cm por encima de Fpz. El monitor procesa (algoritmo específico) la señal bioeléctrica fronto-temporal cerebral y refleja mediante un número (índice), el grado de inconsciencia. El valor numérico se denomina PSI (Patient State Index) que va de 0 (EEG isoeléctrico) a 100 (nivel pleno de consciencia). Tendremos una hipnosis adecuada para la anestesia general si presenta valores entre 25 y 50 (imagen 1). En muchas ocasiones el número que refleja no corresponde con el contexto clínico del paciente (3). Por este motivo, consideramos que es necesario conocer unos aspectos básicos sobre electroencefalografía intraoperatoria.
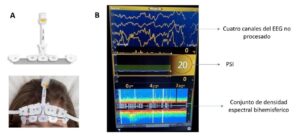
Análisis electroencefalográfico
El EEG es el registro de la actividad bioeléctrica (postsináptica) de las neuronas que componen la capa de células piramidales del córtex cerebral (EEG analógico). Esta actividad bioeléctrica se produce por el intercambio de iones entre el citoplasma y el medio extracelular de las neuronas (4). El voltaje que se produce atraviesa las diferentes estructuras hasta llegar a los electrodos colocados en la región fronto-temporal del cuero cabelludo del paciente, que captan, filtran, amplifican y analizan posteriormente la señal (EEG digital). Este procesamiento de la señal requiere complejos cálculos (algoritmo) que son realizados por un sistema informático. El algoritmo es monitor-especifico.
La impedancia es la resistencia que presentan los electrodos al paso de la corriente, que debe encontrarse entre 300 y 5.000 Ω. Los electrodos deben alcanzar esta impedancia, de lo contrario se corre el riesgo de detectar artefactos como señales electroencefalográficas, por este motivo se recomienda limpiar la piel con alcohol para eliminar cualquier sustancia que pueda interferir con la medición. Hay que comprobar la impedancia después de colocar el sensor para examinar el buen contacto de los electrodos con la piel; si es alta se limpia la piel de contacto (uso de un peeling-gel), presión digital sobre los electrodos o se coloca una cinta adhesiva por encima del sensor(5).
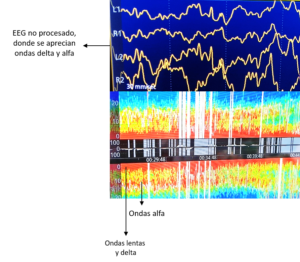
En el monitor aparece un registro EEG no procesado (EEG raw), es decir, se superponen en el mismo trazado diferentes ondas (predominantes y no predominantes) (imagen 2).
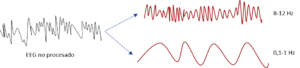
Cada una de estas ondas se compone de una frecuencia y una amplitud. La frecuencia es el número de ondas por segundo y se mide en hercios (Hz) o ciclos/segundo, y la amplitud es la altura que alcanza la onda desde la línea basal y se mide en microvoltios. Además, las ondas se agrupan según la frecuencia que presenten en (imagen 3):
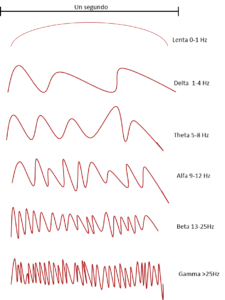
- Ondas gamma (ϒ): frecuencias de 26-80 Hz.
- Ondas beta (β): frecuencias de 13-25 Hz, aparecen en individuos conscientes con ojos abiertos.
- Ondas alfa (α): frecuencias de 9-12 Hz, aparecen en individuos conscientes con ojos cerrados.
- Ondas theta (θ): frecuencias de 5-8 Hz, aparece en individuos somnolientos, con leve depresión bioeléctrica cortical.
- Ondas delta (δ): frecuencias de 1-4 Hz, aparecen en el sueño profundo, neuroisquemia, hipotermia profunda y plano profundo de anestesia.
- Ondas lentas (slow): < 1 Hz
El análisis de las frecuencias y amplitudes del EEG no procesado en quirófano en tiempo real (EEG analógico) es un desafío, por este motivo se buscaron soluciones siendo la más práctica e informativa la realización de un análisis espectral, calculando el espectro; que se representa gráficamente mediante el espectrograma-EEG.
Para un segmento dado de datos del EEG, el espectro proporciona una descomposición del segmento en sus componentes de frecuencia, generalmente calculados por los métodos de análisis de Fourier (6). Se representa trazando la frecuencia en el eje x y la potencia en el y (imagen 4). La potencia se representa en decibelios, definida como 10 veces el logaritmo en base 10 del cuadrado de amplitud de un componente de frecuencia del EEG. Por lo tanto, el espectro de un segmento de datos es una gráfica de frecuencia por potencia [10 log10 (amplitud)2].
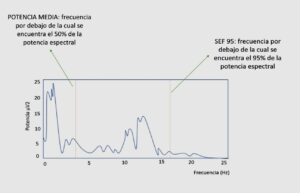
Existen otras herramientas como el SEF95 (SEF: Spectral Edge Frequency) o límite espectral (7), que es la frecuencia por debajo de la cual se encuentra el 95% de la potencia espectral. Un SEF inferior a 12-14 Hz indica que el 95% de la frecuencia está por debajo de 12-14 Hz, indicando que el paciente está adecuadamente anestesiado con respecto al estímulo (quirúrgico).
El espectro únicamente analiza un segmento de datos del EEG. En quirófano necesitamos que se analicen segmentos de datos sucesivos. Esto se visualiza mediante el espectrograma-EEG.
El espectrograma permite mostrar (con cierto retraso) las oscilaciones electroencefalográficas a lo largo del tiempo, debidas a cambios en la dosis de anestésicos / adyuvantes y a la intensidad del estímulo que recibe. El espectrograma Sedline® es una estructura tridimensional, que se traza con representación bidimensional, colocando en el eje x el tiempo, en el y la frecuencia y en el z la potencia que se codifica en una escala de colores que van desde el rojo (mayor proporción de ondas o “alta potencia”) a azul (apenas se detecta actividad electroencefalográfica, o “baja potencia”) (imagen 5). La gráfica bidimensional del espectrograma se denomina matriz de densidad espectral (MDE) o siglas en ingles DSA (Density Spectral Array) mientras que la gráfica tridimensional se llama matriz espectral comprimida.
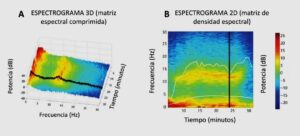
Fuente: modificado de Purdon P, Samposon A, Pavone KJ, Brown EN. Clinical Electroencephalography for Anesthesiologist, Part I: Background and Basic Signatures. Anesthesiology.2015;123(4):937-960
El sensor con electrodos que registran la función cerebral se coloca en la región fronto-temporal. Un paciente consciente con los ojos cerrados mostrará oscilaciones alfa y beta en áreas occipitales (no registradas por la ubicación fronto-temporal del sensor). Con los ojos cerrados y según va disminuyendo el nivel de consciencia se produce el fenómeno de anteriorización (8), en el cual la potencia en bandas alfa y beta del EEG se desplaza desde el área occipital hacia la parte frontal del córtex cerebral, captándose por los electrodos del sensor del Sedline®. Se cree que esta anteriorización de las ondas alfa se producen por el establecimiento de la reverberación del circuito corticotalámico entre la corteza prefrontal y el tálamo (9).
Electroencefalograma en el proceso anestésico
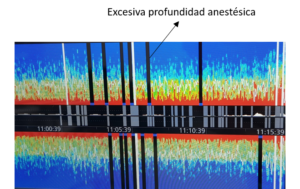
El EEG de un paciente consciente se caracteriza por presentar una actividad predominante de ondas de baja amplitud y alta frecuencia (ondas beta y alfa). La administración de la mayoría de los anestésicos, a dosis hipnótica, producirá un aumento de la amplitud y un descenso de la frecuencia en el EEG raw. Cuando tenemos una profundidad anestésica (componente hipnótico) excesiva (respecto al estímulo aferente) pueden aparecer periodos temporales con ausencia de ondas electroencefalográficas (silencio eléctrico) mezclado con rachas de ondas ondulantes (ondas de gran amplitud y baja frecuencia). Este patrón del EEG se denomina ráfagas o salvas de supresión-descarga (burst suppression)(imagen 6) que es frecuente observar en planos anestésicos muy profundos, en el coma farmacológico inducido (barbitúrico, propofol) e incluso en la hipotermia inducida moderada-profunda. En el EEG procesado este patrón se conoce como tasa de supresión (TS).

La tasa de supresión (TS) es otro parámetro del espectrograma que nos informa sobre el grado de depresión cortical. Además de informar de sobredosificación (plano profundo), tiene otras aplicaciones. El coma barbitúrico inducido, guiado por EEG, se define mediante un patrón de salvas de supresión: >5 salvas/minuto. Una alternativa al EEG, es la utilización del índice biespectral (BIS), ya que hay buena correlación entre el EEG (patrón 3-5 salvas/min) con valores promedio de BIS 15 y Tasa de supresión 75% (10). La medición de niveles plasmáticas de barbitúricos tiene dos problemas: la gran variabilidad intra e interindividual por los fenómenos de inducción enzimática y la existencia de metabolitos activos (11).
Otras aplicaciones clínicas del EEG-procesado, incluyen la detección del infarto/isquemia cerebral (si se produce en la zona de registro) y la identificación del estado comicial no convulsivo, relacionado con las convulsiones subclínicas, los episodios de despolarización cortical propagada (CSD: cortical spreading depression) y las despolarizaciones peri-infárticas (PID: peri-infarct depolarization) o fenómenos CSD-like.
Las ventajas de la anestesia general guiada por espectrograma-EEG son: a) minimizar el despertar intraoperatorio (memoria explicita), b) disminuir el consumo de anestésicos, c) evitar tanto la sobredosificación que acarrea un plano profundo anestésico como la neurotoxicidad (disfunción cognitiva y otros) y d) facilitar la educción anestésica rápida y precoz, por disminución del acúmulo de fármacos anestésicos / adyuvantes; lo que permite realizar una diligente evaluación neurológica.
Otro parámetro que determina el Sedline® es la asimetría MDE interhemisférica (ASYM). Se trata de una variable procesada que indica el porcentaje de potencia del EEG presente en el hemisferio izquierdo o derecho, con relación a la potencia total del EEG. En una situación de clara diferencia (>20%) entre los hemisferios, la ASYM señala el hemisferio con mayor potencia-EEG.
El análisis de coherencia espectral muestra el grado de correlación que hay entre dos señales a una frecuencia determinada. Una coherencia de 1 indica correlación perfecta entre ambas señales a esa frecuencia dada, mientras que para un valor de 0 indica ausencia de correlación entre ambas señales. Mediante el análisis de la coherencia aplicado a los diferentes fármacos se podrían establecer estudios para definir el mecanismo de acción a nivel de los circuitos neuronales de los diferentes fármacos anestésicos. A día de hoy no es un método universalmente establecido para la valoración de la profundidad anestésica, pero si con potencial para el desarrollo de futuras investigaciones (12).
Cada uno de los diferentes anestésicos presentan características típicas (signature) en el EEG raw y en la MDE que deben conocerse y evaluar para una dosificación anestésica individualizada. La expresión electroencefalográfica final dependerá de la acción predominante de uno sobre los demás.
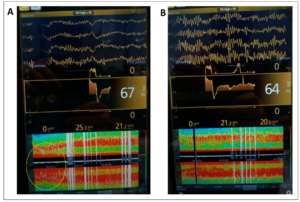
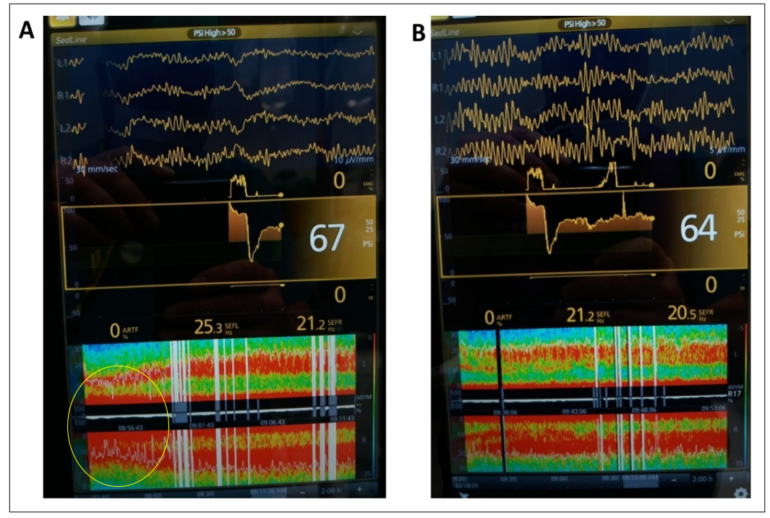
El propofol es el fármaco anestésico más ampliamente utilizado tanto en la inducción como en el mantenimiento de la anestesia general. Actúa sobre los receptores GABA (ácido γ-aminobutírico) aumentando la actividad en las sinapsis inhibitorias y disminuyendo la apertura de los canales de sodio. Cuando se utiliza propofol predominarán en el EEG y en la MDE ondas lentas-delta y ondas alfa (imagen 7).
Si administramos dosis elevadas de Propofol se puede producir fenómenos de supresión-descarga en salvas o burst suppression (imagen 8), que en la MDE se representa como bandas de color negro. Las de color blanco se atribuyen a artefactos
Los fármacos anestésicos volátiles se clasifican en orgánicos que son líquidos a temperatura ambiente, dentro de los cuales se encuentra el enfluorano, isofluorano, desfluorano y sevofluorano; y en inorgánicos o gases a temperatura y presión ambiente, como el óxido nitroso y el xenón.
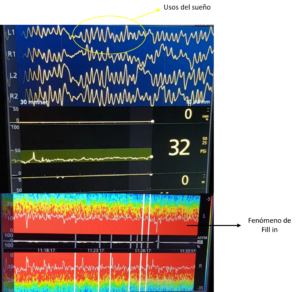
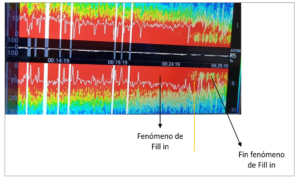
A concentraciones inferiores a la concentración alveolar mínima (CAM), el sevofluorano muestra ondas alfa junto a ondas delta y lenta, que semejan mucho a las que aparecen con el uso de Propofol. Si se aumenta la concentración de sevofluorano, aparece una fuerte presencia de ondas theta que crea un patrón de potencia distribuida uniformemente desde el rango de oscilación lenta hasta el rango alfa. Este patrón se denomina fenómeno de “fill in” (imagen 9). A medida que disminuye la CAM espirada de sevofluorano, las ondas theta se van disipando en el espectrograma-EEG (imagen 10). El isofluorano y el desfluorano presentan patrones similares al sevofluorano (4).
El óxido nitroso se asocia con oscilaciones beta y gamma prominentes y con una disminución relativa de la potencia en las bandas de oscilación lenta y delta.
La ketamina es un derivado de la fenciclidina que actúa sobre los receptores NMDA, (antagonista no competitivo), receptores opioides (produce analgesia), receptores de catecolaminas (efecto simpático) e interfieren con el receptor de acetilcolina (potencia la acción de los bloqueantes neuromusculares no despolarizantes). Cuando únicamente se administra ketamina el EEG mostrará oscilaciones en rango beta y gamma. Estas oscilaciones aparecen a los 2 minutos del inicio de la dosis. Si se administra junto con otro fármaco y predomina la acción de la ketamina sobre el otro medicamento, se apreciará un aumento de las ondas en rangos beta y gamma.
La dexmedetomidina es un agonista selectivo de los receptores alfa 2-adrenérgicos a nivel periférico y central (encéfalo y médula espinal), que produce un efecto sedante y ansiolítico mediante la estimulación pre sináptica de receptores alfa2 a nivel del locus coeruleus. También presenta un efecto analgésico.
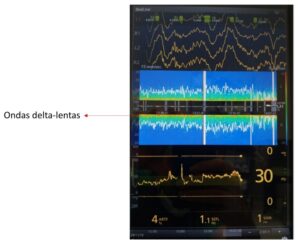
Si la administramos a dosis bajas (0,6 µg/kg/h) induce un nivel de sedación en el que el paciente responde a una estimulación auditiva o táctil mínima. En el EEG aparecerá una combinación de ondas lenta y delta, junto con fenómenos típicos de la fase II del sueño no REM (husos del sueño o “spindles”), que es una modalidad de ritmo alfa con ondas sinusoidales de 9 a 15 Hz, que ocurren en ráfagas y duran de uno a dos segundos. Cuando aumenta la velocidad de infusión (1 µg/kg/h) los husos desaparecen y aumenta la presencia de ondas lenta y delta. Este patrón EEG de oscilaciones lenta-delta se parece mucho a la fase III-IV del sueño lento o no REM.
Otras medidas de la profundidad anestésica
Existen diferentes parámetros para monitorizar la profundidad anestésica (hipnosis) dentro de los cuales se encuentran los potenciales evocados auditivos (PEA). Los PEA son la respuesta a un estímulo auditivo que se trasmite desde la cóclea hasta el córtex (bilateral) cerebral (A1 o área de Heschl). Dependiendo del tiempo que transcurre desde que se emite el sonido hasta que se obtiene respuesta cortical los PEA se clasifican en potenciales evocados auditivos de tronco del encéfalo (PEAT), potenciales evocados de latencia larga (PEALL) y potenciales evocados auditivos de latencia media (PEALM). Los PEAT son los que se generan en el tronco encefálico durante los primeros 10 milisegundos (ms) tras el estímulo acústico. Estos potenciales se afectan poco con los anestésicos, por lo que no se usan para determinar la profundidad anestésica (13).
Los PEALM se generan entre 10-100 ms tras el estímulo acústico. Existe una correlación entre los cambios morfológicos de los PEALM y la profundidad anestésica (componente hipnótico). El algoritmo para determinar el parámetro de los PEALM, se conoce como índice AAI®, que se obtiene a través de un modelo dinámico lineal de extracción rápida, conocido como autorregresión con variables exógenas de entrada (ARX), que los actualiza en menos tiempo que los obtenidos por el modelo autorregresivo de media móvil (MTA); ya que estos últimos requieren un tiempo prolongado para su renovación (actualizar la variable de respuesta) y por tanto no son aptos para monitorizar la profundidad anestésica. Durante la utilización de medicamentos anestésicos como propofol, isofluorano, halotano, enfluorano, etomidato y ketamina disminuye la amplitud y aumenta la latencia de las ondas (Pa y Nb) (14), de manera dependiente de la dosis; pero independiente del fármaco anestésico/adyuvante; por lo que la disminución de los PEALM se correlaciona con la profundidad del plano anestésico (hipnosis) o el nivel de sedación. El índice AAI® es un numero escalado adimensional: 100 – 60 (consciente), 60 – 40 (soñoliento), 40 – 30 anestesia ligera, < 30 anestesia quirúrgica; 0 (silencio bioelétrico). En el caso de AEP monitor se recomiendan índices entre 15 y 25 y en el del BIS entre 40 y 60, pero no parece haber diferencias entre usar el espectrograma-EEG (BIS® o similar) o el IAA® de los PEALM aunque utilicen algoritmos diferentes para la extracción del valor indicador de la señal bioeléctrica cerebral (15). Entre las ventajas de los PEALM respecto al espectrograma-EEG se sugiere que discierne mejor entre consciencia e inconsciencia, tanto en la inducción como en la educción anestésica. La limitación a utilizar los PEALM será en aquellos pacientes con anomalías en la vía aferente auditiva (bilateral > unilateral), es decir la presencia de hipoacusia: conductiva o de transmisión, o neurosensorial o de percepción, o bien mixta.
Los PEALL se generan tras más de 100 ms del estímulo acústico. Estos no han demostrado ser útiles para determinar la profundidad anestésica, sí que podrían ser útiles para estudiar alteraciones cognitivas producidas durante la anestesia (16)

Conclusión
El EEG analógico clásico ha evolucionado al EEG digital para facilitar su interpretación y almacenamiento. La monitorización electroencefalográfica procesada, a través de algoritmos específicos, determina diferentes parámetros (índice espectral, SEF, TS, MDE, coherograma y otros derivados) para estimar el componente hipnótico de la anestesia general o la sedación consciente. Es importante que el anestesiólogo adquiera destreza y sepa interpretar tanto el índice espectral como el espectrograma EEG-especifico (signature) de cada fármaco anestésico. Durante el intraoperatorio las interferencias con la señal bioeléctrica cortical deben evaluarse.
El espectrograma del Sedline® proporciona el índice espectral (algoritmo) mediante un valor numérico (PSI) y además el SEF, la TS, la MDE y otros parámetros derivados. El PSI evalúa el concepto de anestesia adecuada (componente cortical: hipnosis); sin embargo, el valor numérico (PSI) que aportan estos profundímetros en muchas ocasiones no corresponde con la situación clínica del paciente, p. ej. consciencia/inconsciencia, PSI paradójico, PSI bajo de origen genético, potencia baja de todas las bandas en ancianos, artefactos y otras limitaciones. Además, los fármacos utilizados (anestésicos y/o adyuvantes) tienen efectos neurofarmacológicos y neurofisiológicos específicos (specific signature) que se mostrarán en el EEG raw, pero con más claridad en la monitorización EEG procesada (MDE).
En consonancia con el grupo de Brown EN y Purdon PL de Harvard se propone un nuevo acercamiento a la neuromonitorización: entrenar al anestesiólogo para reconocer e interpretar los estados cerebrales inducidos por anestésicos, mediante sus huellas digitales (specific signature) observables en el EEG.
Conflicto de intereses
Los autores expresan que no hay conflictos de intereses con Sedline®.
Bibliografía
1. Rampil IJ, Holzer JA, Quest DO, Rosenbaum SH, Correll JW. Prognostic value of computerized EEG analysis during carotid endarterectomy. Anesth Analg. 1983;62(2):186-92. (PubMed)
2. Myles PS, Leslie K, McNeil J, Forbes A, Chan MT. Bispectral index monitoring to prevent awareness during anaesthesia: the B-Aware randomised controlled trial. Lancet. 2004;363(9423):1757-63. https://doi.org/10.1016/S0140-6736(04)16300-9 (PubMed)
3. García-Colmenero IG, Zorrilla-Mendoza JG, Vega-Anzures LA, Garcia-Nájera O. Electroencefalograma para el anestesiólogo, consideraciones clínicas. Rev mex anestesiol. 2018;41(Supl 1):S39-S43. (PDF)
4. Purdon PL, Sampson A, Pavone KJ, Brown EN. Clinical Electroencephalography for Anesthesiologists: Part I: Background and Basic Signatures. Anesthesiology. 2015;123(4):937-60. https://doi.org/10.1097/ALN.0000000000000841 (PubMed)
5. Johansen JW. Update on bispectral index monitoring. Best Pract Res Clin Anaesthesiol. 2006;20(1):81-99. https://doi.org/10.1016/j.bpa.2005.08.004
6. Babadi B and Brown EN. A review of multitaper spectral analysis. IEEE Trans Biomed Eng. 2014;61(5):1555-64. https://doi.org/10.1109/TBME.2014.2311996 (PubMed)
7. Drummond JC, Brann CA, Perkins DE, Wolfe DE. A comparison of median frequency, spectral edge frequency, a frequency band power ratio, total power, and dominance shift in the determination of depth of anesthesia. Acta Anaesthesiol Scand. 1991;35(8):693-9. https://doi.org/10.1111/j.1399-6576.1991.tb03374.x (PubMed)
8. Mhuircheartaigh RN, Rosenorn-Lanng D, Wise R, Jbabdi S, Rogers R, Tracey I. Cortical and subcortical connectivity changes during decreasing levels of consciousness in humans: a functional magnetic resonance imaging study using propofol. J Neurosci. 2010;30(27):9095-102. https://doi.org/10.1523/JNEUROSCI.5516-09.2010 (PubMed)
9. Vijayan S, Ching S, Purdon PL, Brown EN, Kopell NJ. Thalamocortical mechanisms for the anteriorization of α rhythms during propofol-induced unconsciousness. J Neurosci. 2013;33(27):11070-11075. http://dx.doi.org/10.1523/JNEUROSCI.5670-12.2013 (PubMed)
10. Riker RR, Fraser GL, Wilkins ML. Comparing the bispectral index and suppression ratio with burst suppression of the electroencephalogram during pentobarbital infusions in adult intensive care patients. Pharmacotherapy. 2003;23(9):1087-93. https://doi.org/10.1592/phco.23.10.1087.32766 (PubMed)
11. Winer JW, Rosenwasser RH, Jimenez F. Electroencephalographic activity and serum and cerebrospinal fluid pentobarbital levels in determining the therapeutic end point during barbiturate coma. Neurosurgery. 1991;29(5):739-41. https://doi.org/10.1097/00006123-199111000-00016 (PubMed)
12. Akeju O, Westover MB, Pavone KJ, Sampson AL, Hartnack KE, Brown EN, et al. Effects of sevoflurane and propofol on frontal electroencephalogram power and coherence. Anesthesiology. 2014;121(5):990‐998. (PubMed) https://doi.org/10.1097/ALN.0000000000000436
13. Plourde G. Auditory evoked potentials. Best Pract Res Clin Anaesthesiol. 2006;20(1):129‐139. https://doi:10.1016/j.bpa.2005.07.012 (HTML)
14. Schwender D, Klasing S, Madler C, Pöppel E, Peter K. Midlatency Auditory Evoked Potentials and Cognitive Function During General Anesthesia. International Anesthesiology Clinics 1993;31(4):89-106. (PubMed) https://doi.org/10.1097/00004311-199331040-00009
15. Álvarez JC et al. Utilidad del BIS y AEP monitor/2 para el mantenimiento de la anestesia combinada sevofluorano-regional, comparada con la práctica estándar en población pediátrica. Anestesiol Reanim. (PDF) 2008;55(9):527‐534. doi:10.1016/s0034-9356(08)70648-0.
16. Korpelainen JT, Kauhanen ML, Tolonen U, Brusin E, Mononen H, HIltunen P, et al. Auditory P300 event related potential in minor ischemic stroke. Acta Neurol Scand 2000;101(3):202-8. https://doi.org/10.1034/j.1600-0404.2000.101003202.x. (PubMed)




Felicidades muy buen artículo.