López Segura M (1), Rodilla Fiz AM (2)
(1) Facultativo Especialista de Área. Servicio de Anestesiología, Reanimación y Terapéutica del Dolor. Hospital General Universitario Santa Lucía. Cartagena, Murcia, España.
(2) Facultativo Especialista de Área. Servicio de Anestesiología, Reanimación y Terapéutica del Dolor. Hospital General de Almansa. Albacete, España.
Cómo citar este artículo: López Segura, M., & Rodilla Fiz, A. M. (2022). Manejo preoperatorio del paciente con enfermedad renal crónica. Revista Electrónica AnestesiaR, 14(4). https://doi.org/10.30445/rear.v14i4.996
Definición de Enfermedad Renal Crónica
En el último consenso propuesto en 2012 por the National Kidney Foundation Kidney Disease Outcomes Quality Initiative (6) se define la Enfermedad Renal Crónica (ERC) del adulto como anomalías de estructura o función renal (sedimento, imagen, histología), presentes durante más de 3 meses, con implicaciones para la salud. Se puede clasificar según la causa, la categoría de filtrado glomerular (FG) y la categoría de albuminuria (CGA).
La gravedad de la ERC se ha clasificado en 5 categorías o grados en función de la FG y 3 de CGA (Figura 1). La importancia de la proteinuria en el estadiaje de la ERC es debida a que se considera el factor pronóstico modificable más potente de progresión.
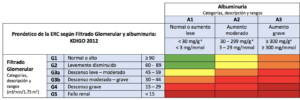
Tabla adaptada de las guías KDIGO (Kidney Disease: Improving Global Outcomes) (6).
El deterioro en el FG es característico de los grados 3 al 5, no siendo necesaria la presencia de otros signos de daño renal. Sin embargo, en las categorías 1 y 2 sí se requiere la presencia de otros signos de daño renal como hematuria, proteinuria o alteraciones en las pruebas de imagen, ya que las cifras de FG se consideran normales. Se trata de una clasificación dinámica y en constante revisión.
Importancia del FG
Como hemos comprobado, el FG es un parámetro crítico para el estadiaje de la ERC, su manejo y seguimiento. El aclaramiento de creatinina (CCr) es el test más difundido para estimar el FG, sin embargo tiene sus limitaciones. Cuando el FG desciende, se produce un aumento en la secreción tubular de creatinina que termina sobreestimando el FG real en un 10-30%. Además se han descrito errores potenciales en la recogida de orina en 24 horas, derivados de la correcta toma de muestra y cuantificación del volumen urinario. No obstante, en algunos estudios en paciente crítico se han mostrado válidas las mediciones de CCr en orina de periodos cortos, que pueden resultar útiles en la práctica habitual (7).
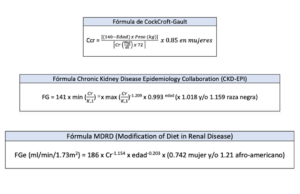
Se han desarrollado múltiples fórmulas para el cálculo del FG a partir de la Cr (creatinina) sérica junto a variables analíticas, demográficas y/o antropométricas, obviando la necesidad de recoger la orina de 24 horas, pero únicamente válidas para pacientes estables y ambulatorios. Actualmente las más empleadas en investigación y en la practica clínica son el MDRD (Modification of Diet in Renal Disease) en su formato simplificado o completo, y la ecuación de CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) que ha demostrado mejores resultados en cuanto a exactitud y precisión; la ecuación de Cockcroft es menos precisa en pacientes mayores de 65 años o con pesos extremos (figura 2). Todas ellas, se encuentran disponibles en la web de la Sociedad Española de Nefrología (8).
Riesgos de la cirugía en la enfermedad renal crónica
Se ha evidenciado que la ERC es un factor de riesgo de complicaciones postoperatorias graves, como lesión renal aguda y complicaciones cardiovasculares, que se asocian con una mayor morbilidad y mortalidad. Concretamente, uno de los factores de riesgo más frecuentes que se postulan como predictores de fallo renal postoperatorio es la presencia de disfunción renal preoperatoria.
La enfermedad cardiovascular es común. El infarto de miocardio, la insuficiencia cardíaca y el accidente cerebrovascular son la principal causa de muerte en pacientes con insuficiencia renal (9). Existe además una alta incidencia de enfermedad coronaria que tiende a seguir una evolución rápidamente progresiva (10) y particularmente, en pacientes jóvenes, la ERC aumenta cien veces el riesgo de mortalidad cardiovascular perioperatoria (11).
Manjunath et al demostraron que la disminución de función renal se asociaba con un marcado aumento en la probabilidad de enfermedad cardiovascular, de forma que por cada 10 ml/min/1,73m2 que desciende la TFG (Tasa de Filtración Glomerular) , se incrementa el riesgo de forma significativa (13).
Riesgo de daño renal en función del tipo de cirugía
Un predictor significativo para el riesgo de empeoramiento de la función renal es el tipo y extensión de la cirugía. Existe una fuerte asociación entre el riesgo de disfunción renal postoperatoria y la cirugía vascular. La cirugía cardíaca tiene un riesgo aumentado de hasta el 30 % en comparación con la población general, especialmente en cirugías que requieren bypass cardiopulmonar, relacionadas con grandes cambios hemodinámicos.
La duración de la hipotensión intraoperatoria y de la isquemia renal, se han postulado como factores clave en el desarrollo de daño renal(14).
En la Tabla 1 se observan una clasificación de las cirugías en función del riesgo cardiaco que presentan y por ende, el riesgo de empeoramiento de la enfermedad renal.
Por otra parte, en cirugía abdominal nos enfrentamos a un problema añadido como es la presencia de hipertensión abdominal que puede afectar a la perfusión renal y condicionar la aparición de daño renal.
La técnica quirúrgica también influye en el riesgo de disfunción renal postoperatoria. La técnica endovascular, por ejemplo en la reparación del aneurisma abdominal, disminuye las complicaciones renales comparado con la cirugía abierta, sin embargo el empleo de contraste para la realización de este tipo de técnicas, a pesar de una correcta preparación renal, puede aumentar el riesgo de nefrotoxicidad. Por otro lado, la técnica anestésica también podría influir en el riesgo de disfunción renal, especialmente si con la misma se producen grandes cambios hemodinámicos.
Principios de preparación preanestésca
Evaluación preoperatoria: generalidades.
El objetivo de la valoración preanestésica consiste en realizar una evaluación integral del paciente así como estimar posibles complicaciones con el fin de adecuar nuestras intervenciones para modificar, a corto y a largo plazo, morbilidad y mortalidad (1).
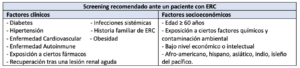
En este sentido, The National Kidney Foundation en sus guías Kidney Disease Improving Global Outcomes (KDIGO), recomienda indagar durante la evaluación de los pacientes con enfermedad renal crónica: el diagnóstico etiológico, las comorbilidades, la severidad (nivel de función renal), las complicaciones, y estimar el riesgo de pérdida de la función renal y de complicación cardiovascular. En la valoración preanestésica estos parámetros deben sumarse a los riesgos inherentes del procedimiento quirúrgico con el fin de optimizar los factores de riesgo.
Como sabemos, la ERC puede ser una enfermedad asintomática y frecuentemente infradiagnosticada (14). Es por ello, que la identificación precisa de estos pacientes se basa en detectar factores de riesgo relacionados, la presencia de enfermedades sistémicas (Tabla 2) y la alteración en distintas pruebas de laboratorio (como cifras de creatinina sérica, urea y TFG (Tasa de Filtración Glomerular) estimada.
Dentro de las directrices generales para la realización de pruebas complementarias, es recomendable que se intenten ajustar al estadio de la ERC.
ERC Estadio 1 y 2:
- Electrocardiograma (ECG) y Radiografía de tórax según la edad, patología asociada y tipo de cirugía.
- Analítica para evaluar función renal, que incluya hemograma, ionograma y creatinina, independientemente de la edad y cirugía.
ERC Estadio 3, 4 y 5:
- ECG.
- Radiografía tórax.
- Analítica completa que incluya: hemograma, coagulación, glucemia, ionograma, equilibrio ácido-base y albúmina.
En la mayoría de las ocasiones los pacientes con ERC serán conocidos y estarán estudiados previamente a nuestra valoración; no obstante puede ocurrir que en la evaluación preoperatoria nos encontremos ante un paciente con ERC no conocida, y en ese caso, será conveniente:
– Estadios 1, 2 o 3a: Derivar al su Médico de Atención Primaria.
– Estadios 3b, 4 y 5: a Nefrología.
En ambos casos, no será urgente, y por lo tanto no deberá retrasar la cirugía, a no ser que el paciente presente signos y/o síntomas de descompensación clínica.
Cuando se trate de un paciente con ERC conocida y detectemos un empeoramiento de la función renal (disminución sobre la basal de FG > 20 ml/min que implique una progresión de estadio) deberemos realizar interconsulta a Nefrología para diagnóstico y optimización; siendo con prioridad urgente en los siguientes casos:
– Hiperpotasemia > 5.5 mEq/L
– Anemia: Hemoglobina < 11g/dL
– Acidosis metabólica: Bicarbonato < 20 mmol/L
– Edemas
– Albuminemia < 35 g/L
– Hipo/hipernatremia (<130 mEq/L o > 148 mEq/L)
– Hipocalcemia < 8.4 mg/dl (2,10 mmol/L)
– Tensión Arterial (TA )> 130/80 mmHg
En aquellos pacientes con ERC estadio 5 en situación de prediálisis, se deberá realizar interconsulta a Nefrología para valorar la posibilidad de iniciarla antes de la cirugía y/o en el postoperatorio inmediato.
En cualquiera de los casos y en especial los pacientes con trasplante renal es fundamental informar al Nefrólogo del tipo de cirugía propuesta y la fecha prevista, para poder programar la diálisis previa y postoperatoria o el tratamiento inmnosupresor durante el perioperatorio, si fuera necesario.
Evaluación preoperatoria: revisión por sistemas
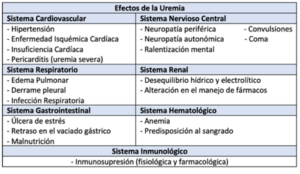
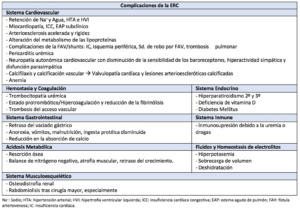
La disfunción multisistémica (15) que se observa en la ERC puede ser consecuencia directa de los efectos de la propia insuficiencia renal (Tablas 3 y 4), como secundaria a los factores desencadenantes de la misma.
El conocimiento de la disfunción multistémica es clave para administrar una anestesia segura a un paciente con ERC (16), tanto para procedimientos quirúrgicos mayores como menores; por ello, puede resultarnos útil el abordaje del manejo preoperatorio realizando una revisión fisiopatológica de los aparatos y sistemas que más afectación presentan en los enfermos renales.
- Afectación Cardiovascular
Hipertrofia ventrículo izquierdo (HVI). Ocurre de forma secundaria a la sobrecarga de presión y volumen. La sobrecarga de volumen puede deberse a la retención de sodio y agua, la presencia de una fístula arteriovenosa (FAV) o bien por el efecto compensatorio que la anemia crónica provoca al aumentar del volumen sistólico y la frecuencia cardíaca. De forma añadida, la sobrecarga de presión tiene que ver con la hipertensión arterial (HTA) y ateroesclerosis, asociadas habitualmente a la ERC. La HVI se asocia con fibrosis miocárdica y alteraciones en la relajación, condicionando por un lado la aparición potencial de enfermedad coronaria, el desarrollo de arritmias, y por otro lado favoreciendo la disfunción diastólica. Glassock et al (17) afirmaron que la disfunción diastólica subclínica es uno de los hallazgos ecocardiográficos más frecuentes en pacientes asintomáticos con ERC, junto con la HVI. La reducción en la complianza del ventrículo izquierdo (VI) puede resultar en una menor tolerancia a cambios en la volemia, de manera que pequeños incrementos en el volumen sistólico puedan precipitar edema agudo de pulmón (9)(5). Además, como consecuencia de la dilatación de cavidades se puede observar una insuficiencia triscuspídea o mitral, y en un alto porcentaje de pacientes a la insuficiencia cardíaca diastólica se añade una insuficiencia cardíaca sistólica progresiva (18). En definitiva, la HVI es un factor de riesgo independiente para producir arritmia, infarto de miocardio e insuficiencia cardíaca de inicio diastólico.
Arteriosclerosis acelerada. En la patología renal se observa un deterioro en la función endotelial e inflamación vascular. A su vez, es frecuente que el metabolismo de las lipoproteínas se encuentre alterado, fenotípicamente con un descenso en los niveles de lipoproteínas de alta densidad (HDL) y un aumento en los niveles de lipoproteínas de baja densidad (LDL) junto a hipertrigliceridemia, típico de los pacientes con ERC, condiciona la aparición de ateroesclerosis. La activación del sistema renina-angiotensina aldosterona (SRAA) también contribuye a este fenómeno, pues la Angiotensina II actúa sobre el receptor de la angiotensina-1 -AT1- promoviendo la producción de radicales libres de oxígeno y con ello acentuando la disfunción endotelial y remodelación vascular.
Calcificación vascular. La ERC favorece el desarrollo de lesiones ateroscleróticas estenóticas calcificadas y de enfermedad cardíaca valvular, y los suplementos de calcio pueden potenciar este proceso. La calcifilaxis es un tipo específico de calcificación vascular relacionada con la diálisis que se caracteriza por una calcificación difusa de arterias pequeñas, medianas y arteriolas con proliferación y trombosis de la íntima. Produce úlceras cutáneas y puede provocar necrosis cutánea potencialmente mortal o gangrena acral.
Anomalías en la conducción. Tanto la fibrosis miocárdica como la calcificación que afecta al sistema de conducción, resultan en un aumento de la prevalencia de bloqueo auriculoventricular (BAV) de segundo y tercer grado, así como un aumento de la incidencia de marcapasos permanente en pacientes en diálisis. Además, la hiperpotasemia y el tratamiento con antagonistas del calcio pueden contribuir al desarrollo de un BAV completo, al igual que la anestesia epidural, con la consiguiente reducción de la actividad simpática.
Hipertensión arterial. La HTA puede ser la causa principal de la enfermedad renal o bien el resultado de una enfermedad renal parenquimatosa o renovascular. En el riñón sano existe un proceso de autorregulación que mantiene constante el flujo de sangre y la presión capilar intraglomerular, a pesar de fluctuaciones en la presión arterial media (PAM) -entre 80 y 160 mmHg-. Este mecanismo de autorregulación confiere protección glomerular pero requiere la integridad del reflejo miogénico y el feedback túbulo-glomerular en el tono de la arteriola aferente. La disfunción de estos mecanismos conduce a un deterioro de la autorregulación, de manera que incrementos de la presión sistémica estarán asociados con aumentos de la presión intraglomerular, predisponiendo al desarrollo de lesión renal (19). Por este motivo, el control de la presión arterial y el bloqueo del SRAA son herramientas importantes para preservar la función residual en pacientes con enfermedad renal tanto diabética como no diabética.
A pesar de que los inhibidores de la enzima convertidora de angiotensina (IECA) y los bloqueadores de los receptores de angiotensina II (ARA) pueden precipitar un deterioro de la función renal, por ejemplo, en presencia de estenosis aterosclerótica bilateral de la arteria renal, la mayoría de los pacientes con ERC e HTA suelen beneficiarse de dicho tratamiento. Así, el bloqueo del SRAA puede tener beneficios renoprotectores más allá del control de la HTA; habiéndose demostrado un beneficio pronóstico importante en la enfermedad renal proteinúrica con ambos grupos de fármacos(9).
Por último, no debemos olvidar que la eritropoyetina aumenta la viscosidad de la sangre y la resistencia vascular, pudiendo agravar la hipertensión; y del mismo modo, tanto los inhibidores de la calcineurina (ciclosporina) como los corticosteroides, pueden inducir HTA en los receptores de trasplante renal.
Recomendaciones preoperatorias
- Es necesario indagar en la historia en busca de hallazgos clínicos que nos puedan sugerir enfermedad cardiovascular, ya que en líneas generales, se recomienda considerar a todo paciente con ERC, paciente de alto riesgo cardiovascular, incluso en ausencia de clínica, ya que ésta podría estar enmascarada por la presencia de diabetes o intolerancia al ejercicio.
- En el ECG se pueden observar cambios inespecíficos como HVI, trastornos electrolíticos y pericarditis urémica, dificultando nuevamente el diagnóstico de la enfermedad coronaria.
- Según las guías de la AHA preoperatorias, es una recomendación II-B, la realización de una prueba de estrés no invasiva en pacientes con capacidad funcional < 4 con factores de riesgo (20) (tabla 5). Se han descrito pruebas complementarias para detectar enfermedad cardiovascular en el perioperatorio, como son la solicitud de troponinas T, ecocardiografía de estrés con dobutamina y si fuera necesario, una angiografía coronaria con revascularización, previo a la cirugía.
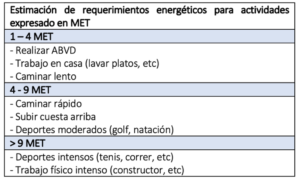
MET: Equivalentes metabólicos energéticos.
- El control adecuado de la HTA es fundamental. Las últimas guías KDIGO para el manejo de la HTA (21), recomiendan un objetivo de PA < 140/90 mmHg en pacientes con cociente albúmina/creatinina < 30 mg/g y una PA < 130/80 mmHg en pacientes con cociente albúmina/creatinina ≥ 30 mg/g, tanto en no diabéticos como en diabéticos.
- Los fármacos antihipertensivos habitualmente empleados son los bloqueantes del SRAA: IECA o ARA II, no obstante la mayoría de los pacientes necesitarán más de un fármaco para el control adecuado de la HTA. Los efectos reno-vasculares de los bloqueantes del SRAA pueden estar potenciados bajo anestesia general, aumentando el riesgo de pérdida de control de la TA y el tono vascular renal. Por este motivo, en pacientes/cirugías susceptibles de hipotensión, se puede considerar la suspensión transitoria el día antes de la cirugía o bien, la dosificación nocturna el día previo a la intervención, de forma que asegure un mínimo de 10 h sin toma de fármaco, y solo reiniciarse en el postoperatorio en situación de euvolemia sin evidencia de lesión renal aguda. En caso que la indicación farmacológica sea por insuficiencia cardíaca (IC), en general se recomienda continuar con la medicación y controlar de forma cuidadosa la situación hemodinámica (20). De la misma forma, pacientes con IC y edema pulmonar deberán mantener el tratamiento diurético.
- Dado que resulta habitual que estos pacientes presenten dislipemia, se recomienda tratarla independientemente del estadio, y mantener la medicación en el perioperatorio.
2. Anemia
La etiología de la anemia en el paciente con ERC es multifactorial:
- El principal mecanismo patogénico es el déficit en la producción de eritropoyetina (EPO).
- Las toxinas urémicas acortan la vida media del hematíe, disminuyen la afinidad de los receptores de la EPO y la capacidad de unión de la transferrina al hierro.
- Pérdidas hemáticas, por la sangre que queda residual en los circuitos de hemodiálisis o durante la desconexión, o incluso por el exceso de pruebas de laboratorio que se le realizan.
- Déficit de hierro y vitaminas.
- Fibrosis de la médula ósea secundaria al hiperparatiroidismo.
Se trata de una anemia de perfil normocítica y normocroma, que suele aparecer cuando el FG es menor de 60 ml/min, siendo una complicación común en pacientes con ERC moderada a grave.
Recomendaciones preoperatorias:
- En general, se recomienda un nivel de hemoglobina preoperatoria > 11 g/dL.
- Las guías de la KDIGO recomiendan tratamiento con agentes estimuladores de la eritropoyesis en pacientes con niveles de hemoglobina (Hb) entre 9 y 10 g/dL (500 Ul/kg), pudiendo asociar hierro intravenoso (200 mg) en caso de índice de saturación de la transferrina ≤ 30 % y una ferritina sérica ≤ 500 ng/ml, un día antes de la cirugía, lo que podría reducir significativamente la necesidad de transfusión de hemoderivados (22).
3. Afectación Hemostasia
Los pacientes con ERC presentan un problema hemostático complejo. Habitualmente experimentan una tendencia al sangrado caracterizada por disfunción plaquetaria, sin embargo, existe también evidencia de un estado protrombótico en estos pacientes.
En general, la disfunción hemostática aparece cuando hay una disminución considerable del FG, y es multifactorial. Entre las alteraciones causantes de esta disfunción, destacamos algunos de los fenómenos implicados:
- Disfunción plaquetaria, influida por (16):
- Trombopatía urémica, consecuencia del efecto inhibitorio de las toxinas urémicas sobre la función plaquetaria.
- Interacción defectuosa entre el factor de von-Willebrand y los receptores de glicoproteína IIb-IIIa plaquetaria.
- Reducción del contenido plaquetario de adenosín difosfato (ADP).
- Reducción tromboxano A2.
- Anemia: por alteración de la reología sanguínea habitual, pues en condiciones normales los glóbulos rojos fluyen por la zona central de la luz del vaso mientras que las plaquetas viajan por la periferia, y cuando existe anemia el flujo laminar de las plaquetas se interrumpe y esto deteriora aún más su funcionalidad en casos por ejemplo de lesión endovascular. Así, se ha demostrado que un hematocrito bajo se ha asociado con un tiempo de sangrado prolongado, pacientes sometidos a un programa de transfusión de glóbulos rojos mostraron un tiempo de sangrado normalizado una vez que el hematocrito fue > de 26% (9).
- Hipercoagulación: Pese a que el recuento plaquetario es generalmente normal y per sé no hay afectación de los factores de coagulación, existe una tendencia a la hipercoagulación. Los índices tromboelastográficos en pacientes con ERC muestran un estado procoagulante, aumentando incluso la formación inicial de fibrina, y reduciéndose también la fibrinólisis.
Recomendaciones preoperatorias:
- Valorar el riesgo de sangrado por historia de diátesis hemorrágica.
- Valorar la suspensión de antiagregantes y anticoagulantes de forma previa a la cirugía, ajustados a función renal según las guías habituales.
- Profilaxis antitrombótica monitorizando la actividad de la heparina para ajustar dosis a función renal: mediante la medición del tiempo de tromboplastina parcial activado (TTPA) en caso de heparina no fraccionada (HNF) o bien medición de actividad anti-Xa en caso de heparina bajo peso molecular (HBPM), si está disponible en el centro.
4. Afectación Sistema Respiratorio
La ERC en su evolución puede asociar numerosas complicaciones pulmonares, como edema pulmonar, pleuritis fibrosa, calcificaciones pulmonares, etc. Existe una elevada prevalencia de apnea del sueño en estos pacientes. Así, pueden presentar hipoxemia, hipercapnia y fenómenos de alteración de la ventilación-perfusión, normalmente secundarios a sobrecarga de fluidos (16).
Recomendaciones preoperatorias:
– Precaución con la fluidoterapia, tratamiento individualizado.
5. Acidosis metabólica
La acidosis metabólica se debe fundamentalmente a la reducción en la capacidad de eliminación de aniones sulfato, fosfato, ácidos orgánicos y a la no reabsorción de bicarbonato. Se reduce además la síntesis de amoníaco, lo cual se ve agravado por la hiperpotasemia (23). Así, la hiperpotasemia y la acidosis hiperclorémica producen un estado de acidosis metabólica inicialmente sin brecha aniónica (anión gap normal), que puede convertirse en acidosis metabólica con anión gap mixto y elevado cuando el FG desciende a 15 ml/min (5). Este trastorno metabólico se observa con frecuencia al comienzo de la enfermedad pero no suele ser significativo hasta fases avanzadas de la misma (Estadío 4). El pH<7.35 es raro y el tratamiento con bicarbonato de sodio generalmente se sugiere (24) cuando la concentración de bicarbonato sérico cae por debajo de 22 mmol/L.
La acidosis metabólica provoca una reducción de la capacidad para compensar la acidosis respiratoria, y afecta también a la distribución y eficacia de los fármacos, entre otros efectos. Otras anomalías adicionales secundarias a la acidemia, incluyen depresión de la contractilidad miocárdica, gasto cardíaco reducido y flujo sanguíneo renal reducido, así como resistencia a la insulina, disfunción tiroidea, niveles altos de cortisol y reducción del factor de crecimiento insulínico tipo 1 (IGF-1) junto con un mayor recambio de proteínas, lo que conduce a una concentración baja de albúmina sérica (9) (25).
Recomendaciones preoperatorias:
- Mantener equilibrio ácido-base en el preoperatorio, con niveles de bicarbonato entorno a 20 – 22 mmol/L.
- Evitar la hipoventilación y con ello la acidosis respiratoria.
6. Afectación Sistema Nervioso Central:
Los efectos de la ERC a nivel del sistema nervioso central pueden incluir fatiga generalizada, malestar general, falta de concentración, deterioro cognitivo que conduce gradualmente a obnubilación mental, convulsiones, coma y muerte. Los pacientes en hemodiálisis (HD) pueden presentar deshidratación, vómitos e hipotensión y rara vez síndrome de desequilibrio de diálisis, debido a cambios en el volumen de líquido extracelular y edema cerebral posterior (16) (26).
Recomendaciones preoperatorias:
– Valorar posible afectación neurológica, como alteración del nivel de conciencia.
7. Afectación del Sistema Nervioso Autonómico
La neuropatía autonómica es común en pacientes con ERC y puede influir de forma significativa en las variaciones de la presión arterial durante el perioperatorio (9) (27). La disfunción autonómica asociada se caracteriza por una reducción de la sensibilidad de los barorreceptores, una hiperactividad simpática y una disfunción parasimpática, pudiendo predisponer al desarrollo de arritmias perioperatorias.
La disfunción parasimpática da como resultado una reducción en la variabilidad de la frecuencia cardíaca (FC), que lleva de la mano una respuesta disminuida a la atropina. En este sentido, el ECG puede proporcionar evidencia de disautonomia al objetivarse esa variabilidad reducida de la frecuencia cardíaca (variación reducida del intervalo RR), aunque es posible que una simple tira de ritmo no lo detecte con gran sensibilidad.
Recomendaciones preoperatorias:
– Medición del intervalo RR en el ECG.
– Realizar otras pruebas para la evaluación del sistema autonómico como respiración acelerada, maniobra de Valsalva, relación 30:15 o de la respuesta ortostática.
8. Afectación gastrointestinal
La hipersecreción ácida predispone a la aparición de ulcus péptico y hemorragia digestiva. La gastritis erosiva y la duodenitis son comunes en el ERC, pudiendo provocar anorexia, náuseas, vómitos, hemorragia gastrointestinal o diarrea, aumento de la acidez y volumen gástrico, requiriendo el empleo de antiH2 e inhibidores de la bomba de protones.
Además, recordemos el efecto adicional de la neuropatía autonómica, especialmente en los pacientes diabéticos, en el vaciado gástrico (presente en el 69% de los pacientes con ERC, por lo que se debe considerar la profilaxis de broncoaspiración en la premedicación junto a la intubación de secuencia rápida para estos pacientes si se planea anestesia general.
Por otro lado, la ERC se asocia a un aumento de la resistencia a la insulina y a una intolerancia a la glucosa. Las guías de práctica clínica de KDIGO sugieren un objetivo hemoglobina A1c (HbA1c) < 7.0% para prevenir o retrasar progresión de las complicaciones microvasculares de la diabetes asociada a la ERC, salvo en pacientes con riesgo de hipoglucemias o con comorbilidades importantes que reduzcan la expectativa de vida, en los que el objetivo será una HbA1C entre 7,5 % y 8 %.
Por otro lado, el control estricto de la glucemia (81-108 mg/dL) en pacientes críticos con ERC se asocia a mayor riesgo de hipoglucemia y efectos adversos, por lo que el nivel objetivo en este tipo de pacientes se sitúa por debajo de 180 mg/dL.
Recomendaciones preoperatorias:
– Premedicación para profilaxis de broncoaspiración.
– Intubación de secuencia rápida.
-En pacientes críticos no se recomienda un control estricto de la glucemia, estableciéndose objetivos de glucemia <180 mg/dl.
9. Afectación equilibrio/homeostasis del potasio
La concentración plasmática de potasio suele permanecer normal hasta el estadio 5 de la ERC, debido a un aumento compensatorio en la excreción de potasio por nefrona funcionante y a una mayor eliminación en las heces.
No obstante, existe un riesgo incrementado de desarrollar hiperpotasemia en fases iniciales cuando hay una exposición excesiva a potasio exógeno (trasfusiones, ingesta, fármacos con sales de potasio), o cambios de potasio transcelular (como en la hiperglicemia o en la acidosis metabólica).
En este sentido, deben evitarse la acidemia, el déficit de insulina, la hipertonicidad y también el uso de fármacos asociados con hiperpotasemia: betabloqueantes, antiinflamatorios no esteroideos (AINE, incluso los COX-2), espironolactona y otros ahorradores de potasio, digoxina, succinilcolina, tacrolimus, ciclosporina, heparina, etc. Además el tratamiento renoprotector con IECA y ARAII, frena la progresión de la nefropatía, pero produce un incremento en el K+ sérico en general de 0.5 mmol/L (hasta en un 50% entre los pacientes con ERC) (28).
El primer indicador de hiperpotasemia es la presencia de anomalías en el ECG. Los cambios están relacionados con la severidad de la hiperpotasemia y frecuentemente se observan ondas T altas y picudas, intervalo PR prolongado, aplanamiento o ausencia de ondas P, ensanchamiento de QRS (>0.12s), bradicardia, taquicardia ventricular, arritmias, etc. Por otro lado, la aparición de las manifestaciones clínicas depende no sólo de la cifra sino de la rapidez de instauración, son inespecíficas (debilidad, parálisis fláccida, parestesias, depresión respiratoria), y suelen aparecer con cifras de K+ > de 6 mmol/L.
Por otro lado, la hipopotasemia también puede presentarse con frecuencia en pacientes con ERC, generalmente en relación a una retirada excesiva de potasio con la diálisis. Este subgrupo de pacientes normalmente tolera grandes variaciones en la concentración de potasio sérico, por lo que se recomienda consultar con su nefrólogo habitual antes de su corrección (15).
Recomendaciones preoperatorias:
- Buscar cambios en el ECG sugestivos de hiperpotasemia.
- Objetivo preoperatorio < 6 mmol/L, aunque algunos autores recomiendan su tratamiento con cifras < 5.5 mmol/L.
- Elevaciones ligeras de K+ se suelen controlar con modificación de hábitos dietéticos.
- Cuando los niveles de potasio preoperatorio sean > 6 – 6.5 mmol/L se deben administrar sales de calcio, gluconato cálcico o cloruro de calcio, con la finalidad de aumentar el umbral para la generación del potencial de acción en el músculo cardíaco, disminuyendo así su excitabilidad.
- Como segunda opción para disminuir la hiperpotasemia, se podría optar por la administración de bicarbonato sódico.
- Son eficaces las terapias que favorecen la captación intracelular de potasio, como la administración de insulina intravenosa o salbutamol nebulizado. La terapia combinada con ambos fármacos tiene un efecto sinérgico y seguro en pacientes con ERC. En casos de resistencia al tratamiento, se podría optar por realizar una diálisis de emergencia.
- La corrección de emergencia de la hipopotasemia solo es necesaria si está asociada con arritmias cardíacas o cambios en el ECG, como la aparición de ondas T aplanadas o invertidas, ondas U prominentes que aparecen como prolongación del QT, depresión del ST y taquiarritmias tanto auriculares como ventriculares.
10. Afectación homeostasis de fluidos y sodio
Los pacientes con ERC no pierden la capacidad de excretar sal y agua de forma adecuada hasta fases avanzadas de la enfermedad, generalmente cuando la TFG cae por debajo de 10-15 ml/min/1,73 m2 (16). Esta pérdida gradual, se debe a que a pesar de existir un menor número de nefronas funcionantes, las restantes se adaptan con la finalidad de permitir la eliminación de solutos, generando de forma secundaria hipertensión glomerular, hiperfiltración y cambios tubulares (24).
Los trastornos hidroeléctricos o del equilibro ácido-base no aparecen hasta el estadio 4, a pesar de presentar una disminución de la capacidad de respuesta ante una sobrecarga o restricción brusca de sodio ya en estadios iniciales. Así, cuando se somete a estos pacientes a una sobrecarga de soluciones hídricas, podemos conducir de forma secundaria a una sobrecarga de volumen, aumentando su morbimortalidad; y a su vez dando como resultado acidosis metabólica hiperclorémica con hiponatremia relativa, e hiperpotasemia (9).
En muchas ocasiones, el acceso reducido a agua libre en el período perioperatorio, unido a la incapacidad de concentrar la orina, podrán dar lugar a hipernatremia e hipertonicidad.
Por otro lado, el manejo del exceso de volemia puede requerir terapia de reemplazo renal (5). Sin embargo, se debe ser cauteloso con el efecto adverso de la deshidratación, que a menudo se asocia con hipotensión, tinnitus y mareos; y que en ocasiones, puede provocar una disfunción renal residual más grave, la oclusión del acceso arteriovenoso, desarrollo de infarto cerebral o mesentérico, y en consecuencia, un aumento de la morbimortalidad.
Recomendaciones preoperatorias (15) :
- Valorar el grado de hidratación de piel y mucosas, especialmente en aquellos que siguen tratamiento con dieta hiposódica y diuréticos por el riesgo de hipovolemia.
- Conocer la ingesta habitual de líquidos: ya que puede estar restringida y, por lo tanto, se requiere precaución con los líquidos intravenosos perioperatorios.
- Averiguar la producción de orina diaria habitual.
- Conocer el régimen de terapia de reemplazo renal.
- A nivel analítico, conocer la función renal basal y actual con valores de concentración sérica de urea y creatinina, TFG y determinar la concentración de electrolitos en suero: sodio y potasio, especialmente.
11. Afectación de homeostasis del calcio, fosfatos y metabolismo óseo
La hiperfosfatemia es una complicación frecuente, pero relativamente tardía. La ERC afecta tanto a la excreción de iones fosfato como a la activación de vitamina D a nivel renal, por lo que se reduce la absorción de calcio del intestino delgado y se produce una caída inicial en el nivel de calcio en sangre. Dicha hipocalcemia puede provocar laringoespasmos, intervalo QT prolongado y arritmias cardíacas.
Esto conlleva al desarrollo de hiperparatiroidismo secundario, en el que se produce una excreción excesiva de hormona paratiroidea (PTH) para compensar la hipocalcemia, lo que conduce a hipercalcemia e hiperfosfatemia a través de la movilización de calcio y fosfato de la matriz ósea.
Como mecanismo compensatorio, el calcitriol es secretado a nivel renal para suprimir directamente la secreción de PTH. Sin embargo, a medida que la enfermedad progresa hasta el estadio 4, los niveles de calcitriol circulante comienzan a descender, lo que da como resultado una enfermedad ósea descompensada.
Clínicamente, el paciente presenta dolores óseos, deformidades en huesos largos y posteriormente fracturas. Por otro lado, la hipercalcemia conduce a un depósito ectópico de fosfateína de calcio en los vasos sistémicos (calcificación vascular) o tejidos blandos (calcifilaxis).
Recomendaciones preoperatorias:
- Se recomienda mantener niveles de calcio y fósforo en rango normal.
- Valorar manifestaciones clínicas de hipocalcemia (parestesias, confusión,) y en el ECG (prolongación intervalo QT, arritmias).
- Se puede considerar la administración de calcitonina bifosfonato y el cinacalcet para el tratamiento de la hipercalcemia.
- La infusión de sales de calcio es una terapia adecuada para la corrección de la hipocalcemia que puede ir asociada a la hiperpotasemia.
Recomendaciones en pacientes en terapia reemplazo renal
Hemodiálisis intermitente
Se recomienda dializar 24 horas antes de la cirugía con el objetivo de optimizar el nivel de electrolitos y estado de hidratación del paciente, así como reducir los niveles de urea plasmática que pudiera interferir en la función plaquetaria.
Si se realizara el mismo día de la cirugía, aumentaría el riesgo de inestabilidad hemodinámica y alteraciones iónicas como la hipercalcemia, mientras que si se lleva a cabo con demasiada antelación a la cirugía, existiría riesgo de sobrecarga de líquidos, hipercalcemia y acidosis metabólica.
Si fuera necesario dializar el mismo día de la intervención, dado el alto riesgo de sangrado, no se deberá cebar el circuito extracorpóreo con heparina.
Diálisis peritoneal
Se deberá continuar su pauta habitual, con drenaje total del abdomen en el último pase previo a la cirugía.
Y antes del reinicio la misma, deberemos asegurarnos de que la distensión abdominal provocada por el líquido de diálisis en la cavidad abdominal no compromete la expansión pulmonar en pacientes con compromiso ventilatorio, aumentando el riesgo de atelectasias y sobreinfección respiratoria.
En caso de tratarse de una cirugía abdominal se deberá prever la necesidad de hemodiálisis en el postoperatorio, tanto a través de un catéter, como preparando anticipadamente una FAV (Fístula arterio-venosa).
En pacientes con ERC terminal en situación de prediálisis, se deberá valorar su realización el día antes de la cirugía o barajar la necesidad de realizarla en el postoperatorio inmediato.
Consideraciones de los accesos vasculares necesarios en el preoperatorio de pacientes con ERC
Es necesario valorar y planificar los accesos vasculares que se necesitaran en el perioperatorio. En los pacientes con ERC en estadios 3-4, dado el riesgo de progresión de la enfermedad y la posible necesidad de hemodiálisis postoperatoria, se recomienda preservar, en la medida de lo posible, el árbol vascular:
– Canalizar vías venosas periféricas en un solo brazo.
– Si fuera necesario canalizar vía venosa central deberá realizarse en el lado seleccionado para vías periféricas siendo de elección el abordaje yugular y evitando al máximo el subclavio por mayor riesgo de trombosis y estenosis, que puede dificultar o impedir la función de una futura fístula.
– Canalizar acceso arterial sólo si es imprescindible.
En los pacientes portadores de FAV:
– Canalizar vías venosas periféricas y venosa central en el lado contralateral a la FAV.
– Medición de la TA no invasiva en el brazo contralateral o en una pierna.
– Protección y colocación cuidadosa de la extremidad portadora de la FAV, para evitar lesión/compresión accidental.
– Monitorizar el correcto funcionamiento de la FAV (palpación del “Thrill”, vibración por turbulencia).
– Si FAV protésica: administrar profilaxis antibiótica.
En el caso de pacientes dializados a través de catéter debemos recordar que durante la cirugía y en el postoperatorio procuraremos:
– Mantener el catéter tapado en condiciones asépticas y protegido.
– No utilizarlo como acceso venoso salvo en caso de urgencia.
– Si es necesario utilizarlo, deberemos realizar una manipulación aséptica y heparinizar lo al finalizar su uso para no invalidarlo.
Bibliografía
1. Cárdenas VHG, Vargas JG, Echeverri JE et al. Pre-anesthesia evaluation in patients with chronic renal disease (emphasis on cardiovascular risk). Rev. colomb. anestesiol.2013; 41(2):132-13. (HTML)
2. Zhang QL, Rothenbacher D. Prevalence of chronic kidney disease in population-based studies: Systematic review. BMC Public Health. 2008;8:117. (PMC)
3. Otero A, De Francisco A, Gayoso P et al. Prevalence of chronic renal disease in Spain: Results of the EPIRCE study. Nefrologia. 2010;30(1):78-86. (PubMed)
4. Lorenzo V, Enfermedad Renal Crónica. Nefrología al día. [Internet] 2020 [Consultado 14 Nov 2020].Disponible en: https://www.nefrologiaaldia.org/136.
5. Kanda H, Hirasaki Y, Iida T et al. Perioperative Management of Patients With End-Stage Renal Disease. J Cardiothorac Vasc Anesth. 2017;31(6):2251-67. (HTML)
6. Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney Int Suppl. 2013;3:1-150. (HTML)
7. Herrera-Gutiérrez ME, Seller-Pérez G, Banderas-Bravo E et al. Replacement of 24-h creatinine clearance by 2-h creatinine clearance in intensive care unit patients: A single-center study. Intensive Care Med. 2007;33(11):1900–6. (PubMed)
8. Sociedad Española de Nefrología. S.E.N. [Internet]. [Consultado el 2 Nov 2020]. Disponible en: https://www.senefro.org/modules.php?name=webstructure&idwebstructure=26
9. Craig RG, Hunter JM. Recent developments in the perioperative management of adult patients with chronic kidney disease. Br J Anaesth. 2008;101(3):296–310. (PubMed)
10. Gradaus F, Ivens K, Peters AJ et al. Angiographic progression of coronary artery disease in patients with end-stage renal disease. Nephrol Dial Transplant. 2001;16(6):1198–202. (PubMed)
11. Baigent C, Burbury K, Wheeler D. Premature cardiovascular disease in chronic renal failure. Lancet. 2000;356(9224):147–52. (PDF)
12. Lee TH, Marcantonio ER, Mangione CM et al. Derivation and prospective validation of a simple index for prediction of cardiac risk of major noncardiac surgery. Circulation. 1999;100(10):1043–9. (HTML)
13. Manjunath G, Tighiouart H, Ibrahim H et al. Level of kidney function as a risk factor for atherosclerotic cardiovascular outcomes in the community. J Am Coll Cardiol. 2003;41(1):47–55. (HTML)
14. Meersch M, Schmidt C, Zarbock A. Patient with chronic renal failure undergoing surgery. Curr Opin Anaesthesiol. 2016;29(3):413-20. (HTML)
15. Rang ST, West NL, Howard J, et al. Anaesthesia for Chronic Renal Disease and Renal Transplantation. EAU-EBU Updat Ser. 2006;4(6):246–56. (PMC)
16. Karim HMR, Panda CK, Singha SK. Accepting a chronic kidney disease patient for perioperative management: a narrative review of key aspects. Anaesthesia, Pain Intensive Care. 2020;(10):22. (HTML)
17. Glassock RJ, Pecoits-Filho R, Barberato SH. Left ventricular mass in chronic kidney disease and ESRD. Clin J Am Soc Nephrol. 2009;4(1):79–91. (PubMed)
18. Curtis BM, Parfrey PS. Congestive heart failure in chronic kidney disease: Disease-specific mechanisms of systolic and diastolic heart failure and management. Cardiol Clin. 2005;23(3):275–84. (PubMed)
19. Tozawa M, Iseki K, Iseki C, et al. Blood pressure predicts risk of developing end-stage renal disease in men and women. Hypertension. 2003;41(6):1341-5. (PubMed)
20. Fleisher LA, Fleischmann KE, Auerbach AD, et al; American College of Cardiology; American Heart Association. 2014 ACC/AHA guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines. J Am Coll Cardiol. 2014 Dec 9;64(22):e77-137. (PubMed)
21. Kidney Disease: Improving Global Outcomes (KDIGO) Blood Pressure Word Group. KDIGO Clinical Practice Guideline for the Management of Blood Pressure in Chronic Kidney Disease. Kidney Int Suppl. 2012;2:337-414. (HTML)
22. Kidney Disease: Improving Global Outcomes (KDIGO) Anemia Work Group. KDIGO Clinical Practice Guideline for Anemia in Chronic Kidney Disease. Kidney Int Suppl. 2012;2(4):279–335. (HTML)
23. Sierra P, Monsalve C, Comps, et al. Valoración preoperatoria del paciente con Enfermedad renal crónica [Internet]. Secció d’Avaluació Preoperatoria (SAP) de la Societat Catalana d’Anestesiologia, Reanimació i Terapèutica del Dolor. Barcelona. [Citado Nov 2020]. Disponible en: http://www.scartd.org/arxius/erc231006.pdf
24. Gorostidi M, Santamaría R, Alcázar R, et al. Documento de la sociedad española de nefrología sobre las guías KDIGO para la evaluación y el tratamiento de la enfermedad renal crónica. Nefrologia. 2014;34(3):302–16. (PDF)
25. Snively CS, Gutierrez C. Chronic Kidney Disease: Prevention and Treatment of Common Complications. Am Fam Physician. 2004;70(10):1921-8. (PubMed)
26. Rao N, Juneja R. Neurological manifestations of renal disease. Neurol India. 2018;66(1):53–4. (PubMed)
27. Sanya EO, Ogunniyi A. Cardiovascular autonomic neuropathy in non-diabetic Nigerian patients with chronic renal failure. West Afr J Med. 2004;23(1):15-20. (HTML)
28. Casas JP, Chua W, Loukogeorgakis S, et al. Effect of inhibitors of the renin-angiotensin system and other antihypertensive drugs on renal outcomes: Systematic review and meta-analysis. Lancet. 2005;366(9502):2026–33. (PDF)