Gordaliza Pastor C (1), Gutiérrez Bustillo R (1), Sánchez Quirós B (2)
(1) MIR Anestesiología y Reanimación. Hospital Clínico Universitario de Valladolid
(1) FEA Anestesiología y Reanimación. Hospital Clínico Universitario de Valladolid
Cómo citar este artículo: Gordaliza Pastor, C., Gutiérrez Bustillo, R., & Sánchez Quirós, B. (2023). Actualización en el manejo anestésico del paciente pediátrico con infección de vía aérea superior. Revista Electrónica AnestesiaR, 15(11). https://doi.org/10.30445/rear.v15i11.1158
Introducción
Una infección de vía aérea superior (IVAS) se define como una infección de la zona superior de la vía aérea que cursa con dos o más de los siguientes signos o síntomas: rinorrea, estornudos, congestión nasal, tos, odinofagia o fiebre. Estos procesos infecciosos siguen un patrón estacional y los virus son responsables del 95% de las IVAS, siendo el rinovirus el más frecuente (1). A esto se suma la posibilidad de una sobreinfección bacteriana. El anestesiólogo debe tener en cuenta tanto las infecciones en curso de un niño en el momento de ser anestesiado como si ha cursado con una IVAS en las dos semanas previas, puesto que también tiene implicaciones.
Las infecciones respiratorias altas se sitúan dentro de los principales motivos de consulta médica. Un adulto puede presentar de media entre dos a cuatro IVAS en un año. En niños el número de episodios puede aumentar hasta seis a ocho por año y esta incidencia va disminuyendo con la edad (2). Esto hace que cerca de la mitad de los niños que se presentan a una cirugía electiva tengan antecedentes de una IVAS en las seis semanas previas a la cirugía. Por otro lado, entre un 20 y un 40% de los niños tienen una infección respiratoria activa el día de una cirugía electiva (3).
La mayor parte de estas infecciones son leves y autolimitadas, pero está demostrado que aumentan la tasa de complicaciones perioperatorias y que el periodo de aumento del riesgo de eventos adversos anestésicos se puede prologar hasta seis semanas tras la IVAS por una perseverancia de la hiperreactividad en la vía aérea.
En un estudio observacional de Von Ungern-Sternberg et al. publicado en 2010 se analizó una muestra de más de 9297 pacientes y compararon la aparición de eventos adversos respiratorios perioperatorios entre pacientes con infección actual, infección reciente (menos de 2 semanas), infección entre 2-4 semanas antes y niños sin infección. Se concluyó que la tasa de estos eventos era superior en los grupos con infección actual o reciente (25% y 29% respectivamente) que en aquellos sin infección o una infección pasada entre 2-4 semanas antes de la cirugía (12 y 8% respectivamente) (4).
Además de la morbilidad asociada, se produce un incremento significativo en los costes hospitalarios por el aumento de los días de hospitalización y, en consecuencia, un mayor coste por episodio quirúrgico. A esto se suma una problemática familiar de absentismo tanto escolar como laboral.
Material y Métodos
El objetivo principal de esta revisión es identificar aquellos pacientes pediátricos que se presentan a una cirugía electiva con síntomas o signos de una IVAS, lo que supone un riesgo anestésico elevado por la posibilidad de presentar complicaciones respiratorias perioperatorias. Como objetivo secundario, se pretende diseñar un algoritmo que ayude a tomar la decisión de demorar una intervención quirúrgica en estos pacientes. Finalmente, pretende recopilar las mejores estrategias para su manejo anestésico.
Para ello, se ha realizado una revisión de la literatura en octubre de 2022, consultando fuentes primarias en las bases de datos MEDLINE, COCHRANE, EMBASE y UpToDate con los términos de búsqueda «anesthesia» & «child» & «respiratory infection». La búsqueda se realizó en inglés con sus equivalentes en español y estuvo limitada a revisiones sistemáticas con o sin metaanálisis y ensayos clínicos aleatorizados publicados en los últimos diez años. Se encontraron 71 artículos y se desestimaron aquellos que no tuvieran relación con la infección respiratoria superior y anestesia, manuscritos con texto completo no disponible, editoriales, cartas al editor y artículos de revisión narrativa, resultando en una selección final de 22 artículos.
Desarrollo
Fisiopatología
La consecuencia final de una invasión viral del epitelio respiratorio y la mucosa es la inflamación, el edema y la broncoconstricción de las vías respiratorias. Vamos a explicar brevemente la fisiopatología de este proceso.
En primer lugar, la invasión viral del epitelio respiratorio produce una disminución de la actividad β-adrenérgica. Los receptores β-adrenérgicos, regulados por el sistema nervioso autónomo (SNA), están localizados en el músculo liso de las vías respiratorias y en las membranas de las células polimorfonucleares. La estimulación con agonistas b-adrenérgicos relaja el músculo liso de las vías respiratorias, inhibe la liberación de mediadores y disminuye la respuesta inflamatoria. En estos niños estas respuestas de protección de la vía aérea están inhibidas.
Por otra parte, el virus, a través de neuraminidasas, inhibe receptores M2 colinérgicos, con un consecuente aumento en la liberación de acetilcolina y tendencia a la broncoconstricción. La destrucción de la barrera protectora del epitelio aumenta la exposición de las terminaciones nerviosas sensitivas y receptores que se encuentran en la membrana basal, permitiendo la penetración de irritantes o alérgenos y la probabilidad de que se liberen mediadores inflamatorios. Las infecciones víricas, pueden reclutar células inflamatorias como eosinófilos, neutrófilos, basófilos, monocitos, macrófagos, células cebadas, linfocitos T y estimular sus funciones biológicas. Al ser activadas liberan mediadores, citocinas u otros compuestos que incrementan la respuesta inflamatoria. A todo esto, se suma una producción aumentada de IgE específica en estos niños, debido a las infecciones recurrentes que provocan el reclutamiento de mastocitos, que a su vez liberan mediadores específicos que también intervienen en la hiperreactividad bronquial y la broncoconstricción (5). Como consecuencia, hay una fuerte respuesta inflamatoria con incremento de la producción de secreciones, obstrucción de las vías respiratorias y exacerbación del asma preexistente en el caso de los niños asmáticos.
Factores de riesgo
Cuando evaluamos a un niño con IVAS que se presenta a una cirugía electiva, es necesario indagar en la existencia de factores de riesgo que se asocian con mayor frecuencia a eventos adversos respiratorios en el perioperatorio.
Dentro de estos, hay factores propios de los pacientes: edad, prematuridad, antecedentes de hiperreactividad bronquial, asma u otra comorbilidad pulmonar, presencia de signos de infección como una secreción nasal importante, fiebre o tos. También ser fumadores pasivos o el hecho de que los padres o cuidadores reconozcan que ven al niño enfermo.
Hay otros factores de riesgo propios de la cirugía. Las cirugías sobre la vía aérea (broncoscopias, cirugías otorrinolaringológicas), cirugías del macizo facial y cuello (por ejemplo cirugía ocular) y las cirugías con posibles repercusiones sobre la función respiratoria (cirugía abdominal superior o cardiotorácica) se asocian con un mayor riesgo.
Por último, hay factores de riesgo relacionados con el procedimiento anestésico, entre los que destacan el manejo de la vía aérea (mayor riesgo el manejo invasivo mediante un tubo endotraqueal), el tipo de agente anestésico usado en la inducción y el mantenimiento y la experiencia del anestesiólogo que maneja la vía aérea pediátrica (6).
De todos estos, los que aparecen en la Tabla 1 son los que se han seleccionado durante el análisis de los artículos incluidos en esta revisión como los principales determinantes para la aparición de complicaciones en niños con IVAS, siendo la cirugía sobre la VA el principal factor para la aparición de eventos adversos.

Escalas de evaluación: COLDS Score
En 2014 apareció el “COLDS score” (Tabla 2), una escala aplicable durante la evaluación preoperatoria cuyo objetivo es analizar el riesgo de una infección respiratoria y determinar la incidencia general de eventos respiratorios (7). Incluye 5 variables en las que recoge distintos elementos identificados como factores de riesgo para eventos respiratorios perioperatorios. De acuerdo a la gravedad de estas variables se adjudica una puntuación, de cuya suma se obtiene un valor que determina el riesgo de que aparezca un evento adverso respiratorio perioperatorio, así como predecir estancias prolongadas de hospitalización en las unidades de recuperación postanestésica.
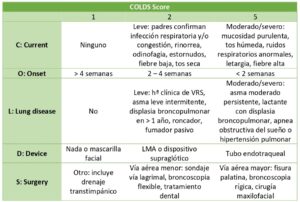
En 2017, esta escala fue implementada y posteriormente validada por la Universidad de California, en particular para pacientes menores de 6 años (8). Se vio que es útil para predecir complicaciones como el broncoespasmo, la desaturación de oxígeno, la necesidad de usar β-agonistas y la tos prolongada, siendo menos útil para predecir el riesgo de laringoespasmo. Así mismo, con su uso se ha podido corroborar que las complicaciones respiratorias son más frecuentes en los pacientes más pequeños, específicamente aquellos entre 0 y 2 años.
Por su simplicidad y facilidad de uso, esta escala podría ayudar a cuantificar el riesgo de presentar una complicación respiratoria, en especial en centros con menos experiencia en anestesia pediátrica, y siempre teniendo en cuenta que no debe usarse de forma exclusiva a la hora de decidir la suspensión de un procedimiento quirúrgico.
Manejo preoperatorio
Por todo esto, nos podemos plantear las siguientes cuestiones: ¿qué hacemos si en el antequirófano nos encontramos con un niño con IVAS? ¿Demorar o proceder? Y si demoramos, ¿cuánto tiempo?. Tradicionalmente, se han suspendido los procedimientos electivos en niños con IVAS, al menos hasta que el niño se encontrase asintomático. Sin embargo, estas decisiones han sido generalmente empíricas, sin tener en cuenta otros elementos. Aunque la suspensión de la cirugía evita la posibilidad de complicaciones, puede acarrear importantes cargas emocionales y económicas a los niños y padres (como períodos de ansiedad y ayuno innecesario, permisos del colegio y los lugares de trabajo, traslado y alojamiento en otra ciudad para los días de la cirugía, etc.). Además, es posible que la suspensión general no siempre sea práctico en el contexto actual de elevada presión asistencial. Por su parte, no hay consenso sobre el tiempo necesario de espera para reprogramar la cirugía, aunque debería basarse en encontrar el equilibrio entre la necesidad de realizar el procedimiento lo antes posible y la disminución del riesgo.
En 2017 Regli A. et al. propusieron en una revisión el siguiente algoritmo de actuación (Figura 1) para el manejo de niños con IVAS que se van a someter a una cirugía electiva (9). Clasificaron a los niños en 3 grupos en función de la gravedad del cuadro clínico que presentasen.
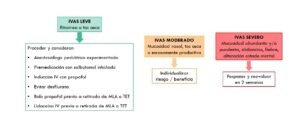
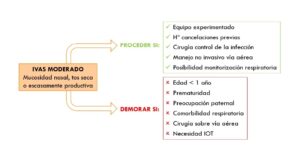

En caso de presentar una IVAS grave, aquella que presente mucosidad abundante o purulenta, sibilancias, fiebre y alteración estado general, recomiendan posponer la cirugía y reevaluar a partir de 2 semanas. En caso de una IVAS leve, definida por rinorrea o tos seca, proponen proceder con la cirugía y considerar los siguientes factores: manejo por parte de un anestesiólogo experimentado, premedicar con salbutamol inhalado, inducción intravenosa con propofol, evitar desflurano y bolo intravenoso de propofol y lidocaína antes de la retirada del dispositivo de la vía aérea, ya sea tubo endotraqueal o mascarilla laríngea. . En caso de IVAS moderadas, definido por mucosidad nasal y tos seca o escasamente productiva, se plantean mayores dudas de manejo. En este último grupo, profundizan más sobre los criterios para proceder o demorar la intervención. Proponen continuar con el procedimiento si se cuenta con un equipo experimentado, si presenta historia de cancelaciones previas, si se trata de una cirugía para conseguir el control de la infección y si se va a realizar un manejo no invasivo de la VA. Por el contrario, indica demorar la intervención si se trata de un paciente de menos de 1 año de edad, prematuro, si existe preocupación importante por parte de los padres sobre la aparición de complicaciones perioperatorias, comorbilidad respiratoria, si se trata de una cirugía sobre la vía aérea o con necesidad de intubación orotraqueal (IOT). Shemesh S. et al., en otro artículo de revisión publicado en 2016 sobre el manejo anestésico en cirugías sobre la vía aérea (VA), concluyen que este tipo de cirugías constituyen un factor de riesgo independiente para la aparición de complicaciones respiratorias perioperatorias. Recomiendan proceder en caso de infecciones leves, ya que el riesgo es menor y en caso de aparecer complicaciones estas serán de fácil manejo. En caso de que exista un riesgo claramente aumentado, y sobre todo si se requiere un manejo invasivo de la VA, recomiendan suspender la intervención (10).
Manejo intraoperatorio
- Premedicación
En primer lugar, debe utilizarse una premedicación adecuada. La ansiolisis juega un papel importante en niños con IVAS, sobre todo cuando existe un nivel de ansiedad alto, para evitar la aparición del llanto que aumenta las secreciones respiratorias y el riesgo de eventos respiratorios.
Clásicamente, el midazolam es el fármaco más empleado. Sin embargo, estudios recientes apoyan más el empleo de agonistas alfa-2 como la clonidina. En este grupo de pacientes con IVAS ha demostrado proporcionar mejor sedación y ansiolisis, mayor analgesia postoperatoria y menor agitación (11).
Otras ventajas respecto al uso de midazolam son las siguientes:
- Atenúa la respuesta estresante frente a la intubación.
- Disminuye los requerimientos de halogenados en el intraoperatorio.
- Produce mínimos cambios hemodinámicos en el niño sano a las dosis adecuadas.
- No produce trastornos respiratorios.
- No tiene efectos cognitivos sobre la memoria.
También podemos emplear otros métodos no farmacológicos para conseguir una mejor ansiolisis en estos niños (12). Las intervenciones que aparecen en la Tabla 3 son algunos ejemplos.

Otro elemento importante en la premedicación de estos niños son los broncodilatadores. Se ha demostrado que la administración de salbutamol inhalado entre 10 y 30 minutos antes de la cirugía reduce la broncoconstricción y los eventos adversos respiratorios perioperatorios (EARP). Las dosis propuestas de salbutamol inhalado son 2,5 mg si pesa menos de 20 kg y 5 mg si pesa más (13).
Una maniobra fundamental en la prevención de EARP, en especial del laringoespasmo, es la disminución del nivel basal de secreciones. No existe suficiente evidencia para recomendar la administración rutinaria de atropina o glucopirrolato en pacientes con IVAS y por tanto su administración debería realizarse a criterio del anestesiólogo (14). Lo que sí ha demostrado eficacia es la aspiración cuidadosa de las secreciones en un plano anestésico profundo, con sondas de aspiración blandas de tamaño acorde al peso del niño (1).
Igualmente, como concluyen Deckx et al. en una revisión sistemática (15), no existe evidencia que apoye el uso de descongestionantes nasales, en concreto de la oximetazolina (agonista alfa-1 y agonista parcial alfa-2) para la optimización preoperatoria de pacientes pediátricos con IVAS que requieren anestesia general. Hayward et al. tampoco encontraron ensayos clínicos que apoyaran el uso de corticosteroides en pacientes con IVAS y recomiendan restringir su uso a pacientes con asma no controlada (16).
2. Inducción y mantenimiento
La elección del agente usado para la inducción y mantenimiento anestésico es un aspecto muy relevante en niños con IVAS. Diversos estudios prospectivos que comparan los agentes anestésicos inhalatorios e intravenosos han demostrado que los gases se asocian a una mayor tasa de eventos adversos respiratorios, mientras que el propofol presenta una menor tasa de complicaciones, tanto en la inducción como en el mantenimiento. Dentro de los gases, por orden de más a menos irritantes, el desfluorano es más irritante que halotano e isofluorano, que a su vez lo son más que el sevofluorano. El sevofluorano ha demostrado una gran superioridad respecto al resto de halogenados por su menor efecto irritante y menor impacto sobre la resistencia de la vía aérea en la inducción. Entre los efectos beneficiosos del propofol se incluye la rapidez de la inducción, la calidad del despertar post anestesia y su reconocido efecto antiemético. Se ha demostrado que también es el que consigue una mayor depresión de los reflejos laríngeos y posee efectos broncodilatadores, similares a los de los anestésicos volátiles. Sin embargo, la limitación que presenta es que requiere la canalización de una vía venosa.
Independientemente del método que empleemos para la inducción, es fundamental que la profundidad anestésica sea la suficiente para abolir los reflejos de la vía aérea en el momento de la intubación.
3. Manejo de la vía aérea
Disponemos de distintas técnicas para el manejo de la vía aérea pediátrica, como la máscara facial, las mascarillas laríngeas (ML) y los tubos endotraqueales (TET), en función de la cirugía propuesta, la duración prevista y las características del paciente, para lograr tanto una ventilación espontánea como asistida.
Como se ha mencionado anteriormente, los niños con IVAS sometidos a una cirugía bajo anestesia general con IOT son los que presentan mayor riesgo de sufrir eventos respiratorios adversos, siendo menor en aquellos en los que se emplea una ML o una máscara facial. Es por ello que la ML supone el método más adecuado para proporcionar una vía aérea segura en estos niños, siempre que se alcance una profundidad anestésica adecuada y cuando el contexto lo permita. Se recomienda además que en caso de emplear IOT se utilicen TET con neumotaponamiento para optimizar la ventilación y minimizar las fugas (9).
En el momento de la educción anestésica, debe retirarse el dispositivo de la vía aérea. Está demostrado que es en este momento en el que se producen más complicaciones respiratorias. Lo que sigue sin estar claro es cuál es el momento óptimo para retirarlo (17). Algunos anestesistas prefieren hacerlo bajo un nivel de anestesia profunda para tener abolidos los reflejos de constricción de la vía aérea, pero otros abogan por hacerlo con el paciente despierto, pensando que el paciente con los reflejos activos está en mejores condiciones para aclarar las secreciones y responder a los estímulos.
Los datos observacionales sugieren que la retirada bajo un nivel profundo reduce la aparición de eventos. Sin embargo, ensayos clínicos aleatorizados recientes muestran resultados contradictorios. Von Ungern-Sternberg comparó la extubación en un nivel de sedación profundo frente a la extubación en paciente despierto en 100 niños sometidos a adenoamigdalectomía. La incidencia global de EARP fue similar entre los dos grupos. La extubación en paciente despierto se asoció con un aumento de la tos (60 frente a 35 %, p = 0,03), mientras que las obstrucciones de las vías respiratorias (solucionadas con maniobras simples en las vías respiratorias como subluxación de la articulación temporo-mandibular y aplicación de presión positiva a través de máscara facial) aumentaron después de la extubación con nivel de sedación profundo (26 frente a 8 %, p = 0,03) (17). En cambio, Baijal et al. no encontraron diferencias en la aparición de EARP comparando la extubación en un nivel de sedación profundo frente a la extubación despierto en 905 niños sometidos a adenoamigdalectomía (18). Al final, la conclusión es que la decisión dependerá de las preferencias y experiencia del anestesiólogo encargado. Por tanto, la recomendación parece ser que al no existir suficiente evidencia que apoye una u otra estrategia de extubación, la decisión deberá basarse en las preferencias y experiencia del anestesiólogo encargado.
A pesar de que el laringoespasmo es una complicación usualmente intraoperatoria, el broncoespasmo, la tos y las desaturaciones pueden ocurrir en el ambiente post-operatorio, por lo que los niños deben mantener al menos una monitorización básica no invasiva durante su estancia en la unidad de recuperación post-anestésica. En esta, debe administrarse oxígeno suplementario y mantenerse una correcta hidratación y analgesia. Los antecedentes de asma, sibilancias recurrentes, infección por virus sincitial respiratorio y las cardiopatías congénitas se consideran factores de riesgo para el desarrollo de EARP post-operatorios.
4. Otros fármacos: Lidocaína
Aunque no existen estudios en niños con IVAS, se ha demostrado que en la población pediátrica el uso de lidocaína intravenosa (IV) a dosis de 1-2 mg/kg, en comparación con placebo o con el no uso de lidocaína, es útil para la prevención del laringoespasmo durante la inducción, el mantenimiento o la extubación (19).
Recientemente, se ha publicado un ensayo clínico de Schebesta K et al en el que se compara el empleo de ML con gel lubricante con y sin lidocaína tanto en niños sanos como en niños con IVAS. Los resultados obtenidos revelaron que en el grupo con IVAS los eventos respiratorios perioperatorios eran menores si se empleaba la ML con gel con lidocaína (20).
No obstante, la lidocaína tópica debe utilizarse de forma adecuada. Por ejemplo, en el estudio prospectivo de Hamilton ND et al. se compararon pacientes pediátricos en los que se realizó una anestesia general con IOT y en los que se empleó lidocaína tópica en 2 modos (spray sobre cuerdas vocales o a ciegas sobre la faringe) frente a otro grupo en el que no se usó la lidocaína. Se observó que la incidencia de desaturación fue mayor con el empleo de lidocaína tópica sin reducir la incidencia de laringoespasmo (21).
Parece, por lo tanto, que sería recomendable emplear lidocaína IV y en gel lubricante sobre ML, pero no lidocaína tópica en spray sobre la vía aérea.
Complicaciones
Todas las medidas expuestas a lo largo de este artículo tienen como objetivo reducir o eliminar la aparición de EARP. Por normal general, cuando aparecen EARP son leves y se resuelven sin secuelas, tal y como muestra el estudio retrospectivo de Kim SY et al. en pacientes con IVAS leve el día de la cirugía. La más frecuente fue la tos persistente y en general se resolvieron sin necesidad de aplicar medicación y sin secuelas (22).
Sin embargo, existen dos entidades especialmente graves, que son el laringoespasmo y el broncoespamo.
a) Laringoespasmo. El laringoespasmo ocurre con mayor frecuencia en la educción (47% de los casos) y con menor frecuencia en la inducción (28%) y mantenimiento (23%). Clínicamente, se caracteriza por una obstrucción de la VA que puede ser parcial (permite escasa entrada de aire a los pulmones) o completa (no permite entrada de aire a los pulmones). Anatómicamente, se produce por el cierre de las cuerdas falsas, la inclinación hacia atrás de los aritenoides y a posterior de la base de la epiglotis, junto con el cierre de las cuerdas vocales verdaderas. En esta figura vemos bien este mecanismo. El diagnóstico de un laringoespasmo es clínico, requiriendo la identificación y manejo tempranos para evitar la progresión a hipoxemia, bradicardia y parada cardiorrespiratoria. Una vez establecido, el tratamiento consiste en los pasos de la Figura 4.
Nunca debemos olvidar pedir ayuda rápidamente durante este proceso. Por otra parte, ante un laringoespasmo perioperatorio, es recomendable dejar al paciente en una unidad de recuperación post-anestésica para observación durante 2 a 3 horas tras el evento. Esto es debido, entre otras cosas, a la posibilidad de aparición de un edema pulmonar “ex vacuo”. La excesiva presión intratorácica negativa causada por la inspiración forzada espontánea contra la glotis cerrada resulta en trasudación de líquido de los capilares pulmonares hacia el espacio alveolo-intersticial. El edema pulmonar resultante puede aparecer en pocos minutos tras la obstrucción de la vía aérea o de forma diferida al cabo de varias horas. Este cuadro clínico es potencialmente grave, pero habitualmente responde bien al tratamiento con oxigenoterapia, ventilación mecánica a presión positiva y diuréticos.
b) Broncoespasmo. El broncoespasmo puede definirse por una condición patológica caracterizada por una respuesta broncoconstrictora exagerada frente a estímulos diversos. Es causado por liberación de histamina y mediado por el nervio vago. Entre los estímulos que lo pueden provocar están el aire frío, los agentes inhalados irritantes y la instrumentación de la vía aérea (presencia de un TET, fibrobroncoscopio, cuerpo extraño, etc). Usualmente se desencadena por alguna maniobra sobre la vía aérea de pacientes con antecedentes de enfermedad respiratoria previa como asma. Clínicamente, se puede manifestar por sibilancias o ausencia de ruidos pulmonares y desaturación. Puede aparecer como una entidad única o asociado a anafilaxia. Los parámetros observados en el respirador incluyen un rápido ascenso de la presión inspiratoria máxima, un lento ascenso en la curva de capnografía y una disminución del volumen pulmonar espiratorio. Su manejo terapéutico se resume en la Figura 5. Igual que para el laringoespasmo, es fundamental pedir ayudar de forma precoz y tras la resolución del episodio se debe considerar la necesidad de ingreso en una unidad de cuidados intensivos.
Prevención
Podría ser interesante encontrar mecanismos preventivos de estos procesos en niños con IVAS recurrentes. Se ha señalado que una combinación de probióticos y vitamina D puede ser interesante para prevenir estos procesos. Los probióticos se definen como microorganismos vivos que cuando se administran en cantidades adecuadas confieren un beneficio al huésped. Recientemente se ha publicado un metaanálisis de Quick M. en la Biblioteca Cochrane que defiende el uso de probióticos en esta subpoblación de niños con IVAS recurrentes. En él, los autores concluyen que el uso de probióticos disminuye el número de IVAS anual, la duración del proceso infeccioso y la duración del tratamiento antibiótico (23).
Conclusiones
Las IVAS suponen un mayor riesgo de complicaciones respiratorias perioperatorias. La incidencia de esta patología en niños es muy alta, por lo que encontrar el momento óptimo para realizar una cirugía electiva es complejo. La decisión de demorar o no una cirugía programada en niños con IVAS debe basarse en la situación clínica del paciente, los factores de riesgo que presente y la experiencia del personal.
En general, las complicaciones respiratorias postquirúrgicas en niños con IVAS se resuelven sin secuelas. Sin embargo, existen escenarios especiales como la cirugía otorrinolaringológica, que suele requerir IOT, y que suele ser necesaria para solucionar el problema infeccioso en niños con IVAS recidivantes.
En caso de una IVAS se han de tomar precauciones especiales para minimizar al máximo el riesgo de complicaciones. Debe evitarse el uso de benzodiacepinas en la premedicación, priorizando el uso de fármacos como la clonidina. Además, emplearemos salbutamol inhalado previo a la inducción. Se recomienda realizar tanto la inducción como el mantenimiento con propofol ya que ha demostrado presentar un mejor perfil de seguridad en estos niños. En caso se emplear gases halogenados, el sevofluorano es el de elección, estando prácticamente contraindicado el uso de desfluorano. Como peculiaridad, en el broncoespasmo los gases son de primera elección, pero no en el laringoespasmo. La lidocaína es un buen fármaco para el manejo intraoperatorio de estos pacientes, usada tanto de forma intravenosa como en el gel lubricante aplicado sobre la ML.
Si es posible, se controlará la vía aérea con dispositivos supraglóticos. Para el manejo de secreciones, la aspiración cuidadosa de secreciones en un plano anestésico profundo ha demostrado superioridad frente al empleo de fármacos antimuscarínicos. La extubación se realizará según el criterio del anestesiólogo responsable, bien en un plano anestésico profundo o en el paciente despierto.
Por último, es primordial disponer de un equipo experimentado en anestesia pediátrica para el manejo de estos pacientes de alto riesgo.
Bibliografía
- Tait AR, Malviya S. Anesthesia for the child with an upper respiratory tract infection: still a dilemma?. Anesth Analg. 2005;100(1):59-65. doi:10.1213/01.ANE.0000139653.53618.91 (PubMed)
- Bramley TJ, Lerner D, Sames M. Productivity losses related to the common cold. J Occup Environ Med. 2002 Sep;44(9):822–9. https://doi.org/10.1097/00043764-200209000-00004 PMID:12227674 (PubMed)
- Monto AS, Ullman BM. Acute respiratory illness in an American community. The Tecumseh study. JAMA. 1974 Jan;227(2):164– 9. https://doi.org/10.1001/jama.1974.03230150016004 PMID:4357298 (PubMed)
- Von Ungern-Sternberg BS, Boda K, Chambers NA, Rebmann C, Johnson C, D Sly P, Habre W. Risk assessment for respiratory complications in paediatric anaesthesia: a prospective cohort study. Lancet. 2010;376(9743):773-783. doi:10.1016/S0140-6736(10)61193-2 (PubMed)
- Rosete ODP, Archundia SFJ, Cabello GC, Manjarrez ZME. Patogenia de las infecciones respiratorias por virus. Rev Inst Nal Enf Resp Mex. 2002;15(4):239-254. (HTML)
- Mamie C, Habre W, Delhumeau C, Argiroffo CB, Morabia A. Incidence and risk factors of perioperative respiratory adverse events in children undergoing elective surgery. Pediatr Anesth. 2004;14:218-224. (PubMed)
- Lee B.J., August D.A. COLDS: A heuristic preanesthetic risk score for children with upper respiratory tract infection. Paediatr. Anaesth. 2014;24:349–350. doi: 10.1111/pan.12337 (PubMed)
- Lee L.K., Bernardo M.K.L., Grogan T.R., Elashoff D.A., Ren W.H.P. Perioperative respiratory adverse event risk assessment in children with upper respiratory tract infection: Validation of the COLDS score. Paediatr. Anaesth. 2018;28:1007–1014. doi: 10.1111/pan.13491. (PubMed)
- Regli A., Becke K., von Ungern-Sternberg B.S. An update on the perioperative management of children with upper respiratory tract infections. Curr. Opin. Anaesthesiol. 2017;30:362–367. doi: 10.1097/ACO.0000000000000460. (PubMed)
- Shemesh S, Tamir S, Goldfarb A, Ezri T, Roth Y. To proceed or not to proceed: ENT surgery in paediatric patients with acute upper respiratory tract infection. J Laryngol Otol. 2016;130(9):800-804. doi:10.1017/S0022215116008549 (PubMed)
- Rosenbaum A, Kain ZN, Larsson P, Lönnqvist PA, Wolf AR. The place of premedication in pediatric practice. Paediatr Anaesth. 2009;19(9):817-828. doi:10.1111/j.1460-9592.2009.03114.x (PubMed)
- Yip P, Middleton P, Cyna AM, Carlyle AV. Non-pharmacological interventions for assisting the induction of anaesthesia in children. Cochrane Database Syst Rev. 2009;(3):CD006447. Published 2009 Jul 8. doi:10.1002/14651858.CD006447.pub2 (PubMed)
- von Ungern-Sternberg BS, Habre W, Erb TO, Heaney M. Salbutamol premedication in children with a recent respiratory tract infection. Paediatr Anaesth. 2009;19(11):1064-1069. doi:10.1111/j.1460-9592.2009.03130.x (HTML)
- Tait AR, Burke C, Voepel-Lewis T, Chiravuri D, Wagner D, Malviya S. Glycopyrrolate does not reduce the incidence of perioperative adverse events in children with upper respiratory tract infections. Anesth Analg. 2007;104(2):265-270. doi:10.1213/01.ane.0000243333.96141.40 (PubMed)
- Deckx L, De Sutter AI, Guo L, Mir NA, van Driel ML. Nasal decongestants in monotherapy for the common cold. Cochrane Database Syst Rev. 2016;10(10):CD009612. Published 2016 Oct 17. doi:10.1002/14651858.CD009612.pub2 (PubMed)
- Hayward G, Thompson MJ, Perera R, Del Mar CB, Glasziou PP, Heneghan CJ. Corticosteroids for the common cold. Cochrane Database Syst Rev. 2015;2015(10):CD008116. Published 2015 Oct 13. doi:10.1002/14651858.CD008116.pub3 (PubMed)
- von Ungern-Sternberg BS, Davies K, Hegarty M, Erb TO, Habre W. The effect of deep vs. awake extubation on respiratory complications in high-risk children undergoing adenotonsillectomy: a randomised controlled trial. Eur J Anaesthesiol. 2013;30(9):529-536. doi:10.1097/EJA.0b013e32835df608 (PubMed)
- Baijal RG, Bidani SA, Minard CG, Watcha MF. Perioperative respiratory complications following awake and deep extubation in children undergoing adenotonsillectomy. Paediatr Anaesth. 2015;25(4):392-399. doi:10.1111/pan.12561 (PubMed)
- Mihara T, Uchimoto K, Morita S, Goto T. The efficacy of lidocaine to prevent laryngospasm in children: a systematic review and meta-analysis. Anaesthesia. 2014;69(12):1388-96. http://doi.org/f6p46v (PubMed)
- Schebesta K, Güloglu E, Chiari A, Mayer N, Kimberger O. Topical lidocaine reduces the risk of perioperative airway complications in children with upper respiratory tract infections. Can J Anaesth. 2010;57(8):745-750. doi:10.1007/s12630-010-9328-y (PubMed)
- Hamilton ND, Hegarty M, Calder A, Erb TO, von Ungern-Sternberg BS. Does topical lidocaine before tracheal intubation attenuate airway responses in children? An observational audit. Paediatr Anaesth. 2012;22(4):345-350. doi:10.1111/j.1460-9592.2011.03772.x (HTML)
- Kim SY, Kim JM, Lee JH, Kang YR, Jeong SH, Koo BN. Perioperative respiratory adverse events in children with active upper respiratory tract infection who received general anesthesia through an orotracheal tube and inhalation agents. Korean J Anesthesiol. 2013;65(2):136-141. doi:10.4097/kjae.2013.65.2.136 (HTML)
- Quick M. Cochrane Commentary: Probiotics For Prevention of Acute Upper Respiratory Infection. Explore (NY). 2015;11(5):418-420. doi:10.1016/j.explore.2015.07.012 (PubMed)