 José Luis Aguilar, María Sanabra, Nicolás García
José Luis Aguilar, María Sanabra, Nicolás García
Cómo citar este artículo: Aguilar, J. L., Sanabra, M., & García, N. (2011). Anestesia Epidural Torácica. Revista Electrónica AnestesiaR, 3(6), 1. https://doi.org/10.30445/rear.v3i6.448
Introducción: perspectiva histórica
La anestesia epidural es una técnica ampliamente usada en Anestesiología. El primero de los abordajes que se aprende de esta técnica es a nivel lumbar. La colocación de un catéter epidural a nivel torácico alto, ha sido descrita hace tiempo para su uso en cirugía torácica (1).
Dos razones importantes hacen que el anestesiólogo sea reacio al uso del abordaje torácico de la anestesia epidural: Una, las dificultades técnicas de la inserción y colocación de un catéter epidural y, en segundo lugar, el miedo a lesionar la medula espinal. El motivo de esta revisión acerca de la anestesia epidural torácica es aumentar el conocimiento y las ventajas de su uso.
Vascocellos (2) describió el uso de la anestesia epidural (presumiblemente torácica) para la cirugía torácica, y posteriormente en 1948, Fujikawa et al. (3) publicaron los resultados de las 100 primeras anestesias epidurales torácicas (AET) realizadas para cirugía torácica en el Missouri State Tuberculosis Sanatorium. En 1951 el equipo de Crawford, ya mencionado (1), amplió el trabajo de Fujikawa con mas 677 epidurales torácicas, realizadas en cirugía torácica con pacientes despiertos y en ventilación espontánea. Describieron excelentes condiciones quirúrgicas sin los problemas propios de respiración paradójica ni bamboleo mediastínico propio en un tórax abierto en ventilación espontánea. Se añadió anestesia con óxido nitroso a tan solo el 5% de los pacientes estudiados y la única complicación intraoperatoria que se observó fue tos paroxística ocasional en algunos pacientes al ligar los segmentos bronquiales. El éxito de este abordaje anestésico en este tipo de cirugía se consigue con una muy buena comunicación con el paciente, buena colaboración por parte del mismo, así como un gran conocimiento de la técnica quirúrgica por parte del cirujano.
John bonica (4) describe su experiencia con más de 1000 pacientes usando un abordaje paramedial, de mayor utilidad en la anestesia epidural torácica donde la angulación de las apófisis espinosas es más pronunciada y por tanto dificulta la técnica medial.
Consideraciones anatómicas: puntos de referencia
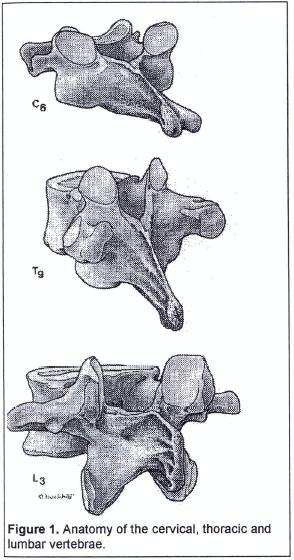
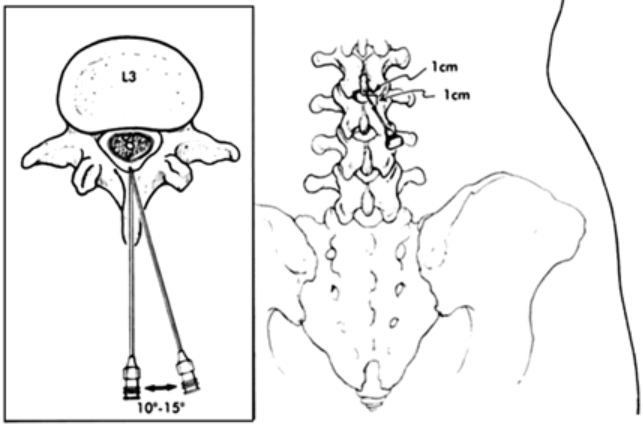
A nivel torácico medio, entre T2-T9, el espacio entre apófisis espinosas es mas estrecho, están más cerca entre sí y su angulación se hace repentinamente mas pronunciada, siendo casi verticales, dificultando por eso la localización del espacio intervertebral y por tanto del ligamento interespinoso (5). Las apófisis espinosas a nivel cervical C1-T2 son casi totalmente horizontales, mientras que a nivel torácico bajo T10-T12 tienen una ligera inclinación caudal (Fig. 1 y 2). A nivel torácico medio, el borde inferior de la apófisis espinosa se encuentra justo encima de la lámina de la vértebra subyacente. Independientemente del abordaje, sea medial o paramedial, el espacio epidural es mas estrecho (3-5 mm) a nivel torácico que a nivel lumbar (5-6 mm). La incidencia de punción dural es menor en el abordaje torácico que en el lumbar, dado que la angulación de la aguja a nivel torácico es de unos 45º y esto hace que la distancia para llegar al espacio epidural sea mayor (5).
Los medios de contraste radiológicos, los anestésicos locales, y otros fármacos inyectados en el espacio epidural potencialmente se distribuyen como sigue:
- La extensión superior e inferior del agente se realiza mayoritariamente en el segmento posterior del espacio epidural, entre la dura y el ligamento amarillo.
- Cranealmente, hacia el foramen magnum.
- Caudalmente, hacia el hiato sacro, el canal caudal, y hacia el foramen sacro anterior.
- Lateralmente hacia los agujeros intervertebrales hacia el espacio paravertebral, produciendo bloqueo paravertebral. Destacando un posible acceso al LCR a través de la duramadre, provocando bloqueo motor y una posible lesión medular (5).
- Anteriormente, en el espacio epidural, entre la duramadre y el ligamento longitudinal anterior.
- Reabsorción intravascular a través del plexo venoso epidural, produciendo toxicidad cardiaca y/o cerebral.
- La abundante grasa epidural puede producir migración cefálica de los fármacos. La medula espinal termina en el borde inferior de L1, y el saco dural termina en S2 en los adultos (S3 en los niños).
Consideraciones técnicas
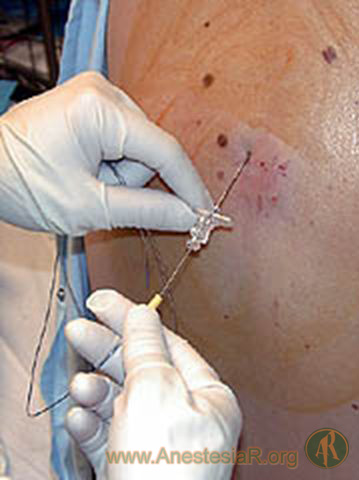
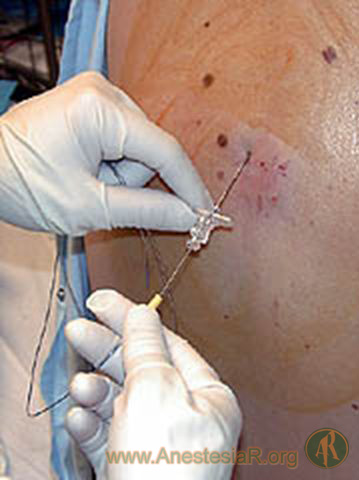
Las preferencias personales, así como la experiencia propia en el abordaje lumbar epidural, influyen directamente en la técnica empleada para el abordaje torácico. Las agujas con punta roma y curva de Hustead o de Tuohy son las de elección para minimizar el riesgo de lesión medular o punción dural en la región torácica. La técnica de perdida de resistencia usando una jeringa con aire o suero fisiológico es la más usada para localizar el espacio epidural. La aguja con aletas es preferible para la detección del espacio epidural en la técnica de gota colgante. A nivel torácico, el mayor determinante de presión negativa es la transmisión de la presión respiratoria negativa del tórax a través del espacio paravertebral y de los agujeros intervertebrales hasta el especio epidural. Existe una comunicación directa entre los espacios paravertebrales adyacentes y contralaterales a nivel del espacio epidural. La presión media intrapleural es de ““7 cm H2O (-5 ““10 cm H2O). Los mismos efectos se obtienen a nivel cervical, excepto que para conseguir una máxima presión negativa el paciente debe estar en sedestación. Una vez pasado el ligamento amarillo la gota de suero salino colocada en la aguja de epidural es absorbida por la presión negativa. Sin embargo, en los pacientes con enfermedad pulmonar grave esta presión negativa puede haber desaparecido completamente.
Para la localización del espacio, el paciente debe estar en posición sentada, con la cabeza flexionada y las piernas flexionadas, preferiblemente colocadas en una silla (9). Siempre debemos tener un ayudante para la sujeción del paciente. Los brazos irán recogidos en el regazo. La elección del espacio a puncionar debe ser el centro del área que queremos bloquear. Puntos de referencia: C7 = la apófisis espinosa más prominente palpable debajo de la base del cuello; T3 = espina de la escápula o a nivel del acromion; y T7 = borde inferior de la escápula.
Abordaje Medial (Dawkins & Steel, 1971) (6)
En este abordaje se accede al espacio epidural con la inserción de la aguja en ángulo recto entre dos espacios intervertebrales por el borde inferior de la apófisis espinosa superior. Se progresa la aguja lentamente hasta encontrase con el borde superior de la apófisis espinosa inferior y se redirige la aguja en sentido paralelo a la apófisis espinosa. Resiguiendo la apófisis espinosa se llegara al ligamento amarillo.
Abordajes medial y paramedial (PACS)
Abordaje Paramedial o lateral (Simpson et al, 1961) (7)
Se usan las mismas referencias óseas que en el abordaje medial, pero la inserción de la aguja se encuentra 1.5-2 cm lateral. Se entra en un ángulo recto con la piel hasta encontrar la lámina. En este momento nos encontramos a la misma profundidad que el ligamento amarillo, por lo que se redirigir la aguja 10º craneal y 10º medial y se avanza la aguja hasta encontrar la perdida de resistencia. Si durante esta maniobra nos encontramos hueso, redirigimos la aguja hasta poder progresar de nuevo hasta el ligamento amarillo.
Evaluación del bloqueo
Para los bloqueos torácicos altos T1-T2, la evaluación de perdida de sensibilidad por encima de las areolas mamarias no es muy útil, dado que la innervación a este nivel es doble y viene dada por las raíces C3-C4 y por T1-T2. Así la persistencia de la sensación termoalgésica a este nivel no predice la eficacia de nuestro bloqueo. Por lo que se evaluará la eficacia determinando la perdida de sensibilidad en la cara medial del antebrazo (T1) y cara medial del brazo (T2). La instauración de bloqueo motor a T1 se puede evaluar pidiéndole al paciente que sujete una hoja de papel entre los dedos (interóseos C8, T1). En un paciente con anestesia superficial, la evaluación de los reflejos nos puede ser útil: epigástrico (T7-T8); abdominal (T9-T12); cremastérico (L1-L2); plantar (S1-S2); reflejo rotuliano o patelar (L2-L4); reflejo aquíleo (S1-S2).
Consideraciones fisiológicas
Cardiovasculares y hemodinámicas:
El efecto de la anestesia epidural torácica viene dado por el efecto de los anestésicos locales a este nivel. Se produce un bloqueo simpático de las fibras cardiacas procedentes de las raíces ventrales entre T1-T5, así como potencialmente se bloquea el sistema medular adrenérgico por acción a nivel de las raíces T6-L1. Estos efectos pueden variar en función de:
- Uso concomitante de anestesia general.
- Grado preexistente de actividad simpática.
- Volemia intravascular.
- Tipo y dosis de anestésico local.
- Extensión de bloqueo sensitivo y grado de simpatectomía/vasoplegia.
En humanos hay hallazgos consistentes que muestran un descenso de la frecuencia cardiaca (FC), de la presión arterial (PA), y del gasto cardiaco (CO) (8). Los mismos efectos aparecen a pesar de una presión de oclusión pulmonar constante con aporte de coloide (10). El trabajo del ventrículo izquierdo también disminuye después de una AET. Todos estos cambios se pueden ver agravados en pacientes con un nivel basal simpático previo ya aumentado (ansiedad o sin premedicación) o en pacientes hipovolémicos. El tratamiento de la hipovolemia se basa en el aporte de volumen con cristaloides o coloide (excepto en las neumonectomías) y pequeñas dosis crecientes de efedrina (5 mg).
Circulación coronaria:
La AET reduce los cambios isquémicos del segmento ST y disminuye el consumo de O2 miocárdico (MVO2), primeramente por el descenso de la FC, PAM y contractilidad cardíacas, en modelos animales. Así mismo, el flujo endocárdico se ve aumentado observándose una disminución del tamaño del infarto y de los eventos arritmogénicos (11). Blomberg observó una mejoría en el dolor torácico en los pacientes con angina inestable, así como una reducción en los eventos isquémicos del segmento ST inducidos por el ejercicio (12-13). Las fibras simpáticas cardiacas (T1-T6) están bloqueadas, y en 8/28 pacientes se observó una disminución de la depresión del ST inducida por el ejercicio. El efecto beneficioso de la AET a nivel miocárdico es la mejoría de la relación aporte / demanda de oxígeno, así como su efecto analgésico (14). Una vasodilatación coronaria y un aumento del diámetro de las arterias epicárdicas estenóticas, ha sido observado por el equipo de Blomberg (15). En resumen, existe evidencia de:
- Disminución electrocardiográfica, ecocardiográfica y angiográfica de isquemia miocárdica después de la AET, sin robo coronario.
- Mejoría de la disfunción ventricular de etiología isquémica.
- Disminución de la incidencia de arritmias.
- Alivio del dolor torácico isquémico.
Efectos respiratorios:
Los efectos respiratorios de la AET son: reducción modesta de la capacidad vital (CV) y del volumen forzado expirado en el primer segundo (FEV1) con bloqueos epidurales torácicos altos T1-T6; reducción de la capacidad pulmonar total (CPT) y la velocidad de flujo medio-espiratorio máximo (MMF) (16). La velocidad de flujo medio-espiratorio (MEF25-75) también decrece. El pico de flujo espiratorio (PEFR) suele estar aumentado en ambos pacientes, sanos y con patología pulmonar de base, siempre y cuando los músculos abdominales no se encuentren bloqueados. Los bloqueos de T12 o superiores disminuyen la capacidad de toser de manera eficaz, especialmente en los pacientes con enfermedad pulmonar obstructiva crónica. Los efectos procedentes de un bloqueo cervical C4-C7 son mayores que en los bloqueos torácicos T5-L4 (16) en lo que concierne el bloqueo del nervio frénico y denervación diafragmática. Por esta misma razón, se recomienda la ultilización de bloqueos epidurales hasta niveles de T5 o inferior. La cirugía del abdomen superior provoca disfunciones diafragmáticas responsables de la disminución de los volúmenes pulmonares (17). La AET previene y revierte esta complicación, ejerciendo un efecto beneficioso en la función diafragmática y la función ventilatoria postoperatorias, independientemente de su acción analgésica. El verdadero papel de la AET en la vasoconstricción hipóxica pulmonar está todavía por dilucidar. La AET disminuye la incidencia de broncoespasmo en pacientes asmáticos, mayoritariamente por prescindir de una anestesia general, más que por el efecto directo de la AET (la incidencia de broncoespasmo después de anestesia epidural fue de 2.9% mientras que después de una anestesia general fue de 5.6% (18)).
Efectos gastrointestinales:
Los efectos de AET entre T1 y L1 incluyen: bloqueo simpático del territorio esplácnico (T6-L1), con aumento del volumen sanguíneo a nivel intestinal; disminución del flujo arterial mesentérico; disminución del flujo portal y del flujo hepático total. Se observa una contracción del intestino grueso secundario a un aumento del tono vagal a este nivel. La AET con anestésicos locales no parece producir un retraso del vaciado gástrico. El uso de morfina en vez de anestésicos locales evita este efecto. La incidencia global de íleo posoperatorio disminuye (19).
Efectos neurohumorales:
La AET hasta L1 interfiere con la estimulación simpática eferente de la medula suprarrenal y también inhibe los impulsos negativos aferentes viscerales que activarían la producción de catecolaminas a nivel de la medula suprarrenal (9). La AET disminuye la respuesta hiperglicémica al estrés quirúrgico y controla el nivel de cortisol, secundario a una amortiguación de la respuesta al estrés. Sin embargo, la AET en cirugía abdominal y torácica es menos eficaz en la reducción de la respuesta al estrés que en la cirugía de la extremidades.
Indicaciones
La anestesia epidural torácica su usa como complemento a la anestesia general (anestesia combinada) o para la analgesia postoperatoria. Otras indicaciones incluyen el tratamiento del dolor crónico o como técnica única para algún proceso quirúrgico especifico. Los fármacos que se usan para esta técnica son los anestésicos locales, los opioides, y la combinación de a2-agonistas con NMDA-antagonistas (ketamina).
La anestesia epidural torácica como técnica de“ analgesia preventiva ““ pre-emptive“ en la analgesia de la cirugía torácica sigue siendo controvertida (20-21). La AET se emplea en las diversas cirugías torácicas: resección pulmonar, resección de la vía aérea, trasplante pulmonar, pleurectomías y reconstrucciones de pared torácica, cirugía de esófago con abordaje toraco-abdominal, resección de aneurisma de la aorta descendente a nivel torácico, y la implantación de un desfibrilador autoimplantable (9). Como técnica única se ha usado para las reconstrucciones mamarias (22). La combinación de un anestésico local a bajas concentraciones con un opioide produce menos hipotensión intraoperatoria que si se usa exclusivamente lidocaína 2% o bupivacaína 0“™5% (9). Esto tiene particular interés en las resecciones pulmonares donde la restricción hídrica es importante. A pesar de una analgesia epidural torácica adecuada, muchos pacientes siguen presentando dolor en el hombro ipsilateral como causa de un dolor visceral referido (23) o como consecuencia de una retracción escapular prolongada asociada a la posición intraoperatoria.
El dolor postoracotomía es un dolor muy intenso que produce alteraciones muy importantes en la función ventilatoria. La analgesia epidural lumbar o torácica con opioides resulta eficaz para mitigar estas complicaciones (24-25).
Algunos estudios han comparado la eficacia de una analgesia intravenosa con opioides, sea con bombas de infusión continua como a demanda, con la analgesia epidural torácica para procedimientos torácicos. El uso de fentanilo (26) y sufentanilo por vía epidural ha demostrado mayor control analgésico posoperatorio. A pesar de ello, persiste la controversia si dicho efecto viene dado por la acción a nivel sistémico o por la acción pura a nivel epidural (46-50).
Como se demuestra en el estudio de Salomí¤ki, a nivel epidural las dosis requeridas para analgesia de fentanilo son menores que la dosis requerida del mismo a nivel intravenoso (46).
En relación con la posición del extremo del catéter epidural en el espacio epidural, todavía no existen recomendaciones firmes. Dada la lipofília del fentanilo, se considera que la administración de dicho fármaco a nivel lumbar no difunde adecuadamente por el espacio epidural y por lo tanto no alcanzaría el nivel torácico pertinente (9). Se ha demostrado en los pacientes con analgesia epidural torácica con fentanilo comparado con la analgesia epidural lumbar, una disminución de la estancia hospitalaria, así como una mejor capacidad pulmonar en las pruebas funcionales, a pesar de presentar, ambos grupos, escalas de dolor equivalentes (28). Otras investigaciones han demostrado superior control analgésico y menor dosis de opioides con la analgesia epidural torácica (29). Sin embargo, algunos autores, no han demostrado diferencia significativa entre la analgesia epidural lumbar y torácica para intervenciones de cirugía torácica, aun y usando el sufentanilo (30). El uso de opioides hidrofílicos como la hidromorfona o la morfina tienen el riesgo de la depresión respiratoria por la migración del mismo a través del LCR (31). En cambio, la aplicación de dichos opioides a nivel lumbar tienen la misma eficacia que aplicados a nivel torácico.
Se ha demostrado una mejoría de las pruebas funcionales respiratorias con la analgesia epidural torácica con fentanilo, comparado con la analgesia epidural lumbar y la intravenosa con fentanilo (28).
Existe todavía algún dilema sin resolver en relación al uso de anestésicos locales a bajas dosis y los opioides epidurales. La bupivacaína es el anestésico de elección por la larga duración de acción y una buena analgesia sensitiva. Por el contrario, a dosis más altas produce hipotensión y bloqueo motor. A dosis muy bajas, como 0“™125% o menores, a menudo la analgesia no es suficiente para el control del dolor postoracotomía. Así, las ventajas de la combinación de anestésicos locales con opioides son:
- Efecto sinérgico.
- Retraso de la tolerancia a cada uno de los fármacos, cuando se usa en perfusión continua (9,32).
- Disminución de los efectos secundarios de cada uno de los fármacos.
La combinación de bupivacaína-morfina para la analgesia epidural torácica ha demostrado mayor eficacia del control del dolor que cada uno por separado. Cuando comparamos distintas perfusiones analgésicas en la epidural torácica vemos que entre bupivacaína 0“™125%, sufentanilo (4-8 mg/h), o la combinación de ambas, esta ultima es la que demuestra mayor eficacia. Y el uso de bupivacaína 0“™125% sola la que menos efecto tiene, por no aportar una analgesia suficiente (33).
Estos beneficios también se adaptan a otro tipo de cirugías, como la cirugía cardiaca. La AET se ha usado en estos pacientes con perfusiones continuas de morfina para el bypass coronario permitiendo una extubación mas temprana y una analgesia superior comparado con la administración intravenosa (33). El uso concomitante de bupivacaina-sufentanilo epidural en la cirugía cardiaca confiere una estabilidad hemodinámica intra y posoperatoria superior, permite una extubación mas temprana y disminuye la incidencia de isquemia miocárdica (34-36).
A pesar del uso de heparina y de la disfunción plaquetar en la cirugía cardiaca, no se han descrito hematomas epidurales por dicha causa. En todos los pacientes, la colocación de un catéter epidural se ha establecido antes de la anticoagulación eficaz total, y se ha retirado varios días después de la reversión del efecto de la heparina. La retirada del catéter epidural cuando el paciente persiste anticoagulado incrementa el riesgo de hematoma epidural (37). El uso de la anestesia epidural torácica en la cirugía abdominal alta ofrece una buena analgesia y mejora la función pulmonar intra y postoperatoria. Lo mismo ocurre en la cirugía de aorta abdominal (27). Algunos procedimientos quirúrgicos que se han beneficiado de una AET son la timectomía transesternal (miastenia gravis) y la reseccion del feocromocitoma (9).
Anestesia epidural torácica y técnicas de alivio del dolor
Vías del dolor a nivel torácico:
Existen 4 vías del dolor bien establecidas. Vías aferentes, incluyendo las vías nociceptivas, del pulmón y del árbol traqueobronquial superior a través del plexo pulmonar hasta el nervio vago. El sistema nervioso simpático a través de los ganglios torácicos, sin embargo, se consideran como vía reconocida del dolor de origen cardiaco. Las vías aferentes nociceptivas del esófago también son vehiculizadas a través del nervio vago. El nervio frénico inerva el pericardio fibroso, la pleura que yace encima de las cúpulas diafragmáticas, la pleura parietal mediastínica y el área central del diafragma. Los márgenes diafragmáticos, la mayor parte de la pleura parietal, las estructuras de la pared torácica como la piel, músculos y huesos son subsidiarios de los nervios intercostales.
En la práctica anestésica, las únicas vías aferentes en las que podemos aplicar técnicas analgésicas (bloqueos nerviosos) son las que se vehiculizan por los nervios intercostales. Estas vías pueden ser interrumpidas periféricamente, a través de un bloqueo intercostal aislado, un poco más proximal a través del bloqueo paravertebral ipsilateral, y en su origen a través de bloqueos epidurales o intradurales torácicos. En general, cuanto más central es el bloqueo más amplia es la analgesia que nos ofrece, mayores los posibles efectos secundarios, y más complicaciones potenciales existen. Como indicaciones tenemos la pancreatitis, herpes zoster agudo y dolor postherpético, dolor postoracotomía y fracturas costales. En último lugar, los vendajes compresivos y la dificultad a la expectoración son favorecedores de atelectasias, hipoxia y neumonía intercurrente. Un eficaz control del dolor es imprescindible en los pacientes con fracturas múltiples y tórax inestable para evitar la intubación endotraqueal (7). Para este tipo de pacientes se ha usado bupivacaína, 2 mg de morfina epidural torácica, perfusiones de bupivacaína-morfina, perfusión continua de fentanilo epidural (38) (2 pacientes con analgesia epidural lumbar continua solo consiguieron analgesia eficaz cuando se les repitió la técnica a nivel torácico), morfina epidural versus morfina intravenosa (con disminución de la estancia hospitalaria en el primer grupo), con muy buenos resultados. La adición de AINES en los pacientes tratados con epidural torácica con perfusión continua de bupivacaína-morfina no parece mejorar el control analgésico (39).
En resumen:
- La administración intermitente de opioides epidurales proporciona mejor analgesia que su uso a nivel intramuscular o intravenoso.
- La analgesia proporcionada por los opiodes intravenosos es similar a la analgesia epidural en procesos quirúrgicos con poco dolor postoperatorio.
- En procedimientos con dolor postoperatorio elevado el uso de una técnica epidural torácica con opioides proporciona mejores resultados que los mismos a nivel intravenoso.
- La perfusión epidural torácica de fentanilo, o en combinación con anestésicos locales, proporciona una excelente analgesia y una recuperación temprana después de una toracotomía (40).
Complicaciones y problemas relacionados
En relación a la depresión respiratoria, existen varios factores de riesgo que propician este fenómeno:
- Uso de fármacos hidrofílicos.
- Grandes dosis o dosis repetidas de opioides epidurales.
- Nivel torácico del bloqueo.
- Uso concomitante de opioides intravenosos.
- Edad avanzada o pacientes debilitados.
- Enfermedades pulmonares coexistentes.
Trauma directo de la medula espinal:
La incidencia real es desconocida, pero en una revisión bibliográfica realizada por Dawkins (41), después de 32.718 bloqueos epidurales hubo dos casos con parálisis transitoria después de la realización de la técnica. La incidencia en la literatura parece ser casi inexistente en lo que los autores denominan“ manos expertas lumbares“. Bromage advierte del peligro de lesión durante la anestesia epidural torácica con el paciente anestesiado (42). El dolor lancinante que acompaña el dolor del trauma medular pasaría inadvertido en el paciente dormido.
Vascularización arterial de la medula espinal:
Solo existe una arteria medular anterior en la medula espinal. Es el territorio mas vulnerable. A nivel tóraco-lumbar, la arteria medular esta nutrida por la «radicularis magna«, que suele acceder al canal medular por el foramen intervertebral izquierdo a nivel T11-T12 ( aunque puede acceder a través de los forámenes de T8-L3). El aporte arterial de la medula espinal a nivel tóraco-lumbar se encuentra interrumpido en los niveles mas superiores (46). El riesgo de hemorragia o trombosis de la arteria medular anterior se tiene que tener siempre en cuenta. La imposibilidad de colocar un catéter epidural torácico ocurre en 1 de cada 10 veces aun en manos experimentadas (47).
Dosis recomendadas
En cirugía torácica, cuanto menor es la dosis mejor el resultado. Pero ¿cuanto menor? Sería motivo de debate. Se esta observando un interés creciente en las perfusiones continuas epidurales a dosis extra-bajas, pero lo estudiado no se puede extrapolar todavía a nivel torácico. Hasta el presente (46), las concentraciones comerciales de lidocaína 1% y bupivacaína han demostrado eficacia, a pesar que algunos autores describen un 80% de somnolencia en los tratados con bupivacaína 0“™25%. Un bloqueo motor leve y caudal aparece en algunos pacientes pero sin interferir en la posibilidad de expectorar. El uso de una perfusión continua de anestésico local a bajas dosis también disminuye la incidencia de hipotensiones (46).
Para la inyección intermitente epidural un buen protocolo clínico sería la administración de 1 ml de anestésico local por dermatoma que queremos bloquear (46). La toxicidad, sin embargo, es un efecto adverso que deba siempre contemplarse. Son los niveles de anestésico local en sangre los que determinan la toxicidad de un anestésico local, provocando convulsiones o depresión miocárdica, y es conocido que los niveles tóxicos en sangre se alcanzan rápidamente en los bloqueos intercostales. En parte esto es debido a la gran vascularización de la zona intercostal y en parte por la necesidad de frecuentes y múltiples reinyecciones a este nivel para conseguir una analgesia adecuada (46).
Dosis bajas de morfina epidural (0“™2 mg/h) ““ bupivacaína (10 mg/h) no han demostrado obtener mejoría en lo que concierne la deambulación precoz, posiblemente debido al bloqueo simpático o por la alteración de la adaptación cardiovascular a la sedestación (45). La analgesia y anestesia epidural torácica tiene también gran utilidad a nivel pediátrico.
Bibliografía
1.- Crawford OB, Ottesen P, Buckingham WW, Brasher CA. Peridural anesthesia in thoracic surgery. A review of 677 cases. Anesthesiology 1951; 12: 73-95. (PubMed) (pdf)
2.- Vasconcelos E. Cancer of the esophagus: original technique for total esophagectomy. Diseases of the Chest 1944; 10: 471-480. (html) (pdf)
3.- Fujikawa YF, Neves A, Brasher CA et al. Epidural anesthesia in thoracic surgery. J Thorac Surg. 1948 Feb;17(1):123-34. (PubMed)
4.- Bonica J. Continuous peridural block. Anesthesiology 1956; 17: 626-630. (PubMed) (pdf)
5.- O’Connor CJ. Thoracic epidural analgesia: Physiologic effects and clinical applications. J Cardiothorac Vasc Anesth. 1993 Oct;7(5):595-609. (PubMed)
6.- Dawkins & Steel. Thoracic extradural block for upper abdominal surgery. Anaesthesia. 1971 Jan;26(1):41-8. (PubMed)
7.- Simpson BR, Parkhouse J, Marshall R, Lambrechts W. Extradural analgesia and the prevention of postoperative respiratory complications. Br J Anaesth. 1961 Dec;33:628-41. (PubMed)
8.- Reinhart K, Foehring U, Kersting T, Schaefer M, Bredle D, Hirner A, Eyrich K. Effects of thoracic epidural anesthesia on systemic hemodynamic function and systemic oxygen supply-demand relationship. Anesth Analg. 1989 Sep;69(3):360-9. (PubMed)
9.- O’Connor CJ. Thoracic epidural analgesia: Physiologic effects and clinical applications. J Cardiothorac Vasc Anesth. 1993 Oct;7(5):595-609. (PubMed)
10.- Saada M, Catoire P, Bonnet F, Delaunay L, Gormezano G, Macquin-Mavier I, Brun P. Effecte of thoracic epidural anesthesia combined with general anesthesia on segmental wall motion assessed by transesophageal echocardiography. Anesth Analg. 1992 Sep;75(3):329-35. (PubMed)
11.- Blomberg S, Ricksten S. Effects of thoracic epidural anaesthesia on central haemodynamics compared to cardiac beta adrenoreceptor blockage in conscious rats with acute myocardial infarction. Acta Anaesthesiol Scand. 1990 Jan;34(1):1-7. (PubMed)
12.- Blomberg S, Curelaru I, Emanuelsson H, Herlitz J, Pontén J, Ricksten SE. Thoracic epidural anaesthesia in patients with unstable angina pectoris. Eur Heart J. 1989 May;10(5):437-44. (PubMed)
13.- Blomberg SG. Long term home self treatment with high thoracic epidural anesthesia in patients with severe coronary artery disease. Anesth Analg. 1994 Sep;79(3):413-21. (PubMed)
14.- Kock M, Blomberg S, Emanuelsson H, Lomsky M, Strí¶mblad SO, Ricksten SE. Thoracic epidural anesthesia improves global and regional left ventricular function during stress-induced myocardial ischemia in patients with coronary artery disease. Anesth Analg. 1990 Dec;71(6):625-30. (PubMed)
15.- Blomberg S, Ernanuelsson H, Krist H et al. Effects of thoracic epidural anesthesia on coronary arteries and arterioles in patients with coronary artery disease. Anesthesiology 1990; 73: 840-847. (PubMed) (pdf)
16.- Speight KL, Rauck RL, Mann JF. The effect of thoracic epidural anesthesia on pulmonary function in normals. Anesthesiology 1991; 75: A729. (Poster)
17.- Pansard JL, Mankikian B, Bertrand M et al. Effects of thoracic extradural block on diaphragmatic electrical activity and contractility after upper abdominal surgery. Anesthesiology. 1993 Jan;78(1):63-71. (PubMed) (pdf)
18.- Tanaka K, Shono S, Watanabe R et al. Incidence of asthmatic shock is not increased during high epidural anesthesia: an analysis of 1,063 asthmatics. Anesthesiology 1992; 77: A1090. (Poster)
19.- Scheinin B, Asantila B, Orko R The effect of bupivacaine and morphine on pain and bowel function after colonic surgery. Acta Anaesthesiologica Scandinavica 1987; 31: 161-170. (PubMed)
20.- Katz Journal of, Kavanagh B, Sandler A. Pre-emptive analgesia: clinical evidence of neuroplasticity contributing to postoperative pain. Anesthesiology 1991; 77: 439-446. (PubMed) (pdf)
21.- Dahl JB, Kehlet H. The value of pre-emptive analgesia in the treatment of postoperative pain. British Journal of Anaesthesia 1993; 70: 434-439. (PubMed)
22.- Nesmith RL, Herring SR, Marks M et al. Early experience with high thoracic epidural anesthesia in outpatient submuscular breast augmentation. Annals of Plastic Surgery 1990; 24: 299-303. (PubMed)
23.- Burgess FW, Colonna T, Anderson DM et al. Postoperative referred pain following thoracotomy. Anesthesiology 1992; 77: A867. (Poster)
24.- Kavanagh BP, Katz J, Sandler AN. Pain control after thoracic surgery. A review of current techniques. Anesthesiology 1994; 81: 737-759. (PubMed) (pdf)
25.- Brodsky JB, Chaplan SR, Brose WG et al. Continuous epidural hydromorphone for post-thoracotomy pain relief. Annals of Thoracic Surgery 1990; 50: 888-893. (PubMed)
26.- Benzon HT, Wong HY, Belavic A et al. A randomised double-blind comparison of epidural fentanyl infusion vs. patient controlled analgesia with morphine for post-thoracotomy pain. Anesthesia and Analgesia 1993; 76: 316-322. (PubMed)
27.- Salomaki TE, Laitinen 10, Nuutinen LS. A randomized double-blind comparison of epidural versus intravenous fentanyl infusion for analgesia after thoracotomy. Anesthesiology 1991; 75: 790-795. (PubMed) (pdf)
28.- Guinard JP, Mavrocordatos P, Chiolero R, Carpenter RL. A randomised comparison of intravenous versus lumbar and thoracic epidural fentanyl for analgesia after thoracotomy. Anesthesiology 1992; 77: 1108-1115. (PubMed) (pdf)
29.- Sawchuk CW, Ong B, Unruh HW, Horan TA, Greengrass R. Thoracic versus lumbar epidural fentanyl for postthoracotomy pain. Ann Thorac Surg. 1993 Jun;55(6):1472-6. (PubMed)
30.- Swenson J, Bready R, Hollander M. A comparison of thoracic vs. lumbar epidural sufentanil for postthoracotomy pain using PCA. Anesthesiology 1992; 77: A828. (Poster)
31.- Etches RC, Sandler AN, Daley MD. Respiratory depression and spinal opioids. Canadian Journal of Anaesthesia 1989; 36: 165-185. (PubMed)
32.- Conacher ID. Pain relief after thoracotomy. British Journal of Anaesthesia 1990; 65: 806-812. (PubMed)
33.- Mourisse J, Hasenbos MA, Gielen MJ et al. Epidural bupivacaine, sufentanil, or the combination for post-thoracotomy pain. Acta Anaesthesiologica Scandinavica 1992; 36: 70-74. (PubMed)
34.- Liem TH, Booij LH, Hasenbos MA et al. Coronary artery bypass grafting using two different anesthetic techniques. Haemodynamic results: Part I. Journal of Cardiothoracic and Vascular Anesthesia 1992; 6: 148-155. (PubMed)
35.- Liem TH, Hasenbos MA, Booij LH et al. Coronary artery bypass grafting using two different anesthetic techniques: Part II. Postoperative outcome. Journal of Cardiothoracic and Vascular Anesthesia 1992; 6: 156-161. (PubMed)
36.- Liem TH, Hasenbos MA, Booij LH et al. Coronary artery bypass grafting using two different anesthetic techniques: Part III. Postoperative outcome. Journal of Cardiothoracic and Vascular Anesthesia 1992; 6: 162-167. (PubMed)
37.- Stevens DS. Epidural hematoma. Was catheter removed during complete anticoagulation? Anesthesia and Analgesia 1992; 75: S63. (PubMed)
38.- Mackersie RC, Shackford SR, Hoyt DB et al. Continuous epidural fentanyl analgesia: ventilatory function improvement with routine use in treatment of blunt chest injury. Joumal of Trauma 1987; 27: 1207-1212. (PubMed)
39. Bigler D, Moller J, Kamp-Jensen M, Berthelsen 0, Hjortso Ne, Kehlet H. Effect of piroxicam in addition to continuous thoracic epidural bupivacaine and morphine on postoperative pain and lung function after thoracotomy. Acta Anaesthesiologica Scandinavica 1992; 63: 647-650. (PubMed)
40.- Benzon HT. Post-thoracotomy epidural analgesia: lumbar or thoracic placement? Joumal of Cardiothoracic and Vascular Anesthesia 1993; 7: 515-516. (PubMed)
41.- Dawkins CJM. An analysis of the complications of extradural and caudal block. Anaesthesia 1969; 24: 554-563. (PubMed)
42.- Bromage PR The control of post-thoracotomy pain. Anaesthesia 1989; 44: 445-446. (PubMed)
43.- Aguilar JL, Samper D, Montes A, Llorente e, Faura A, Vidal F. Thoracic epidural block does not prevent post-thoracotomy pain. Regional Anesthesia 1992; 17: S148. (Poster)
44.- Aguilar JL, Cubells e, RinconR, Preciado MI, Valldeperas I, Vidal F. Pre-emptive analgesia following epidural 0.5% bupivacaine in thoracotomy. Regional Anesthesia 1994; 19: sn. (Poster)
45.- Moiniche S, Hjortso NC, Blemmer T, Dahl JB, Kehlet H. Blood pressure and heart rate during orthostatic stress and walking with continuous postoperative thoracic epidural bupivacaine/morphine. Acta Anaesthesiologica Scandinavica 1993; 37: 65-69. (PubMed)
46.- Cousins MJ, Bromage PR Epidural neural blockade. In Cousins MJ, Bridenbaugh PO (eds). Neural Blockade in Clinical Anesthesia and Management of Pain. Philadelphia, PA, Lippincott, 1988; 253-347. (googlebooks)
47.- Conacher ID. Pain relief following thoracic surgery. In: Gothard JWW, ed. Thoracic Anaesthesia. London, Bailliere Tindall, 1987; 240-243.
José Luis Aguilar, María Sanabra, Nicolás García Servicio de Anestesiología, Reanimación y Tratamiento del Dolor Hospital Son Llatzer – Palma de Mallorca



muy bueno este articulo, desearia seguir recibiendo articulos como estos. gracias.
Lanzo un par de preguntas (dirigidas a quienes tengan experiencia en epidural torácica)
– ¿Cuánto soléis introducir el catéter epidural a este nivel?
– ¿Qué analgesia postoperatoria utilizais en cirugía abierta sobre la aorta abdominal? ¿Utilizais la epidural? En caso de que así sea, ¿qué pasa con la tan temida «punción hemática»? ¿Nos arriesgamos a tener que suspender la cirugía por proporcionar una analgesia «óptima» o nos conformamos con una PCA venosa?
Felicidades a los autores de la entrada.
Yo quisiera incidir en las cuestiones que plantea Mikel acerca de la epidural para cirugía vascular. Hasta donde yo sé hay pocas dudas acerca de suspender una intervención de cirugía cardíaca si, tras la colocación del catéter epidural, refluye sangre por el mismo, habida cuenta que al paciente se le van a administrar 3 mg/kg de heparina antes de entrar en bomba. Pero, ¿qué ocurre si la aspiración de sangre por el catéter epidural se da antes de la administración de 1 mg/kg de heparina para una cirugía vascular? ¿Debemos suspender la intervención?
Buenísima entrada . Mis sinceras felicitaciones . Curiosamente es un tema en el que es dificil encontrar revisones tan didacticas como ésta .
Esta entrada es un «must » para que la lean los resis .
O el principio de un libro electrónico de anestesia ….
Respecto a la pregunta de Mikel , nosotros sí la utlizamos mucho : más alta en cirugía torácica y algo más baja en cirugía general .
En cirugía vascular también se hace de rutina en mi servico . La clave en este último caso es la relación con los cirujanos , y que el equipo asuma que es positiva .
Los cirujanos torácicos son pioneros en esa asunción , pero enotros escenarios como la vascular puede ser igual .
De hecho en Alicante por ejemplo llegan tiempo haciendo inclusive epidural torácica en cardicaca .
Sí que se observa , hablando con compañeros y amigos de nuemerosos hospitales que hay un ligero retroceso de la epidural en favor del paravertebral , y que en sitios dónde no se hacía epidural , ahora se hace paravertebral .
Pero bueno esa es otra discusión .
Lo que si es cierto es lo buena y útil de la entrada para los resis ( y lo digo como tutor ) .
Coincido con Fernando Ramasco. En nuestro centro también hay un ligero retroceso de la epidural en favor de la paravertebral, pero sólo en cirugía torácica.
¿habeis visto el artículo sobre paravertebral bilateral de este mes en el BJA?
Gracias. José Luis (Cote) Aguilar
GRACIAS A TODOS OTRA VEZ….Tomamos nota y trabajaremos más en esta línea didáctica….. Cote
Excelente artículo, nosotros la usamos de rutina en cirugía torácica y con cierto temor en cardiovascular por el detalle de la heparina, aunque no hemos tenido nunca una complicación neurologica.
Introducimos apenas, volúmenes no mayores de 6cc y unos 5cms el catéter, gracias por este blog .
Tengo mucha duda respecto a la dosis a utilizar en caso dado q se haga una anestesia para cirugía de mamá. Cuál es el espacio recomendado. Q anestésico local de elección. El volumen y la cantidad de anestésico q podría usar.