Molero Díez YB (1), Gómez Fernández M (2), García Lázaro F (2)
(1) Residente de Anestesiología y Reanimación, Hospital Virgen de la Concha, Zamora
(2) FEA en Anestesiología y Reanimación, Hospital Virgen de la Concha, Zamora
Cómo citar este artículo: Molero Díez, Y. B., Gómez Fernández, M., & García Lázaro, F. (2020). Diabetes insípida perioperatoria secundaria a litio.: Reporte de un caso. Revista Electrónica AnestesiaR, 12(2), 1. https://doi.org/10.30445/rear.v12i2.817
Introducción
La diabetes insípida es una patología que se caracteriza por la eliminación de elevados volúmenes de orina muy diluida. La hormona antidiurética o arginina vasopresina (AVP) se libera desde la neurohipófisis y es la encargada de regular la reabsorción de agua en las células del túbulo colector renal (1). Dependiendo del nivel que esté afectado podemos encontrarnos con dos variantes:
Diabetes insípida neurogénica o central (DIC), cuando es la neurohipófisis la que presenta una insuficiencia para secretar cantidades adecuadas de vasopresina (AVP), también denominada hormona antidiurética.
Diabetes insípida nefrogénica (DIN), en este caso es el riñón el que presenta incapacidad total o parcial para responder a la AVP circulante.
La forma nefrogénica adquirida o secundaria es mucho más frecuente que la congénita, con una clínica más moderada, siendo raramente severa. Puede ser causada por disbalances electrolíticos (hipercalcemia, hipopotasemia), enfermedades renales y fármacos.
Varios fármacos han sido involucrados en la pérdida de la capacidad concentradora renal (2).
Caso clínico
Se presenta el caso de una paciente mujer de 49 años de edad, 157cm de altura y 72kg, diagnosticada de estenosis pilórica benigna ya intervenida, que ingresa 10 días antes por dolor epigástrico y vómitos secundario a movilización de prótesis pilórica. Se somete en cirugía programada a duodenotomia, duodenorrafia, colecistectomía y resección segmentaria de íleon en una misma intervención quirúrgica.
Entre sus antecedentes personales se encuentran hipertensión arterial (HTA), trastorno bipolar, varices esofágicas, histerectomía con doble anexectomía hace 5 años, colocación de prótesis pilórica y mastectomía radical con linfadenectomía, quimioterapia y radioterapia por neoplasia maligna de mama hace 13 años, actualmente sin progresión.
En el momento de la intervención quirúrgica se encontraba en tratamiento con valsartán, domperidona, olanzapina, venlafaxina, lorazepam, zolpidem y litio, que mantuvo hasta la noche previa. Los valores analíticos preoperatorios fueron: Hb: 11,3g/dL, Hto: 35,3%, plaquetas: 425×109/L, TP:77%, TTPA: 29s, litio: 0,9mEq/L, sin otros hallazgos significativos. Electrocardiograma (ECG) normal. Resto de exploración anestésica preoperatoria dentro de los límites normales.
Se realizó una monitorización intraoperatoria estándar con electrocardiograma continuo (ECG), saturación de oxígeno por pulsioximetría (SpO2), presión arterial no invasiva (PANI), y concentración espiratoria de dióxido de carbono o end-tidal de CO2 (EtCO2). Además, se colocó medidor de relajación neuromuscular. No se realizó monitorización de la temperatura. A su llegada a quirófano PANI 137/81mmHg, frecuencia cardíaca 74 latidos por minuto y SpO2 99%.
Previamente a la inducción se premedicó con 3mg de midazolam para colocación de catéter epidural, pero por falta de colaboración de la paciente se desestimó esta técnica analgésica. La inducción anestésica se realizó con propofol a 2,5mg/kg y fentanilo a 1µg/kg, se realizó intubación con tubo orotraqueal nº 7,5 tras 40mg de rocuronio.
Los parámetros ventilatorios que se fijaron fueron FiO2: 0,4 (mezcla de aire y oxígeno), volumen corriente: 7ml/kg y frecuencia respiratoria de 12 respiraciones por minuto mediante un modo de ventilación por volumen con una PEEP óptima de 4.
El mantenimiento se estableció mediante técnica de anestesia intravenosa (TIVA) con propofol a 6µg/kg/h y bolos intermitentes de fentanilo de 2 µg/kg cada 30 minutos, precisándose un total de 700µg de fentanilo tras 185 min de cirugía. Se administraron un total de 70mg de rocuronio para mantener una buena relajación neuromuscular (TOF 0-1). La paciente permaneció estable hemodinámicamente en todo momento.
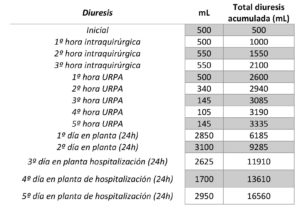
Se realizó sondaje vesical, con una diuresis tras el mismo de 500cc. La diuresis horaria fue de 500cc durante la primera hora, 550cc durante la hora siguiente y 550 en la 3º hora, sumando un total de 2100ml en 185 minutos. En control bioquímico intraoperatorio a las 2 horas del inicio de la incisión destacó un sodio de 152mEq/l, Potasio 3.3mEq/l, Osmolalidad 295mOsml/kg, Glucosa 169mg/dl, Urea 17mg/dl, Creatinina 0,65mg/dl, Ecuación CKD-EPI 105mL/min/1.73m2. Ante esta situación de poliuria, y con sospecha de diabetes insípida, se administraron 2µg de desmopresina (derivado sintético de la vasopresina) una hora antes del despertar.
Se infundieron durante la cirugía 2000ml de suero salino fisiológico y otros 2000ml de Ringer Lactato® con calentador de fluidos. Se utilizó manta térmica durante toda la intervención. La pérdida hemática fue aproximadamente de 50ml.
Previo a la educción se administraron 50mg de dexketoprofeno y 40mg de pantoprazol intravenosos. A continuación, la paciente fue conducida a la unidad de recuperación postanestésica (URPA), en la que permaneció 5,5 horas, con una diuresis/hora de 500 ml la primera hora, 340ml, 145ml, 105 ml y 145ml respectivamente, acumulando un total de 1235 ml durante su estancia en URPA (Tabla I). La paciente se mantuvo estable desde el punto de vista hemodinámico y ventilatorio con analgesia postoperatoria de paracetamol 1gr y una perfusión continua de cloruro mórfico de 0,5mg/h.
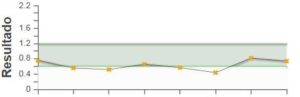
Se revisaron todos los niveles de litio preoperatorios registrados (gráfico 1), con un margen terapéutico limitado en nuestro hospital entre 0,6 y 1,2 mEq que en los últimos años y en la determinación realizada tras la consulta de preanestesia habían estado dentro de rango terapéutico. Durante su estancia hubo valores de litemia ligeramente inferiores al rango bajo de la normalidad, recuperándose al alta. Se solicitó valoración al Servicio de Nefrología pautando desmopresina 2µg y sueroterapia con Suero salino hipotónico 0,45 % 1000ml junto con suero glucosado 5% 500ml con 10 mEq ClK y 2500ml suero fisiológico 0,9% diarios.
El control de la función renal a las 3 horas del ingreso en URPA reflejó los siguientes datos: Sodio de 151 mEq/l, Potasio 3.4 mEq/l, Osmolalidad 294mOsml/kg, Glucosa 179mg/dl, Urea 20mg/dl, Creatinina 0,79mg/dl, Ecuación CKD-EPI 88mL/1.73 m2. Sodio en orina 96mEq/l, Potasio 22,7mEq/l. Osmolaridad medida en orina de 360mOsm/l. Los niveles de Litio fueron de 0.44mEq/l.
En planta de hospitalización se ajustó de nuevo la sueroterapia por parte del Servicio de Nefrología, que indicó la no reanudación del tratamiento con litio, adecuando el tratamiento el Servicio de Psiquiatría. Se mantuvo desmopresina 2µg cada 12 horas y posteriormente cada 24 horas, suspendiéndola a las 72 horas del postoperatorio.
La diuresis en las primeras veinticuatro horas en planta fue de 2850cc, el segundo día de 3100cc, el tercer día de 2625cc, el cuarto día de 1700cc, el quinto día 2950cc, normalizándose posteriormente (tabla I)
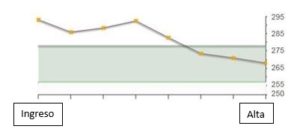
La paciente permaneció estable hemodinámicamente durante toda su estancia hospitalaria, con PANI en torno a 140/85mmHg. Las osmolaridades plasmáticas durante el ingreso fueron descendiendo (gráfica 2) en controles seriados. Fue alta domiciliaria a los 17 días de la intervención con el diagnóstico definitivo diabetes insípida nefrogénica secundaria a litio con cierto componente de origen central.
Discusión
Los agentes farmacológicos más frecuentemente asociados con la diabetes insípida nefrogénica son la demeclociclina y el litio(3).
El litio es la droga de elección en la enfermedad bipolar, siendo ampliamente utilizada. A pesar de su eficacia establecida hay que tener en cuenta que su uso a largo plazo puede presentar complicaciones por el estrecho rango terapéutico que presenta y por los amplios, y en ocasiones irreversibles, efectos secundarios que puede ocasionar(4).
La ADH se une a los receptores V2 de las células principales del túbulo colector provocando así la traslocación de los canales de agua de las aquaporinas-2 y permitiendo la reabsorción de agua a favor de gradiente(5).
Se han descrito varias vías mediadoras del daño renal inducido por el litio, pero los últimos estudios han demostrado daño en las aquaporinas como causantes de esta patología, a pesar de ello el mecanismo fisiopatológico por el que esta enfermedad se produce no está claramente definido(6). Se sabe que el litio disminuye el efecto antidiurético de la vasopresina en los tratamientos de larga duración; por un lado, se encarga de disminuir la producción de la prostaglandina PGE2 que se encarga de la síntesis del cAMP de la vasopresina; por otro lado, el litio reduce el gen de la aquaporina 2 por un mecanismo independiente al de las prostaglandinas, reduciendo aún más la capacidad de concentración urinaria. El litio además induce remodelación de los túbulos colectores reduciendo el número de células principales encargadas de la concentración de la orina(5, 7).
Cerca del 10-20% de los pacientes tratados con litio pueden presentar una diabetes insípida nefrogénica, por resistencia a la ADH, pudiendo llegar a desarrollar un pequeño porcentaje también diabetes insípida central.
El diagnóstico diferencial de la diabetes insípida (tabla II) va a depender de los datos analíticos de laboratorio, por la concentración de los iones y la osmolaridad plasmática y la osmolaridad urinaria(8); así como clínica, signos y síntomas compatibles. El test de deprivación de agua o la sobrecarga con vasopresina van a confirmar el diagnóstico definitivo de la enfermedad.
El tratamiento inicial de la diabetes insípida nefrogénica es la retirada del litio, junto con la restricción de la ingesta de sal para evitar una mayor absorción de sodio que aumenta la osmolaridad plasmática(9). Se puede añadir también una tiazida o amiloride, diuréticos ahorradores de potasio, dado los bajos niveles que estos pacientes presentan. Se ha intentado el tratamiento con antiinflamatorios no esteroideos (AINES) clásicos y con inhibidores selectivos de la COX pero se ha visto que aumentan la toxicidad del litio(10).
La litemia puede aumentar con una gran cantidad de fármacos, como son los AINES, algunos diuréticos tiazídicos, del asa y ahorradores de potasio, los IECAs y los antagonistas del calcio.
Es importante conocer que los procedimientos quirúrgicos suponen un gran acontecimiento para el paciente, pudiendo manifestar y conllevar un compromiso biopsicosocial, especialmente en personas con enfermedades psiquiátricas. La existencia de un problema mental no tratado o mal controlado se asocia a una mayor estancia hospitalaria(11). Cuando el paciente ya se encuentra en tratamiento en rango óptimo, la decisión de suspender o continuar con el tratamiento psicofarmacológico durante el periodo perioperatorio va a depender del balance riesgo/beneficio en cuanto al riesgo de recaída si se abandona, o riesgo de interacciones farmacológicas si se continua.
En el caso del litio existe bastante controversia sobre si se debe mantener o suspender, dado su estrecho margen terapéutico(12). Debido a que la ingesta de líquidos está reducida las horas previas a la intervención quirúrgica, estos pacientes podrían llegar a presentar hipovolemia e hipernatremia con la consiguiente subida plasmática del litio. El riesgo de recaída tras la retirada es muy alto, por lo general, se debería mantener, aun sabiendo que puede prolongar el efecto de los relajantes neuromusculares tanto despolarizantes como no despolarizantes; también se cree que bloquea la liberación de adrenalina, noradrenalina y dopamina en el cerebro, que utilizándolo junto a barbitúricos, puede aumentar el tiempo de hipnosis, es por ello que muchos autores abogan por la descontinuación del litio antes de una cirugía electiva 72 horas antes de la misma, reiniciándolo en el postoperatorio una vez el paciente se encuentre hemodinámicamente estable, con tolerancia oral y niveles adecuados de sodio, potasio y función renal(13).
En caso de decidir mantenerlo, se debe realizar una correcta monitorización de sus niveles plasmáticos preoperatorios, junto con los electrolitos, función renal y tiroidea. También es imprescindible una correcta monitorización de la relajación neuromuscular intraoperatoria. Con respecto a la analgesia postoperatoria hay que tener especial precaución, dado que la mayoría de los AINES aumentan la litemia, mientras que el paracetamol, el ácido acetilsalicílico (AAS) y el sulindac no tienen repercusión sobre la misma.
El uso del litio puede ser potencialmente dañino dado el estrecho rango terapéutico que tiene. Es por ello por lo que se necesita una correcta monitorización plasmática del mismo, valorando el verdadero riesgo/beneficio de su retirada preoperatoria, manteniéndoles euvolémicos y vigilando de manera estrecha a estos pacientes durante todo el periodo perioperatorio.
El caso presentado parece corresponder a una Diabetes Insípida Nefrogénica con componente central ante los datos de laboratorio y la respuesta al tratamiento.
Bibliografía
- Bockenhauer D, Bichet DG. Nephrogenic diabetes insipidus. Curr Opin Pediatr. 2017;29(2):199-205. https://www.doi.org/10.1097/MOP.0000000000000473 (PubMed)
- Morello J-P, Bichet DG. Nephrogenic Diabetes Insipidus. Annu Rev Physiol. 2001;63(1):607-30. (PubMed)
- Velásquez-Jones L, Medeiros-Domingo M. Diabetes insípida nefrogénica. Bol Med Hosp Infant Mex. 2014;71(6):332-8. http://dx.doi.org/10.1016/j.bmhimx.2015.01.004
- Shakaroun D, Nasser H, Munie S, Soman S. Nephrogenic diabetes insipidus after esophagectomy in a patient with remote history of lithium treatment: A case report. Int J Surg Case Rep. 2019;57:71-3. http://dx.doi.org/10.1016/j.ijscr.2019.03.006 (PubMed)
- Shnaider A, Azab A. Lithium-induced Nephrogenic Diabetes Insipidus–A Case Report and Discussion on the Pathophysiological Mechanism. Int J Nephrol Kidney Fail. 2015;1(3). http://dx.doi. org/10.16966/2380-5498.113
- Castro-Pretelt D, Mauricio J. Diabetes insípida nefrogénica inducida por litio: el papel de las aquoporinas. Salud Uninorte. 2005(20). (HTML)
- Sugawara M, Hashimoto K, Ota Z. Involvement of prostaglandin E2, cAMP, and vasopressin in lithium-induced polyuria. Am J Physiol. 1988;254(6):R863-R9. (PubMed)
- Stone KA. Lithium-induced nephrogenic diabetes insipidus. J Am Board Fam Pract. 1999;12(1):43-7. (PubMed)
- Boton R, Gaviria M, Batlle DC. Prevalence, pathogenesis, and treatment of renal dysfunction associated with chronic lithium therapy. Am J Kidney Dis. 1987;10(5):329-45. (PubMed)
- Kim G-H, Choi NW, Jung J-Y, Song J-H, Lee CH, Kang CM, et al. Treating lithium-induced nephrogenic diabetes insipidus with a COX-2 inhibitor improves polyuria via upregulation of AQP2 and NKCC2. Am J Physiol Renal Physiol. 2008;294(4):F702-F9. (PubMed) http://dx.doi.org/10.1152/ajprenal.00366.2007
- Janowsky EC, Risch C, Janowsky DS. Effects of anesthesia on patients taking psychotropic drugs. J Clin Psychopharmacol. 1981;1(1):14-20. (PubMed)
- Fuentes R, Parra A, Coloma R, Inzunza M, Díaz P, Nazar C. Manejo perioperatorio de pacientes usuarios de antidepresivos. Rev Chil Cir. 2017;69(4):345-51. (PDF) http://dx.doi.org/10.1016/j.rchic.2017.02.008
- Attri J, Bala N, Chatrath V. Psychiatric patient and anaesthesia. Indian J Anaesth. 2012;56(1):8-13. (HTML) http://dx.doi.org/10.4103/0019-5049.93337
Cómo citar: Molero Díez, Y. B., Gómez Fernández, M., & García Lázaro, F. (2020). Diabetes insípida perioperatoria secundaria a litio.: Reporte de un caso. Revista Electrónica AnestesiaR, 12(2), 1. https://doi.org/10.30445/rear.v12i2.817