Charco Roca LM (1), Jimenez Vizuete JM (2), Ayelo Navarro A (3)
(1) Facultativo Especialista de área. Servicio de Anestesiología y Reanimación, Hospital General Universitario de Albacete.
(2) Jefe de Sección. Servicio de Anestesiología y Reanimación, Hospital General Universitario de Albacete.
(3) Jefe de Servicio. Hospital General de Almansa, Albacete.
Cómo citar este artículo: Charco Roca, L. M., Jiménez Vizuete, J. M., & Ayelo Navarro, A. (2020). Estrategias de optimización de uso de betalactámicos: La importancia de conocer las particularidades fisiopatológicas del paciente crítico. Revista Electrónica AnestesiaR, 11(9), 3. https://doi.org/10.30445/rear.v11i9.786
Introducción
Los pacientes críticos presentar unas características especiales (gravedad, agentes patógenos, disfunciones orgánicas) que los diferencian del resto de pacientes hospitalizados y que justifican un uso diferenciado de los antibióticos. Desde hace años se han propuesto normas y estrategias para mejorar la administración de la antibioterapia, lo que en conjunto recibe el nombre de política antibiótica, con la finalidad de optimizar su empleo y disminuir la morbilidad relacionada con su prescripción.
Los betalactámicos son el grupo de antibióticos más utilizados en las Unidades de Medicina Intensiva (UCI) gracias a su amplio espectro y a su alta tolerabilidad. Elegir el antimicrobiano adecuado para tratar el foco infeccioso, es tan crucial como pautar la dosis correcta para obtener una adecuada erradicación microbiológica y una curación clínica.
Los cambios fisiopatológicos de los pacientes ingresados en la UCI originan situaciones donde la información farmacocinética obtenida en las fases iniciales de los estudios clínicos realizados para la aprobación de los antibióticos, no se ajusta habitualmente a la situación real. Se ha observado que las alteraciones fisiopatológicas de estos pacientes pueden generar cambios significativos dinámicos en uno o en varios de los cuatro procesos farmacocinéticos (absorción, distribución, metabolismo o excreción) (1), representando este hecho una gran variabilidad interindividual a pesar de administrar las mismas dosis de antibióticos. Debido a esto, es necesario individualizar los tratamientos antimicrobianos en el paciente crítico para mejorar así su eficacia.
Resumen
– Objetivos
Este trabajo presenta una descripción de las particularidades farmacodinámicas de los betalactámicos y su aplicación en el contexto de la infección en el paciente crítico.
– Material y métodos
Para escribir esta revisión los autores realizaron una búsqueda bibliográfica en PubMed de los artículos en inglés publicados desde enero del año 2000 hasta Diciembre de 2017, utilizando las siguientes palabras clave: cuidados críticos o cuidados intensivos o enfermos críticos y sepsis o shock séptico y antibióticos, y farmacocinética o farmacodinamia. Se incluyen en esta revisión 214 estudios.
– Resultados
Los resultados se exponen a modo de resumen la tabla 1.
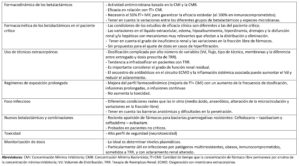
– Conclusiones
Los autores concluyen que se ha demostrado una mejora del perfil farmacodinámico de los betalactámicos con un aumento de la duración del tiempo de infusión. Según los autores se necesitan más estudios que definan: la dosificación óptima de los nuevos betalactámicos, el uso de antibióticos en el paciente con soporte extracorpóreo, el tratamiento de las cepas multirresistentes y el tratamiento de pacientes con focos difíciles de tratar por limitación de la difusión de los fármacos. Proponen que la medición de niveles séricos podría ser de utilidad en determinados pacientes (obesos, inmunodeprimidos, hiperfiltradores, uso de terapias de depuración renal o con patógenos multirresistentes) y recomiendan usar dosis superiores al estándar, preferiblemente en infusiones continuas o prolongadas.
Comentarios
La actividad antimicrobiana de los antibióticos suele evaluarse por determinación de la concentración mínima inhibitoria (CMI) y la concentración mínima bactericida (CMB) del fármaco en condiciones específicas in vitro que pueden ser diferentes de las que puede presentar el lugar de la infección, donde el medio ambiente es frecuentemente ácido y anaeróbico, y el fármaco puede unirse a proteínas viéndose disminuida su fracción libre (activa). Los niveles de los fármacos en los pacientes no son estables habitualmente y además el laboratorio los testa con inóculos bacterianos estándar (10 unidades formadoras de colonias (UFC) por mililitro) que no necesariamente corresponden a densidades bacterianas en el sitio de la infección. La máxima capacidad bactericida para los betalactámicos se consigue cuando las concentraciones plasmáticas del fármaco se mantienen 4-5 veces por encima de la CMI (2), mientras que exceder esos valores no aumenta la capacidad bactericida (Figura 1).
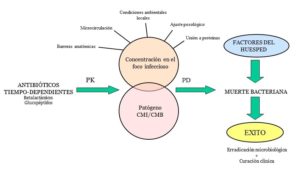
Por otra parte, la dosis e intervalo de administración de los antibióticos se basa en estudios realizados en condiciones in vitro o en animales. El establecimiento de los regímenes de dosificación y los estudios de eficacia clínica se realizan en voluntarios humanos sanos. Con los regímenes de dosificación recomendados es posible que se produzcan resultados subóptimos especialmente para las cepas bacterianas más resistentes y en población inmunocomprometida. Esto implica que pautar las dosis recomendadas de betalactámicos puede conllevar sobredosificación o infradosificación si no se tienen en cuenta las particularidades de los pacientes ingresados en UCI.
Los betalactámicos son fármacos hidrófilos y, por lo tanto, su volumen de distribución es bajo y similar al del agua extracelular. Variaciones en el líquido extracelular y/o en la función renal o hepática pueden considerarse como los hechos fisiopatológicos más relevantes que afectan a la farmacocinética, y en consecuencia suponen una modificación de los efectos farmacodinámicos observados.
Concretamos que está claro que el aclaramiento renal tiene un elevado impacto en la farmacocinética de los betalactámicos; algunos factores pueden aumentar (trauma, quemados, hiperdinamia en la fase temprana de la sepsis o por drogas vasoactivas) o reducir (insuficiencia renal, desgaste muscular, pacientes postrados en la cama) el aclaramiento renal y, por consiguiente, alterar las concentraciones séricas de fármacos promoviendo la infradosificación o sobredosificación (3).
Los estudios incluidos en esta revisión, muestran que los pacientes sépticos con insuficiencia renal aguda pueden tener un nivel subóptimo de concentraciones de antibióticos en los primeros días de terapia, cuando el ajuste de dosificación se hace en función de su función renal. Los autores puntualizan que no se recomienda reducir la dosis estándar de antibióticos en pacientes con insuficiencia renal y terapias continuas de depuración renal, ya que no se acumulan los antibióticos, ni tampoco en pacientes con bacterias multirresistentes que reciben infusiones continuas. Sin embargo si es una práctica habitual en las UCIs. Por otra parte y en el otro extremo, en presencia de hiperfiltración (aclaramiento de creatinina o ClCr > 130 ml / min) se requieren dosis mucho más altas de antibióticos para obtener niveles séricos terapéuticos.
Dado que las variaciones en el aclaramiento renal tienen impacto sobre la farmacocinética de los betalactámicos proponemos hacer cálculos de ClCr en el paciente crítico ya que es un procedimiento sencillo y con bajo coste de recursos añadido. El objetivo de estas determinaciones es ajustar las dosis de antimicrobianos y otros fármacos; no obstante las guías farmacoterapeúticas recomiendan determinados ajustes de dosis en casos de deterioro del filtrado glomerular, pero actualmente no hay recomendaciones en situaciones de hiperfiltración dado que los estudios sobre este tema son escasos y focalizados en muy pocos antibióticos (carbapenems, cefepime o piperacilina-tazobactam) (4). En estos casos recomendamos pautar dosis de carga cuando administramos betalactámicos. Hay que tener en cuenta también que aunque un ClCr aumentado se correlaciona significativamente con un aumento de depuración, los cambios en el filtrado glomerular y las terapias continuas de reemplazo renal (TCRR) no predicen de forma fiable las variaciones en la farmacocinética/farmacodinámica de los fármacos. En el futuro se debe investigar en qué grado se ve afectado el aclaramiento de los antibióticos con el objetivo de ofrecer tratamientos con dosis ajustadas.
Ya que los betalactámicos son antimicrobianos tiempo-dependientes, su eficacia se relaciona principalmente con el parámetro fT> CMI (cantidad de tiempo que la concentración de fármaco libre permanece por encima de la concentración mínima inhibitoria o CMI de la bacteria objetivo). Este porcentaje de tiempo por encima de CMI varía entre los diferentes grupos betalactámicos, siendo mayor para las cefalosporinas y aztreonam que para las penicilinas, y mayor para penicilinas que para carbapenémicos. Estos supuestos deben ser tenidos en cuenta en las pautas de tratamiento.
La duración de la infusión de betalactámicos influye en su fT> CMI y puede mejorarse su perfil farmacodinámico mediante el aumento de la frecuencia de dosificación, las infusiones prolongadas, o las infusiones continuas, sin que por ello aumente la toxicidad. Generalmente se considera que los betalactámicos tienen un alto perfil de seguridad con relativamente pocos efectos adversos, incluso cuando se utilizan altas dosis. La neurotoxicidad (especialmente en forma de convulsiones y mioclonías) es inherente a las altas dosis de los betalactámicos (incluyendo a varias penicilinas), sabiendo que hay condiciones que predisponen para este efecto secundario como la insuficiencia renal, la edad, y una historia previa de trastornos neurológicos.
Tiene sentido valorar el uso de infusiones continuas especialmente si se considera la presencia de cepas bacterianas altamente resistentes, e incluso usando dosis totales diarias más pequeñas, aunque hay que destacar que los resultados de estudios disponibles son contradictorios con respecto a la disminución de la mortalidad y tasas de erradicación bacteriana y de curación clínica. Siguen necesitándose ensayos clínicos grandes para concretar esta cuestión, para lo cual probablemente será necesario estandarizar antes los protocolos de infusión y aclarar la confusión existente entre los diferentes tipos; continua, intermitente y extendida. Mientras tanto, tampoco hay datos que indiquen que la perfusión continua pueda tener más riesgos que la estándar, si bien es cierto que estos antibióticos fueron diseñados, en principio, para una infusión en un periodo corto de tiempo.
El enfoque de monitorizar concentraciones podría ser particularmente útil en un cierto grupo de pacientes críticos en los que lograr concentraciones objetivo es más difícil, como aquellos infectados por patógenos multirresistentes, obesos, inmunocomprometidos, sometidos a TCRR, y pacientes con aclaramiento renal aumentado. Se ha instaurado la monitorización terapéutica de niveles plasmáticos para aminoglucósidos y glicopéptidos para reducir la tasa de toxicidad. Sin embargo, debido al perfil de seguridad de betalactámicos, esto fue considerado innecesario y por el momento no disponemos de ello en la práctica clínica diaria.
Finalmente hay que tener en cuenta que en determinadas situaciones en las que existen alteraciones en la microcirculación, como en el shock séptico y/o dificultades para la difusión por presencia de barreras anatómicas (barrera hematoencefálica, ojo, próstata) habrá una mayor dificultad para que el antimicrobiano alcance concentraciones adecuadas en el foco que queremos tratar conllevando una mayor tasa de fracaso terapéutico (5). La monitorización de niveles farmacológicos en el sitio de acción (liquido alveolar, líquido cefalorraquídeo…) permitiría mejorar los ajustes posológicos y probablemente su eficacia.
Bibliografía
– Gonçalves-Pereira J, Póvoa P. Antibiotics in critically ill patients: a systematic review of the pharmacokinetics of b-lactams. Crit Care. 2011; 15(5):R206. (PubMed) (HTML) (HTML2) (PDF)
– McKinnon PS, Paladino JA, Schentag JJ. Evaluation of area under the inhibitory curve (AUIC) and time above the minimum inhibitory concentration (T>MIC) as predictors of outcome for cefepime and ceftazidime in serious bacterial infections. Int J Antimicrob Agents. 2008 Apr;31(4):345-51. (PubMed)
– Udy AA, Varghese JM, Altukroni M, Briscoe S, McWhinney BC, Ungerer JP, et al. Subtherapeutic initial b-lactam concentrations in select critically ill patients. Association between augmented renal clearance and low trough drug concentrations. Chest. 2012; 142:30–9. (PubMed)
– Abdul-Aziz MH, Lipman J, Akova M, Bassetti M, De Waele JJ, Dimopoulos G, et al. Is prolonged infusion of piperacillin/tazobactam and meropenem in critically ill patients associated with improved pharmacokinetic/ pharmacodynamic and patient outcomes? An observation from the Defining Antibiotic Levels in Intensive care unit patients (DALI) cohort. J Antimicrob Chemother. 2016; 71: 196–207. (PubMed) (HTML)
– Pea F, Viale P, FurlanutM. Antimicrobial therapy in critically ill patients. A review of pathophysiological conditions responsible for altered disposition and pharmacokinetic variability. Clin Pharmacokinet. 2005; 44:1009–34. (PubMed)
Cómo citar: Charco Roca, L. M., Jiménez Vizuete, J. M., Ayelo Navarro, A. (2020). Estrategias de optimización de uso de betalactámicos: La importancia de conocer las particularidades fisiopatológicas del paciente crítico. Revista Electrónica AnestesiaR, 11(9), 3. https://doi.org/10.30445/rear.v11i9.786





