Llagunes Herrero J
FEA Anestesia. H. General Universitario de Valencia
Segunda parte del artículo «Monitorización hemodinámica, de la fisiología a la práctica clínica». Puede leer la primera aquí
Cómo citar este artículo: Llagunes Herrero, J. (2020). Monitorización hemodinámica: de la fisiólogia a la monitorización. Revista Electrónica AnestesiaR, 12(1), 4. https://doi.org/10.30445/rear.v12i1.787
Sistema arterial
La presión arterial (PA)
La generación de la presión arterial se produce por tres tipos de energía: la elástica, la cinética, y gravitacional.
La más importante es la energía elástica: el volumen dentro de las estructuras vasculares distiende sus paredes elásticas y produce una fuerza de retroceso que ejerce una presión. La presión arterial depende así, tanto de la fuerza impulsora debida a la sístole cardíaca como a la retracción elástica arterial junto a la gravedad.
La segunda fuerza determinante de la presión arterial es la cinética. Es la energía producida por la velocidad del flujo de la sangre, siendo esta energía igual a la mitad de la masa de sangre multiplicado por la velocidad al cuadrado (Energía cinética= 1/2 m x V2). A una misma aceleración sanguínea, ejercida por la contracción cardiaca constante, una disminución de la complianza venosa originaría un incremento de la velocidad con lo que la energía cinética se incrementaría a nivel venoso. La energía cinética probablemente tiene un papel más importante en los pacientes con un elevado gasto cardíaco (sepsis), en los cuales el componente cinético es mayor y al mismo tiempo la energía elástica disminuye por la vasodilatación. Esto también explica que en la sepsis exista una gran diferencia entre la presión medida de forma no invasiva y la invasiva, puesto que el método no invasivo detecta mucho más el componente elástico de la pulsación arterial.
La última energía es la gravitacional. Es un factor poco importante con el paciente en posición supina, porque las presiones son bajas, variando entre 4- 10 mmHg. Si puede afectar al cálculo del GC cuando varía la posición del paciente.
La presión sistólica aórtica (PS) aumenta hasta su valor máximo cuando el ventrículo izquierdo expulsa el volumen y genera un flujo de sangre. Durante la relajación posterior del ventrículo esta presión va disminuyendo hasta su valor mínimo; la Presión diastólica (PD). La diferencia entre PS y PD se denomina presión de pulso (PP). El factor que determina la PS es la fuerza y duración de la sístole ventricular, unido a la complianza arterial. El patrón de la onda arterial viene también determinado por la velocidad de propagación de la onda de presión y las ondas de reflexión hacia el corazón desde las arterias periféricas (figura 5 y 6), que a su vez vendrán determinados por el tono vasomotor y el grado de rigidez arterial. El aumento de la velocidad de las ondas reflejadas desde el sistema arterial periférico determina un aumento en el pico de la PS central o aórtica (Fig. 5 y 6). Por otro lado, la PD también depende de la complianza arterial, y a medida que esta disminuye aumenta dicha presión. Reseñar que con la edad existe un aumento de la rigidez arterial con lo que la PD aumenta.
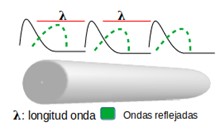
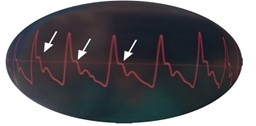
A medida que la onda de presión se desplaza de las arterias centrales a las periféricas existe un aumento de la PS y una disminución de la PD lo que conlleva un aumento de la presión de pulso. Sin embargo, en la presión media (PM) estas diferencias son mucho menores a lo largo de todo el sistema arterial y es por lo que se considera un valor más objetivo, utilizándose como valor de referencia. La presión media puede obtenerse por la fórmula conocida ( PM= [0.33(PS – PD) + PD] ) o mediante métodos digitales obteniendo el área bajo la curva de presión y dividiéndola por el tiempo de su duración (13) .
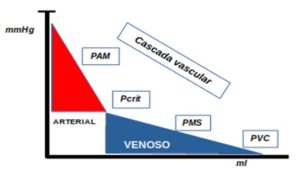
La fisiología CLÁSICA considera la presión auricular derecha como la presión más baja de la circulación sistémica y, por lo tanto, utiliza la presión venosa central para el cálculo de la resistencia vascular sistémica para evaluar el tono vasomotor y guiar la terapia cardiovascular (14). Sin embargo, el sistema arterial en su conjunto se comporta como una resistencia, ya que el flujo de sangre cesa a presiones arteriales positivas muy por encima de la presión venosa, es la llamada presión crítica de cierre (Pcrit) cuyo comportamiento es debido al tono arteriolar y a la presión del tejido que rodea la vasculatura. En otras palabras, la presión arterial y venosa central no se comportan como si los vasos sanguíneos fueran tubos rígidos. Este fenómeno se ha atribuido al cierre de los canales vasculares pese a tener una presión intraluminal arterial positiva, y se relaciona con el tono vascular arterial o arteriolar y con el colapso vascular.
En el estudio de Du et al (15), la presión crítica fue calculada con la extrapolación de la PA a flujo sanguíneo cero en la arteria renal, demostrando en un modelo de endotoxemia como desaparece el gradiente entre la Pcrit y la PMS, siendo esta última superior a la Pcrit. En este caso de endotoxemia se produce una disminución tanto de la PAM como de la Pcrit, disminuyendo el retorno venoso, y por tanto, el GC. En los animales la Pcrit es alrededor de 30 mmHg, pero difiere entre los distintos órganos. En la actualidad la Pcrit no puede medirse de una forma práctica. Sin embargo, sabemos que el uso de la presión auricular derecha o la presión venosa central para el cálculo de la resistencia vascular sistémica produce un error importante, lo que implica que para tener una mayor exactitud en las mediciones deberíamos reescribir el clásico cálculo de las resistencias vasculares sistémicas (RVS):
RVS=PAM-PVC/GC
Debería rescribirse como
RVS=PAM-Pcrit/GC
Constataríamos que las RVS son marcadamente menores al sustituir la PVC por la Pcrit.
La presión de perfusión capilar
Todo lo anterior es importante para entender la perfusión a nivel microvascular; regulada por la resistencia vascular que el propio flujo sanguíneo capilar. Así, la perfusión capilar depende de la diferencia entre la presión de entrada, la presión de salida y el grado de vasodilatación. Debe mantenerse una presión de entrada suficiente para preservar la perfusión de los órganos, influidos por el tono de las arteriolas y los esfínteres precapilares que determinan dicha presión precapilar, que a su vez, dependerá de la PAM y la Pcrit. La presión de salida o postcapilar en cambio, dependerá de la PMS y la presión en aurícula derecha (PVC).
Consideramos así que las resistencias venosas y arteriales determinan la “cascada vascular” que contribuye al mantenimiento de la perfusión de los órganos, incluso en condiciones de flujo disminuido (siempre que se mantenga una PAM por encima de la Pcrit). Cuando la PAM es igual o menor a la Pcrit, la perfusión de los órganos depende exclusivamente de la PAM. Si añadimos una Pcrit igual o menor a la PMS nos encontraremos con la desaparición del gradiente de presión (la cascada vascular) y tratar esta situación con un aumento de la PVC solo producirá un empeoramiento de la perfusión capilar (16).
Flujo capilar= Presión precapilar (Pam-Pcrit)- Presión postcapilar (PMS-PVC)
Elastancia
Además debemos definir el concepto de elastancia como la relación de las variaciones de presión con el volumen:
Elastancia(E)=∆P/∆V
Así, la elastancia es una medida de la tendencia de un órgano hueco (por ejemplo, un vaso sanguíneo o el corazón) a retroceder hacia sus dimensiones originales al eliminar una fuerza de distensión o compresión. A continuación, se explica la elastancia arterial (Ea) o relación de los cambios a nivel aórtico por el volumen eyectado por el corazón, la elastancia ventricular (Ev) o los cambios interventriculares durante la sístole cardiaca y el acoplamiento ventrículo-arterial.
Elastancia arterial
La elastancia arterial (Ea), es la relación entre la presión arterial sistólica y el volumen sistólico, y dado que el flujo arterial es cíclico (no constante) es una medida más real del tono arterial que el cálculo de las RVS, con un valor medio de 2.2 ± 0.8 mmHg/ml. Su cálculo es:
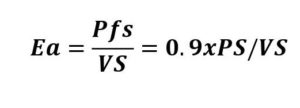
Pfs=presión al final de la sístole (Pfs es 90% de la presión sistólica) y VS= Volumen sistólico y PS es la presión sistólica
En la práctica clínica se puede utilizar la variable: Elastancia Arterial Dinámica (Eadyn), que establece la relación entre la variación de la presión de pulso (VPP) y las variaciones del volumen sistólico (VVS) durante el ciclo respiratorio.
Eadyn=VPP/VVS
Su valor normal es 1. En el estudio de Monge et al (18) un valor inicial de Eadyn > 0,9 predijo un aumento de PAM tras la administración de líquidos con una sensibilidad del 93,75% y una especificidad del 100%. Lo que esto significa que un paciente con un valor de Eadyn <0,9 la carga de líquido no elevará la presión arterial, siendo de elección como terapia inicial los fármacos vasoactivos.
Los propios autores (19), describen en pacientes sépticos que responden a volumen como se produce un incremento del GC (5,5 a 6,3 l/min); sin embargo, existe una disminución de la Ea (1.76 a 1.64 ml/mmHg), con lo que no existe una mejoría en la PAM.
La Elastancia Ventricular
La elastancia ventricular (Ev), es la relación entre la presión y el volumen intraventricular izquierdo. La Ev puede ser calculada como la presión al final de la sístole (Pfs) dividido entre el volumen al final de la sístole (Vfs). Siendo la Pfs= Ps x 0.9. De esta forma necesitamos solo la presión arterial y el cálculo del Vfs mediante ecocardiografía. El valor de la Ev medio es de 2.3 ± 1.0 mmHg/ml.
Ev=PSx0.9/Vfs
Ev: elastancia ventricular, PS presión sistólica y Vfs volumen al final de la sístole
El acoplamiento ventricular-aórtico
Se define como la relación entre la elastancia ventricular y la elastancia aórtica, su acoplamiento o coordinación es esencial en términos de gasto energético cardíaco y perfusión sistémica La relación entre la Ea, como una medida de la carga arterial neta ejercida en el ventrículo izquierdo, y la Ev, como una medida independiente del rendimiento del ventrículo izquierdo, sería una relación que representa el funcionamiento cardiovascular en su conjunto: corazón y sistema arterial (20).
Acoplamiento V-Ao=Ea/Ev
V= ventrículo, Ao= Aorta, Ea= elastancia arterial, Ev=elastancia ventricular
Es decir, mide la relación entre la fuerza o presión generada por la sístole ventricular y los cambios de volumen tanto a nivel ventricular como de la aorta. Esta relación es óptima cuando la relación entre Ea/Ev=1 (valor medio 1.0 ± 0.36). En otras palabras, el sistema cardiovascular funciona mejor cuando se consigue un GC adecuado con un mínimo consumo energético ventricular. Un ejemplo típico es una relación Ea/Ev>1 que ocurre en la insuficiencia cardíaca con disfunción sistólica, por disminución de la elastancia ventricular (Ev), con valores en torno a 1.3-4.3. Al contrario una relación Ea/Ev<1, en los casos de hipertensión arterial sistémica o pulmonar que afectaría al acoplamiento del ventrículo izquierdo o derecho respectivamente.
Postcarga ventricular
Es la presión de la pared miocárdica necesaria para vencer la resistencia o carga de presión que se opone a la eyección de sangre desde el ventrículo durante la sístole. A mayor postcarga, más presión debe desarrollar el ventrículo, lo que supone más trabajo y menor eficiencia de la contracción. Depende de más factores que la propias RVS, es importante tener en cuenta la propia postcarga intraventricular y el acoplamiento ventricular-aórtico (20). La primera postcarga que debe superar el corazón es la intraventricular: La tensión de la pared ventricular o estrés viene determinada, según la ley de Laplace, por el radio interno, la presión de distensión y el espesor de la pared. Así, los ventrículos dilatados tienen mayor radio y por lo tanto mayor tensión de la pared, lo que produce un aumento de la postcarga intraventricular, independiente de la propia postcarga del sistema arterial: RVS y Ea.
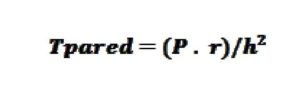
Aplicaciones prácticas en la monitorización hemodinámica
Cuando se habla de «inestabilidad hemodinámica» se suele asociar con una presión arterial anormal o inestable y especialmente con la hipotensión. Desde un punto de vista más amplio, puede ser definida como una perfusión global o regional insuficiente para el adecuado funcionamiento de los órganos o del cuerpo. En la monitorización básica del paciente inestable, además de la PA, se deben monitorizar: el gasto cardíaco y la PVC. Evaluándose el conjunto de resultados con el contexto clínico. También existe controversia sobre la invasividad de la monitorización. Todo esto dependerá de la situación clínica y de la tecnología disponible en cada centro. Otro capítulo aparte sería la monitorización hemodinámica a nivel tisular, véase Tovar MS (21).
La hipotensión
Es el signo más frecuente de alteración hemodinámica, una adecuada presión sanguínea asegura la perfusión coronaria, renal y cerebral, por lo que el punto de partida debe ser tener una medición adecuada y fiable de la presión arterial.
En la práctica clínica es habitual su monitorización cruenta a nivel periférico en la arteria radial, opción simple, sencilla y muy accesible. Sin embargo, en pacientes muy complejos con requerimientos elevados de drogas vasoactivas e inestabilidad, es preferible una arteria central: femoral o axilar, ya que nos dará la presión más próxima al corazón para permitirnos unos cálculos más fiables de la Ea, Ev y del acoplamiento ventrículo-arterial (20). Además, si colocamos los catéteres disponibles de termodilución transpulmonar (Picco®, Volume View ®) casi tendremos hecho la mitad del trabajo, al permitirnos con un acceso venoso central la posibilidad de calcular también el GC para saber si además de una presión de perfusión adecuada existe un flujo adecuado a todos los órganos; es necesario saber el flujo sanguíneo con la medida del gasto cardíaco.
El gasto cardiaco
Hoy día es más fácil determinar su cálculo con los dispositivos actuales. Éstos se dividen según la metodología empleada; ordenados de menos a más invasivo:
Ecocardiografía transtorácica (ETT) y tranesofágica (ETE).
Análisis de la onda de pulso sin calibración: Vigileo®, Moscare-PRAM® y Capstesia® (22).
Análisis de la onda de pulso con calibración: Picco-Pulsión®, LiDCOplus® y ProAQT® (puede establecerse la calibración introduciendo el GC calculado por ecografía).
Termodilución transpulmonar sin indicador mediante sistema Picco®, Pulsión® y con indicador (Litio) LiDCOplus®.
Termodilución pulmonar mediante catéter de Swan-Ganz modificado con oximetría.
Ecocardiografía
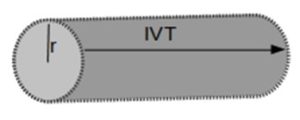
Los actuales ecógrafos tanto ETT o ETE permiten de forma semiautomática obtener el GC, utilizando tres valores: la frecuencia cardiaca, el valor de la Integral de Velocidad Tiempo (IVT: siempre en cm) obtenida con doppler a nivel del tracto de salida del ventrículo izquierdo (TSVI) y la medida del diámetro del TSVI (23).
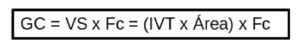
- Al
medir la IVT obtenemos el flujo de sangre que atraviesa el TSVI en cm.
Necesitamos saber el área por la que pasa el flujo de sangre, sabiendo el diámetro del TSVI, el área será:
Área = π x r2 = π x (d/2)
Con la IVT y el área obtenemos el volumen sistólico (VS) que atraviesa el TSVI
Por último, obtenemos GC= Fc x VS en ml. Si lo dividimos por la superficie corporal (BSA) obtenemos el índice cardíaco:
IC= (Fc x VS)/ BSA
Para hacerlo más sencillo, debemos saber que el diámetro del TSVI en mujeres es alrededor de 1.8 cm y en hombre 2 cm; estas cifras se dividen por 2 para obtener el radio; se eleva al cuadrado, y se multiplica por π nos da aproximadamente 3 cm²de área (23). Abreviando el cálculo:
Medimos el valor de IVT, lo multiplicamos x 3 y obtenemos el VS. Luego al multiplicar por la Fc, obtenemos el GC:
GC= (IVT x 3) x Fc ➤ IC= GC/BSA
Es importante destacar que solo con la medida de la IVT nos puede llevar a errores, por simplificación de algunos algoritmos actuales, donde dan como valores normales de la IVT que oscilan entre 18-20 cm, como un GC adecuado. Pero esta simplificación debe interpretarse según la Fc y sobre todo según la superficie corporal y no asimilar una IVT 19 cm con un IC adecuado ej. VTI 19 cm con Fc 75 y BSA de 2 (80 Kg y 1,85m) nos da con el cálculo abreviado. 19 x 3 x 75 = 4275 ml/min que corresponde a un IC 2.1 l/min/m2, un IC bajo y no adecuado en condiciones de necesidad de un aporte de oxígeno elevado (ej. sepsis).
Siempre tener en cuenta las limitaciones de la ecocardiografía:
1.- Necesidad de formación adecuada para realizar cálculos y diagnósticos.
2.- Dificultad en obtener una buena ventana con la sonda transtorácica.
3.- Dificultad en la alineación del flujo aórtico con la sonda transesofágica a nivel del plano transgástrico profundo.
4.- A pesar del uso de medidas estandarizadas, existe un grado de subjetividad y variabilidad del médico que realiza la prueba
Obtener un acceso venoso central, para poder infundir drogas vasoactivas y monitorizar la PVC.
Suele preferirse un acceso a nivel de la vena cava superior, ya sea a través de la vena yugular interna o subclavia. El acceso es sencillo con ecografía minimizando sus posibles complicaciones; en el caso de la v. yugular interna derecha nos permite un acceso recto y directo al corazón, además de una aproximación muy fiable de la medida de la presión venosa central. Respecto a esta última, está demostrado que es un parámetro estático y que no predice la respuesta a fluidoterapia, pero es fundamental si queremos medir el gradiente de retorno venoso al corazón (PMS-PVC) informándonos de la eficiencia del gasto cardiaco e incluso de una disfunción severa del ventrículo derecho. Además, nos permite la obtención de una gasometría venosa central, pudiendo medir la saturación venosa central de oxígeno (SvcO2).
Los siguientes pasos a realizar:
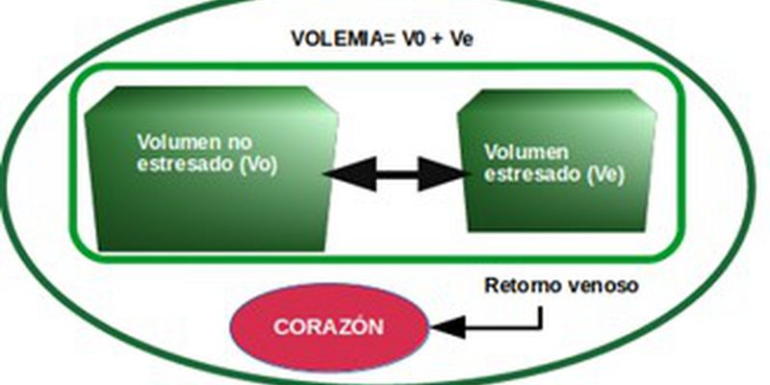
1.-Determinación de la volemia adecuada
2.- Respuesta al volumen
Determinación de la volemia adecuada
Medición de la PMS (Presión Media Sistémica de llenado)
En la actualidad, su uso en la práctica clínica es limitado, pero su medida nos proporciona una aproximación fiable a la volemia del paciente y nos permite de forma indirecta una evaluación del gasto cardiaco y su variación con la terapia vasoactiva utilizada.
- El valor normal de la PMS oscila entre
18-21 mmHg según los estudios realizados, esto nos informa del estado de la
volemia del paciente (volumen estresado -Ve-). Además, el aporte de fluidos nos
da una evidencia clara de que dicho volumen incrementa el Ve: ej. Si
administramos 250 ml de fluido y se incrementa la PMS, nos indica que ese
volumen es efectivo e incrementa el volumen estresado (Ve) es decir aumenta el
volumen efectivo. Pero, si no aumenta el GC ni la PAM significa que el paciente
no responde con un aumento del GC al incremento de volumen al estar en la parte distal de la curva de Frank-Starling y por lo tanto necesitaría
inotropos. . - El gradiente entre las presiones:
PMS-PVC nos indica también si el retorno venoso y por tanto el GC, se
incrementa o disminuye. Si aumenta la diferencia entre estas presiones se
favorece el retorno venoso (incremento
del GC) y por el contrario si disminuye, el gradiente es menor con lo que se
dificulta el retorno venoso y empeoraría el GC.
Dicho gradiente se sitúa entre 7-10 mmHg y además, nos permite calcular la resistencia vascular venosa (Rv) si conocemos el valor del Gasto Cardiaco:
Rv= PMS-PVC/GC
Medida del gradiente de retorno venoso y las resistencias venosas
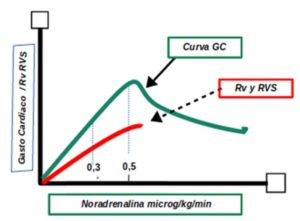
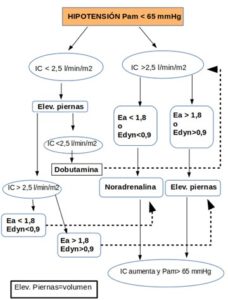
Su cálculo es importante cuando se administra noradrenalina, ya que esta produce un aumento de la volemia transfiriendo parte del volumen no estresado (V0) al volumen estresado (Ve) por vasoconstricción venosa, al aumentar las resistencias venosas (transfiere volemia, sobre todo, del lecho esplácnico) y, a la vez, incrementa a dosis bajas el inotropismo. La dosificación de la noradrenalina de forma excesiva nos puede llevar a una disminución del gasto cardiaco de dos formas (ver Fig 9):
- Con un aumento de las Rv, lo que produce una disminución del retorno venoso con el descenso de la volemia disponible o Ve.
- También produce un aumento las RVS, y por tanto, a un empeoramiento del GC.
Visualización de la vena cava ecográficamente
Los cambios visualizados mediante ecografía en el diámetro de la vena cava inferior (VCI) con la respiración mecánica proporcionan buena aproximación al estado de la volemia del paciente. El diámetro <2.1 cm y una variación que se colapsa > 50% con una inspiración, sugiere un valor de la PVC entre 0-5 mmHg. Un diámetro> 2,1 cm y un colapso menor del 50% durante la inspiración sugieren una PVC elevada, entre 10-20 mmHg (24). La evaluación con ecocardiografía (25) torácica (ETT) de la vena cava inferior (VCI) y de la vena cava superior (VCS) con ecografía transesofágica (ETE) con pacientes en ventilación mecánica (26):
- ∆
VCI > 18% (VCId insp-VCId esp)/ VCI
esp. X 100
- ∆
VCS > 36% (VCSd insp-VCSd esp)/VCS
esp. X 100
Es decir, un cambio durante el ciclo respiratorio superior al 18% medido en la VCI y del 36% en la VCS implican que el paciente necesita volumen y que su administración producirá un incremento del GC y PAM.
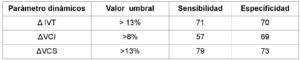
Aunque cada vez son más los artículos que cuestionan su utilidad (27), en el estudio de Charbonneau et al (28), con pacientes sépticos se encontró que la precisión de los cambios inducidos por la ventilación en el diámetro de la vena cava inferior y superior para predecir la respuesta a la administración del fluido era baja. El metaanálisis de Orso D. et al (29), concluye que la evaluación del diámetro de la VCI y su variabilidad respiratoria no parecen ser un método fiable para predecir la respuesta a la administración de fluidos. En el reciente trabajo de Vignon et al (30) donde se analizan los distintos parámetros dinámicos de la respuesta a fluidos en paciente con hipotensión y lactato elevado no relacionado con shock cardiogénico ni obstructivo, obtuvieron los siguientes resultados:
Como se evidencia en la tabla anterior un incremento de la IVT > 13%, implica una respuesta a fluidos, con aumento del GC y la PAM, similar a la variación en la VCS y muy superior a las variaciones en la VCI.
Respuesta a la administración de fluidos
Una práctica habitual en la UCI con un paciente hemodinámicamente inestable es valorar si la administración de fluidos produce un aumento del gasto cardíaco. Lo que significa que el paciente será respondedor si está dentro de la curva de Frank-Starling; al incrementar el volumen la longitud de las fibras miocárdicas se producirá un incremento del GC, al aumentar el volumen eyectado por el corazón.
Sin embargo, en la práctica clínica se administra un bolo de fluido a todos los pacientes y posteriormente se evalúa su efecto sobre la PAM y GC. Lo que es una aproximación inadecuada en ocasiones, ya que sabemos que aproximadamente el 50% de los pacientes no responden a fluidos, Estos hallazgos están en línea con los publicados por Ceconni et al (31), en el estudio observacional realizado en UCIs de todo el mundo, se evidenció que no se utilizó ninguna variable hemodinámica en el 42.7% de los pacientes, siendo la hipotensión, el destete de vasopresores y la oliguria los parámetros más utilizados para determinar la administración de líquidos. En el resto de pacientes se utilizaron:
- Variables estáticas (PVC, PAOP y otras) en el 35.5%,
- Variables dinámicas (VVS, PPV, ecografía) en el 21.9%.
Estos estudios resaltan la necesidad de más formación y más investigación en la estandarización de la administración del bolo inicial de fluidos. La maniobra efectiva del aumento de la volemia con la elevación de las piernas, aporta entre 250-300 ml de volumen para poder evaluar la respuesta al aporte de fluidos, desde el volumen interno del propio paciente y evita el efecto deletéreo de la sobrecarga de fluidos:
Análisis de la onda de pulso y volemia adecuada
El objetivo principal de la administración de líquidos es aumentar la precarga cardíaca, aumentar el retorno venoso y el gasto cardíaco para incrementar el oxígeno a nivel tisular. Mediante el análisis de la variación de la presión de pulso (VPP), del volumen sistólico (VVS) y el del GC con la tecnología del análisis de la onda de pulso se puede predecir esta respuesta.
Los valores de referencia utilizados en la práctica clínica (32), son la variación de la presión de pulso (VPP): > 13%. Valor predictivo 0,94 un parámetro mucho más fiable que la variación del v. sistólico (VVS): > 10%, con un valor predictivo inferior del 0,84 (33). Estos datos contrastan con los estudios que utilizaron la maniobra de elevación pasiva de las piernas en el metanálísis de Monnet et al (34), con una sensibilidad superior al 56% y especificidad del 83 %, para la VPP y un área bajo la curva ROC del 0.77±0.05. Para los cambios inducidos en el GC la sensibilidad combinada fue mayor de un 85 % y una especificidad combinada de 91%. También en el metanálísis de Cherpanath et al (35), los cambios en la VPP presentaron una sensibilidad del 58% y una especificidad del 83%, siendo mucho mejor el aumento del GC, con sensibilidad del 85% y una especificidad del 92%. El valor predictivo de una variable de flujo como es el GC es más fiable que la VPP.
Utilidad del cálculo de la Elastancia Arterial (Ea)
Es un parámetro que podría ser más fiable al cálculo habitual de las RVS, ya que:
RVS= PAM-PVC (Pcrit)/GC
Lo que implica que si existe un GC elevado con hipotensión, las RVS serán bajas. Al contrario, una hipotensión con GC bajo, las RVS serán normales o altas. Por lo que su cálculo no nos ayuda mucho. Eso sin mencionar lo dicho anteriormente respecto al cambio de las PVC por la Pcrit, que implica unas cifras más bajas de las propias RVS a las que estamos acostumbrados.
El cálculo de la Elastancia aortica (Ea) es fácil de obtener. Basta con calcular del volumen sistólico (VS), ya sea por termodilución o por ecocardiografía, y obtener la medida de la presión sistólica (PS), así:
Ea= 0,9 x Ps/VS
También puede obtenerse el cálculo de la Elastancia dinámica (Edyn), obtenido por el análisis de la onda de pulso con o sin calibración.
Edyn= VPP/VVS
Sabiendo que con una Ea < 1,8 ml/mmHg la respuesta al volumen puede ser positiva, pero no mejorará la PAM e IC, lo ideal sería instaurar un tratamiento inicial con noradrenalina, pero manteniendo un IC normal o elevado. Lo mismo ocurre con Edyn, si su valor es < 0,9.
Lo anterior, implica una elevada complianza (C) y por definición ya sabemos que la complianza es la inversa de la elastancia: C=1/E (C=Complianza y E= Elastancia). Estamos ante incrementos de complianza y disminución de la E arterial, lo que conlleva a necesitar elevar la misma con fármacos vasoactivos.
Ver esquema aplicación monitorización: PAM, IC y Elastancia
Conclusión
Es fundamental una buena comprensión de la fisiología cardiovascular para poder aplicar la monitorización adecuada y valorar los cambios a lo largo del tiempo. Es necesario incluir conceptos ya conocidos como la PMS y la E, tanto aortica como dinámica, para poder evaluar y tratar mejor a nuestros pacientes. En un futuro próximo los algoritmos de los monitores hemodinámicos incluirán estas variables y otras muchas que nos proporcionarán herramientas más precisas para el manejo del paciente hemodinámicamente inestable.
Bibliografía
- 1.-Patterson SW, Starling EH. On the mechanical factors which determine the output of the ventricles. J Physiol 1914;48:357-79. (PMC)
- 2.-Guyton AC. Regulation of cardiac output. Anesthesiology 1968;29:314-26. (PubMed)
- 3.- Henderson WR, Griesdale DE, Walley KR and Sheelet AW. Guyton: the role of mean circulatory filling pressure and right atrial pressure in controlling cardiac output. Critical Care 2010;14:243. (PubMed)
- 4.-Rothe CF. Reflex control of veins and vascular capacitance. Physiol Rev 1983; 63:1281–1342. (PubMed)
- 5.-Ripollés-Melchor J, Chappell D, Aya HD, et al Recomendaciones de fluidoterapia perioperatoria para la cirugía abdominal mayor. Revisión de las recomendaciones de la Vía RICA. Parte II: Terapia hemodinámica guiada por objetivos. Fundamento para la optimización del volumen intravascular. Rev Esp Anestesiol Reanim 2017;64:339-47. (HTML)
- 6.- Funk DJ, Jacobsohn E, Kumar A. The role of venous return in critical illness and shock-part I: physiology. Crit Care Med. 2013 Jan;41(1):255-62. (PubMed)
- 7,-Anderson RM. The gross physiology of the cardiovascular system. 2012 ed. Tucson, Arizona: Racquet Press; 1993. (PDF)
- 8.- Maas JJ, ; Pinsky MR; Aarts LP ;. Janse JR. Bedside Assessment of Total Systemic Vascular Compliance, Stressed Volume, and Cardiac Function Curves in Intensive Care Unit Patients Anesth Analg 2012; 115:880–7. (PubMed)
- 9.-Parkin, W.G. & Leaning, M.S. J Clin Monit Comput 2008, 22: 391. (PubMed)
- 10.-He, H., Gruartmoner, G., Ince, Y., van Berge Henegouwen, M., Gisbertz, S., Geerts, B, et al. Effect of pneumoperitoneum and steep reverse-Trendelenburg position on mean systemic filling pressure, venous return, and microcirculation during esophagectomy. Journal of Thoracic Disease, 2018, 10 (6): 3399-3408. (PMC)
- 11. – Maas JJ, Geerts BF, van den Berg PCM, Pinsky MR, Jansen JRC: Assessment of venous return curve and mean systemic filling pressure in postoperative cardiac surgery patients. Crit Care Med 2009, 37:912-918. (PubMed)
- 12. – Maas JJ, de Wilde RB, Aarts LP, Pinsky MR, Jansen JR. Determination of vascular waterfall phenomenon by bedside measurement of mean systemic filling pressure and critical closing pressure in the intensive care unit. Anesth Analg. 2012; 114(4):803-10. (PubMed)
- 13.- Morelli, A. & De Backer, D. The ten principles behind arterial pressure. Intensive Care Med (2018) 44: 911-15. (PubMed)
- 14.- Kottenberg-Assenmacher E, Aleksic I, Eckholt M, Lehmann N, Peters j; Critical Closing Pressure as the Arterial Downstream Pressure with the Heart Beating and during Circulatory Arrest. Anesthesiology 2009; 110 (2):370-379. (PubMed)
- 15. – Du W, Liu D, Long Y and Wang X. The β-Blocker Esmolol Restores the Vascular Waterfall Phenomenon After Acute Endotoxemia. Critical Care Medicine, Volume 45, Number 12, December 2017:1247-1253(7). (PubMed)
- 16. – Magder S. The meaning of blood pressure. Critical Care (2018) 22:257-67. (HTML)
- 17.-Ochagavia A., Zapata L., Carrillo A., Rodríguez A., Guerrero M., Ayuela J.M.. Evaluación de la contractilidad y la poscarga en la unidad de cuidados intensivos. Med Intensiva 2012: Jul ; 36( 5): 365-374. (PDF)
- 18.-Monge García MI, Gil Cano A, Gracia Romero M. Dynamic arterial elastance to predict arterial pressure response to volume loading in preload-dependent patients. Crit Care. 2011;15(1):R15. (PubMed)
- 19.- Monge García, M. I., Guijo González, P., Gracia Romero, M., Gil Cano, A., Oscier, C., Rhodes, A., et al (2015). Effects of fluid administration on arterial load in septic shock patients. Intensive Care Medicine, 41(7), 1247–1255. (PubMed)
- 20.- Chantler PD, Lakatta EG, Najjar SS. Arterial-ventricular coupling: mechanistic insights into cardiovascular performance at rest and during exercise. J Appl Physiol (1985). 2008;105(4):1342-51. (PubMed)
- 21.- Tovar Doncel MS. Visualizando más allá de la macrohemodinamia https://anestesiar.org/2017/visualizando-mas-alla-la-macrohemodinamia. Last access Enero 2019.
- 22.-Barrachina B, Cobos R, Mardones N, Castan A and Vinuesa C. Assessment of a smartphone app (Capstesia) for measuring pulse pressure variation: agreement between two methods.A Cross-sectional study. Eur J Anaesthesiol 2016;33:1–6. (PubMed)
- 23.- In Critical and Acute Care Ultrasound: A Comprehensive Book on Critical and Acute Care Ultrasound (CACU), edited by Manu Malbrain. Chapter 9 (pag 109) CGuy L.J. Vermeiren, Manu L.N.G. Malbrain, Jeroen M.J.B. Walpot. Cardiac Ultrasonography in the critical care setting: a practical approach to assess the cardiac function and preload for the “non – cardiologist”. ©2017 International Fluid Academy. (HTML)
- 24,- Ochagavía A, Baigorri F, Mesquida J, Ayuela JM, Ferrándiz A, García X, Monge MI, et al. Grupo de Trabajo de Cuidados Intensivos Cardiológicos y RCP de la SEMICYUC. Hemodynamic monitoring in the critically patient. Recomendations of the Cardiological Intensive Care and CPR Working Group of the Spanish Society of Intensive Care and Coronary Units. Med Intensiva Vol. 38. Núm. 3. 2014 : 133-200. (PubMed)
- 25.- Vieillard-Baron A, Chergui K, Rabiller A, Peyrouset O, Page B, Jardin F. Superior vena caval collapsibility as a gauge of volume status in ventilated septic patients.Intensive Care Med. 2004;30:1734–39. (PubMed)
- 26,- Barbier C, Loubieres Y, Schmit C, Hayon J, Ricome JL, Jardin F, et al. Respiratory changes in inferior vena cava diameter are helpful in predicting fluid responsiveness in ventilated septic patients. Intensive Care Med. 2004;30:1740-46. (PubMed)
- 27.- Via, G., Tavazzi, G., & Price, S. (2016). Ten situations where inferior vena cava ultrasound may fail to accurately predict fluid responsiveness: a physiologically based point of view. Intensive Care Medicine, 42(7), 1164–1167. (PubMed)
- 28.- Charbonneau H, Riu B, Faron M, Mari A, Kurrek MM, Ruiz J, et al. Predicting preload responsiveness using simultaneous recordings of inferior and superior vena cavae diameters. Crit Care. 2014;18:473. (HTML)
- 29.- Orso, D., Paoli, I., Piani, T., Cilenti, F. L., Cristiani, L., & Guglielmo, N. Accuracy of Ultrasonographic Measurements of Inferior Vena Cava to Determine Fluid Responsiveness: A Systematic Review and Meta-Analysis. J Intensive Care Med. 2018 Jan 1-10. Doi 10.1177/0885066617752308 (PubMed)
- 30.- Bentzer P, Griesdale DE, Boyd J, MacLean K, Sirounis D, Ayas NT. Will This Hemodynamically Unstable Patient Respond to a Bolus of Intravenous Fluids? JAMA. 2016; 316 (12):1298–1309. (PDF)
- 31.- Cecconi, M., Hofer, C., Teboul, JL. Pettila V, Wilkman E, Molnar Z. et al. Fluid challenges in intensive care: the FENICE study. Intensive Care Med 20151; 41: 1529. (PubMed)
- 32.- Vignon P, Repessé X, Bégot E, Léger J, Jacob C, Bouferrache K, et al. Comparison of Echocardiographic Indices Used to Predict Fluid Responsiveness in Ventilated Patients. AJRCCM 2017; 195 (8):1022-32. (PubMed)
- 33.- Xiaobo Yang, Bin Du. Does pulse pressure variation predict fluid responsiveness in critically ill patients? A systematic review and meta-analysis. Crit Care 2014, 18 (6):650. (PubMed)
- 34.-Monnet X, Marik P, Teboul JL. Passive leg raising for predicting fluid responsiveness: a systematic review and meta-analysis. Intensive Care Med 2016;42: 1935-47. (PubMed)
- 35.-Cherpanath TG, Hirsch A, Geerts BF, Lagrand WK, Leeflang MM, Schultz MJ, et al. Predicting Fluid Responsiveness by Passive Leg Raising: A Systematic Review and Meta-Analysis of 23 Clinical Trials. Crit Care Med 2016;44: 981-91. (PubMed)
Cómo citar: Llagunes Herrero, J. (2020). Monitorización hemodinámica: de la fisiólogia a la monitorización. Revista Electrónica AnestesiaR, 12(1), 4. https://doi.org/10.30445/rear.v12i1.787