López Herrero R (1), Sánchez Quirós B (1), Lomo Montero FJ (2).
(1) MIR Anestesia y Reanimación. Hospital Clínico Universitario de Valladolid.
(2) Adjunto Anestesia y Reanimación. Hospital Clínico Universitario de Valladolid.
Cómo citar este artículo: López Herrero, R., Sánchez Quirós, B., & Lomo Montero, F. J. (2021). Manejo anestésico de paciente con Hemofilia tipo A. A propósito de un caso. Revista Electrónica AnestesiaR, 13(1). https://doi.org/10.30445/rear.v13i1.886
Introducción
La hemofilia, en términos generales, es un trastorno de la coagulación de origen genético, con un patrón hereditario recesivo asociado al cromosoma X. Es importante conocer que la tercera parte de las personas hemofílicas no tienen antecedentes familiares de este trastorno, tratándose de una mutación de novo1.
Se pueden distinguir varios tipos de hemofilia dependiendo del déficit de factor de coagulación que se tenga. Hablaremos de hemofilia tipo A cuando existe un déficit de factor VIII y tipo B si hay déficit del factor IX.
La hemofilia A tiene una incidencia de 1 de cada 5000 recién nacidos vivos de sexo masculino, mientras que para la B es de 1 de cada 300002,3.
Esta patología afecta fundamentalmente a los varones, siendo las mujeres portadoras. Ellas podrían presentar dicha enfermedad en situaciones especiales como, por ejemplo, en el Síndrome de Turner o en situaciones de consanguinidad (heredando dos cromosomas X mutados, uno del padre hemofílico y el otro de la madre portadora)1.
Debemos sospechar la presencia de hemofilia en pacientes con propensión a la aparición de hematomas, hemorragias espontaneas y hemorragias excesivas tras un traumatismo o una cirugía.
Caso clínico
Presentamos el caso de un varón de 18 años y 60 kg de peso, sin alergias medicamentosas y antecedentes de Hemofilia A leve (niveles de factor VIII del 40%) diagnosticada hace 17 años. Recibió factor VIII recombinante a los tres años de vida como profilaxis en cirugía de amigdalectomía sin incidencias.
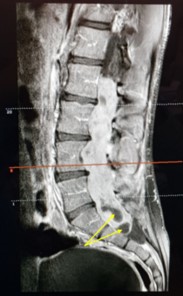
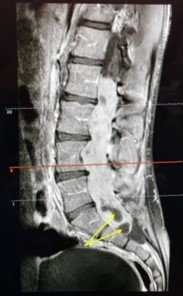
Es valorado por lumbalgia mecánica no irradiada con parestesias inferiores y debilidad de la marcha de varios meses de evolución. Se realizó una resonancia magnética (RM) con contraste donde se objetivó una tumoración intratecal probablemente dependiente del filum terminale desde L1-L2 hasta S1 (imagen 1).
En el preoperatorio presentaba radiografía de tórax, electrocardiograma y ecocardiograma normales, hemoglobina 16,1 g/dL, hematocrito 48,3%, plaquetas 348 x 103/ µL, TTPA 43,4 segundos, ratio de TTPA 1,33, índice de protrombina 90%, niveles de factor VIII 30,4%. Tras consultar con el servicio de hematología se decidió pautar factor VIII recombinante 1500 unidades internacionales (UI) iniciándose media hora antes de la inducción anestésica (es necesario esperar desde su administración al menos diez minutos para la realización de técnicas invasivas4). La coordinación entre hematología, anestesiología y neurocirugía se planificó cuidadosamente antes de la intervención quirúrgica.
Previa a la inducción anestésica se canalizaron dos vías venosas periféricas de calibre 16 Gauges (G) y de 20 G. Por la vía del calibre 20G, se administró únicamente el factor VIII.
En el quirófano se monitorizó electrocardiograma, presión arterial invasiva, profundidad anestésica con sistema de Sedline y monitorización neurofisiológica de potenciales evocados somatosensoriales de las cuatro extremidades, motores transcorticales y electromiograma. No se realizó una monitorización de la relajación muscular por parte de anestesia.
La inducción anestésica se realizó mediante la administración de Propofol a 2 mg/Kg, fentanilo a 1 µg/kg y rocuronio a 0,6 mg/kg. Se procedió a la intubación orotraqueal con tubo número 7 sin incidencias. Se fijaron unos parámetros ventilatorios de FiO2 de 0,5, volumen tidal de 7 ml/kg y 12 respiraciones por minuto. Posteriormente, se procedió a la canalización de la arteria radial izquierda mediante técnica de Seldinger y de vena yugular interna derecha eco guiada sin incidencias inmediatas. Se situó al paciente en decúbito prono protegiéndose las zonas de presión, colocando un Guedel almohadillado (se revistió la cánula con gasas) y evitando movimientos forzados de las articulaciones.
El mantenimiento anestésico se estableció mediante anestesia total intravenosa con sistema TCI (Target controlled infusion system) con remifentanilo (dilución de 20 mcg/ml) concentración efecto objetivo de 2-5 ng/ml según modelo Minto, propofol a 3-4 µg/ml según modelo Schnider y sin relajación muscular por la monitorización neurofisiológica. La temperatura corporal se mantuvo entre 36-37ºC utilizando manta térmica.
A las tres horas del comienzo de la cirugía se realizó una determinación del factor. Los valores obtenidos fueron de 55,30%, por lo que se decidió suministrar 1500 UI.
Pasadas tres horas volvimos a evaluar los niveles, obteniendo valores de factor del 88,4%. Ante la presencia de niveles por encima del 80%, se decidió no administrar más dosis intraoperatorias.
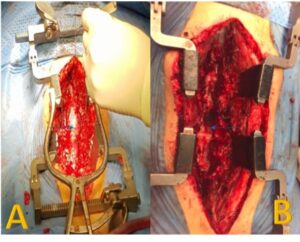
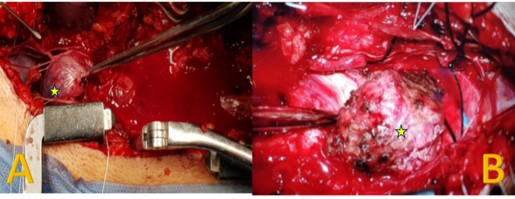
La intervención quirúrgica (laminectomía bilateral L2 a S1 con exéresis parcial de láminas y resección de toda la lesión tumoral) duró 10 horas. El paciente estuvo estable hemodinámicamente, no precisando vasopresores para control tensional. Presentó un sangrado total de 400 mililitros, no siendo necesaria la transfusión (imagen 2 y 3).
El paciente fue trasladado intubado a la Unidad de Reanimación, donde se extubó sin incidencias a las 2 horas de su llegada. Se realizó una monitorización del factor VIII a las 4 y 12 horas del fin de la intervención quirúrgica, ya que los pacientes con hemofilia A leve tienen más riesgo de desarrollar factores inhibidores5. En nuestro caso se objetivó una actividad del 100 % a las 4 horas y del 85,8 % a las 12 horas del ingreso en la unidad (tabla 1).
Al tratarse de una cirugía mayor importante se requerían valores de factor postoperatorio entre el 60-80%3, por lo que se decidió administrarlo cada 12 horas (vida media del factor6) durante dos días, observándose una actividad del 72% al tercer día.
En el postoperatorio no se evidenció sangrado manteniendo niveles de hemoglobina dentro de rango de normalidad (valor mínimo de 14,1 g/dL). Estuvo hemodinámicamente estable sin necesidad de vasopresores. Se realizó un adecuado control analgésico con paracetamol 1gramo/8 horas y metamizol 2 gramos/8 horas, precisando analgesia de rescate con cloruro mórfico. Presento una adecuada exploración neurológica movilizando adecuadamente las cuatro extremidades.
A las 24 horas del ingreso en la unidad el paciente fue dado de alta a planta sin incidencias y a los 7 días del hospital.
Discusión
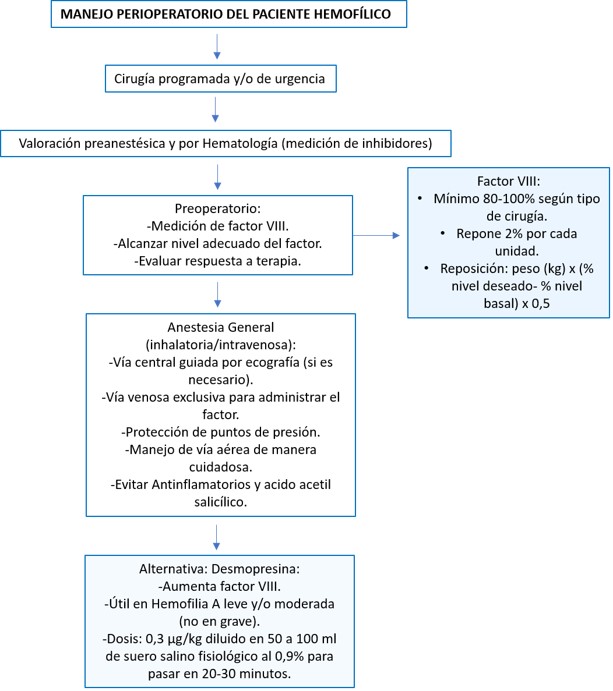
La cirugía en un paciente con hemofilia requiere un enfoque multidisciplinar que combine la experiencia del hematólogo, anestesiólogo y del cirujano. El objetivo terapéutico es corregir la deficiencia del factor antes, durante y después de la intervención quirúrgica.
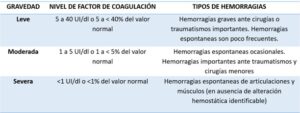
La hemofilia es una enfermedad hemorrágica recesiva ligada al cromosoma X. Presenta una incidencia de 1,5 casos por millón por año7. Se presenta sobre todo en edades avanzadas8. La principal manifestación clínica es la hemorragia. Su gravedad en los pacientes hemofílicos guarda relación con la cantidad de factor que presentan (tabla 2).
Las manifestaciones hemorrágicas son variadas, los principales sitios de hemorragias son las articulaciones, los músculos y los tejidos blandos9. La clínica que presentan los pacientes con hemofilia A y B es similar, algunos estudios indican que los sangrados son más frecuentes en los pacientes con hemofilia A y tienen peor pronóstico10.
Es necesario realizar una historia clínica de los antecedentes familiares, tipo y lugar de sangrado en pacientes en los que se sospecha hemofilia. Se realizan estudios de coagulación, en los que el tiempo de protrombina y el tiempo de sangrado son normales. Característicamente el tiempo de tromboplastina parcial activado (TTPa) está prolongado de manera aislada, aunque en pacientes con hemofilia leve puede ser normal. El diagnostico se confirma por la presencia de niveles bajos de factor VIII o IX en hemofilia A y B respectivamente. En estos pacientes es necesario realizar un diagnóstico diferencial con la enfermedad de Von Willebrand. Además, el hematólogo debe excluir la presencia de anticuerpos inhibidores del factor VIII. En nuestro caso, el paciente no presenta dichos anticuerpos.
Para el tratamiento perioperatorio, la cirugía de columna debe considerarse de alto riesgo hemorrágico en pacientes hemofílicos (tabla 3). El objetivo debe ser mantener una actividad de factor VIII entre 80 y 100% del valor considerado como normal. El paciente debe tener un valor de factor adecuado para poder realizar la intervención quirúrgica. Por cada UI/kg infundido de concentrado de factor VIII, hay un aumento del 2% en su nivel plasmático11. El número de unidades necesario sería el resultado de multiplicar la mitad del peso en kilogramos del paciente por el aumento deseado de la concentración del factor VIII en tanto por cien (peso (kg) x (% nivel deseado – % nivel basal) x 0,5). En nuestro paciente: 60 kg x (100-52) x 0,5=1440. El factor debe infundirse lentamente por vía intravenosa a una tasa que no exceda el volumen de 3 ml/min3.
En nuestro caso, en un primer momento no conseguimos niveles adecuados de factor, por lo que tuvimos que repetir una dosis adicional del mismo, tras su administración, alcanzamos valores dentro del rango previsto, siendo el tratamiento eficaz para una adecuada hemostasia en el periodo intra y postoperatorio12.
Se ha descrito la aparición de inhibidores que actúan sobre el factor VIII tras dosis repetidas del mismo.
También se puede utilizar desmopresina a dosis de 0,3 µg/kg diluido en 50-100 ml de suero salino fisiológico 0,9% para pasar en infusión en 30 minutos (presenta un pico de acción a los 90 minutos), que aumentan el factor VIII y el factor Von Willebrand, siendo de utilidad en hemofilia A leve o moderada, pero no en la severa3.
En el preoperatorio, el anestesiólogo debe realizar una adecuada evaluación física, examinado el estado de las articulaciones, buscar hematomas espontáneos y valorar la vía aérea. Nuestro paciente presentaba una exploración física sin ninguna alteración, un Mallampati clase I, una distancia tiromentoniana grado I (mayor de 6,5 cm) y un test de mordida clase I.
El consumo de factores de coagulación aumenta considerablemente durante la cirugía. El anestesista debe asegurarse de que las técnicas anestésicas utilizadas presentan el menor riesgo de sangrado.
A pesar de que el paciente presente una cantidad adecuada de factor VIII es necesario tener una serie de precauciones:
-Posición en el quirófano: es necesario cuidar la posición del paciente en la mesa del quirófano y evitar movimientos forzados de las articulaciones, ya que los pacientes presentan mayor riesgo de sufrir luxaciones y fracturas13. En nuestro caso, almohadillamos todas las articulaciones, e introducimos un Guedel almohadillado en la boca para evitar posibles lesiones en las mucosas que se pueden producir por el estímulo neurofisiológico.
-La inducción debe de ser suave, dejando un tiempo necesario para la acción y el efecto de los medicamentos administrados. Existen varios métodos para conseguirlo, se puede realizar una inducción anestésica con propofol en bolo titulando las dosis según monitorización electroencefalográfica hasta conseguir pérdida de consciencia, como hicimos en nuestro caso. O se puede conseguir mediante una infusión objetivo-controlada con el sistema TCI modelo farmacocinético Marsh, por ejemplo, con concentración objetivo plasmática (Ca) de 2 µg/ml.
Es necesario evitar la anestesia superficial o medicamentos como la succinilcolina para que no ocurran contusiones musculares, por el riesgo de sangrado muscular que presentan estos pacientes. Aunque no se han demostrado interacciones farmacológicas de los agentes anestésicos con el factor VIII, se prefiere que los medicamentos usados vayan por un acceso venoso diferente. También se puede producir la trombosis de la vía por la que se administra el factor.
-Manejo de la vía aérea: debe ser extremadamente cuidadoso para evitar la formación de hematomas. No se recomienda de rutina el uso de videolaringoscopios, ya que en ocasiones pueden producir lesiones en la cavidad oral. Estas lesiones aparecen fundamentalmente durante la inserción bucal del dispositivo y sobre todo si el paciente presenta una cavidad orofaríngea pequeña. Los tubos deben estar previamente lubricados para reducir el roce con la mucosa y hay que evitar la intubación nasotraqueal. También tendríamos que evitar la colocación de sondas nasogástricas para evitar lesiones por sangrado.
-Canalización de vía venosa para infundir el factor VIII: se requiere un acceso venoso estable y sin complicaciones, por este motivo las venas periféricas representan la opción preferente14. Si necesitamos canalizar una vía venosa central se aconsejan niveles de factor VIII superiores al 80% y realizar la técnica guiada con ecografía15. El uso de una vía central para infundir el factor VIII está asociado a una tasa de complicaciones elevadas como infección y oclusión trombótica.
-La hipertensión arterial y la taquicardia no son deseables, ya que aumentan el riesgo de sangrado.
-Debe evaluarse el uso de antiinflamatorios no esteroideos para el control del dolor. El ácido acetil salicílico está contraindicado y el ibuprofeno está asociado a un ligero aumento del sangrado. La utilización de opioides intravenosos son de mayor utilidad para el control del dolor agudo postoperatorio. En nuestro caso, la analgesia perioperatoria se llevó a cabo con perfusión de remifentanilo y la postoperatoria con Paracetamol, Metamizol y cloruro mórfico.
-Se aconseja la extubación del paciente suave sin que se produzca reflejo de la tos. Para conseguirlo se puede realizar una “extubación profunda” que consiste en extubar al paciente cuando se encuentre en un plano anestésico profundo para disminuir el riesgo de laringoespasmo, el reflejo de la tos o el movimiento previo a la extubación. También se puede administrar lidocaína intravenosa a dosis de 1mg/kg ya que disminuye el reflejo tusígeno. La aspiración de la orofaringe debe ser cuidadosa. Nuestro paciente fue extubado sin incidencias en la Unidad de Reanimación.
Conclusiones
Cualquier intervención quirúrgica en un paciente hemofílico puede ser peligrosa, aumentando el riesgo de sangrado. La preparación preoperatoria es esencial para obtener resultados positivos. Es importante un adecuado manejo interdisciplinar entre el hematólogo, anestesista y cirujano. Es fundamental realizar varias mediciones de los niveles de factor en el periodo pre, intra y postoperatorio. Si dichos niveles son inferiores a los requeridos debemos de realizar una infusión de los mismos para evitar que aparezca sangrado. Todas estas medidas son fundamentales para que el procedimiento transcurra con éxito.
Bibliografía
- García-Chavez J, Majluf-Cruz. Hemofilia. Gac. Med. Mex. 2013;149(3):308-21.(PubMed)
- Castaman G, Matino D. Hemophilia A and B: molecular and clinical similarities and differences. Haematologica 2019; 105(9):1702-1709 (PubMed)
- Federación Mundial de la Hemofilia. Guías para el tratamiento de la Hemofilia. 2ª ed. Montreal: Blackwell Publishing; Ltd 2012. (pdf)
- Sociedad Argentina de Hematología. Guía para el manejo de la Hemofilia congénita. Consenso de Médicos especialistas en Hemofilia de la Republica de Argentina. 2017 (pdf)
- Kempton CL, Soucie J, Miller CH, Hooper C, Escobar MA, et al. In non-severe hemophilia A the risk of inhibitor after intensive factor treatment is greater in older patients: a case-control sudy. J Thromb Haemost 2010;8(10):2224-31 (PubMed)
- Tiede A.Half-life extended factor VIII for the treatment of hemophilia A. J Thromb Haemost 2015;13 (Suppl.1):S176-S9 (PubMed)
- Collins PW, Mccartney N, Davies R, Lees S, Giddings J, Majer R. A population based unselected, consecutive cohort of patients with acquired haemophilia A. Br J Haematol 2004;124:86-90. (PubMed)
- Green D. The management of acquired haemophilia. Haemophilia 2006;12(Suppl 5):32-6 (HTML)
- Srivastava A, Brewer AK, Mauser-Bunschoten EP, Key NS, Kitchen S, Llinas A, et al. Guidelines for the management of hemophilia. Haemophilia 2013;19(1):e1-47. (PubMed)
- Venkateswaran L, Williams JA, Jones DJ, Nuss R. Mild haemophilia in children: Prevalence, complications, and treatment. J Pediatr hematol Oncol. 1998;20(1):32-5 (HTML)
- Gyanesh P, Dhiraai S. Anesthetic management of a patient with hemophilia A with spontaneous acute subdural hematoma. J Anaesthesiol Clin Pharmacol 2013;29(1):117-120 (PubMed)
- Haya S, Moret A, Cid AR, Cortina V, Casaña P, Cabrera N, et al. Inhibitors in haemophilia A: current management and open issues. Haemophilia. 2007;13(Supple 5):52-60 (PubMed)
- Caicedo MV, Raffan-Sanabria F, Duarte-Romero M. Manejo perioperatorio del paciente hemofílico. revista mex de anestesiología. 2009; 32 (3):177-185. (pdf)
- Santagostino E, Mancuso ME. Venous access in haemophilic children. Haeemophilia. 2010;16 Suppl1:20-24 (PubMed)
- Ewenstein BM, Valentino LA, Journeycake JM, Tarantino MD, Shapiro AD, Blanchette VS, et al. Consensus recommendations for use of central venous access devices in haemophilia. Haemophilia 2004;10:629-648 (PubMed)





Gracias estimada doctora Rocío López. Muy educativo. Preciso, conciso, buena lectura de una redacción adecuada y entendimiento.