Flores García JA (1), López Torres J (2), Íñiguez de Onzoño-Pérez (2), Cifuentes García B (1)
(1) Médico Interno Residente de Anestesiología y Cuidados Intensivos. Complejo Hospitalario Universitario de Albacete.
(2) Facultativo Especialista de Área de Anestesiología y Cuidados Intensivos. Complejo Hospitalario Universitario de Albacete.
Introducción
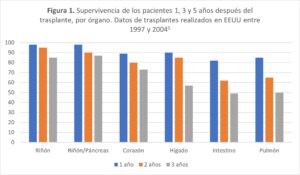
El número de pacientes con insuficiencia renal terminal se ha incrementado en los últimos años (figura 1). El tratamiento de elección en la enfermedad renal crónica en fase terminal es el trasplante renal (1). El trasplante renal es el trasplante de órgano sólido más realizado (2), desde hace décadas ha demostrado una mejora en la calidad de vida y una reducción del riesgo de mortalidad en comparación con los pacientes que se mantienen en tratamiento dialítico (3).
Son numerosos los factores que influyen en la supervivencia del paciente y del injerto a largo plazo como la presencia de comorbilidades significativas, fundamentalmente patologías cardiacas y pulmonares. A pesar de los avances, las complicaciones médicas y quirúrgicas siguen representando importantes causas de morbilidad y mortalidad (4). Por este motivo es de vital importancia optimizar los cuidados postoperatorios en una unidad de cuidados intensivos (UCI).
El objetivo de la presente revisión es describir los aspectos más importantes de manejo dentro del postoperatorio inmediato del trasplante renal.
Manejo postoperatorio del receptor de trasplante renal
Evaluación inicial
El receptor de un trasplante renal requiere vigilancia intensiva en una UCI (2), al menos durante las primeras horas postoperatorias. Los objetivos de la estancia del paciente en estas Unidades son mantener la estabilidad hemodinámica del paciente con el fin de asegurar la perfusión del injerto y optimizar su función, revertir la hipotermia, ajustar la fluidoterapia y controlar el dolor postoperatorio. Además, se iniciará o continuará el tratamiento inmunosupresor y la profilaxis antibiótica (5).
Es conveniente obtener información acerca del balance hídrico intraoperatorio, posibles episodios de hipotensión o pérdidas sanguíneas durante la intervención, medicamentos utilizados o alteraciones electrolíticas (6). También es importante recabar información acerca de los eventos quirúrgicos, así como el aspecto del riñón tras el desclampaje (1). Se ha visto que las complicaciones intraoperatorias durante la cirugía de trasplante de riñón son poco comunes. Se ha descrito hemorragia durante la anastomosis de los vasos ilíacos, pero no es frecuente. Estas complicaciones vasculares, aunque son infrecuentes, son devastadoras y pueden llevar a la pérdida del injerto (7).
El seguimiento clínico del paciente trasplantado renal exige el control de diferentes parámetros. La monitorización de tensión arterial (TA), frecuencia cardiaca (FC), temperatura, saturación periférica de oxígeno (SpO2) y frecuencia respiratoria (FR) se realizará desde la llegada del paciente a la unidad hasta el momento del alta.
Es importante la vigilancia del débito de los drenajes quirúrgicos, así como el aspecto de los apósitos con el fin de evidenciar un posible sangrado postoperatorio.
Un aspecto básico es el control de la diuresis a través de sonda vesical. La vigilancia del gasto urinario durante el postoperatorio inmediato es de vital importancia porque en las primeras horas postrasplante, el paciente puede presentar desde anuria hasta poliuria superior a los 500 mL/hora. Se ha demostrado que el inicio inmediato de producción de orina es predictor de buen pronóstico para el injerto y el paciente (1).
Otro de los aspectos a tener en cuenta es el cuidado de la fístula arteriovenosa (FAV) de diálisis, especialmente al ingreso y al alta. Se han descrito eventos como la trombosis de la FAV durante la cirugía o en el postoperatorio inmediato (6).
Monitorización del injerto renal
Es fundamental el control analítico de sangre y orina durante el postoperatorio inmediato y en días sucesivos (6). Entre los parámetros de interés se incluyen, de forma evidente, una bioquímica sanguínea que incluya urea y creatinina y gasometrías seriadas para el control de iones. Además, será necesaria la vigilancia del hemograma y los parámetros de la coagulación.
La presencia de una reducción en la producción de orina durante las primeras horas de postoperatorio puede corresponderse con una disfunción temprana del injerto (8). Si se sospecha una causa prerrenal, relacionada con la pérdida directa de líquidos intravasculares o la disminución relativa de volumen circulante, el tratamiento es la expansión de volumen (2). En cambio, las causas postrenales, como la obstrucción ureteral, la trombosis vascular y la hemorragia, pueden requerir una reexploración quirúrgica temprana.
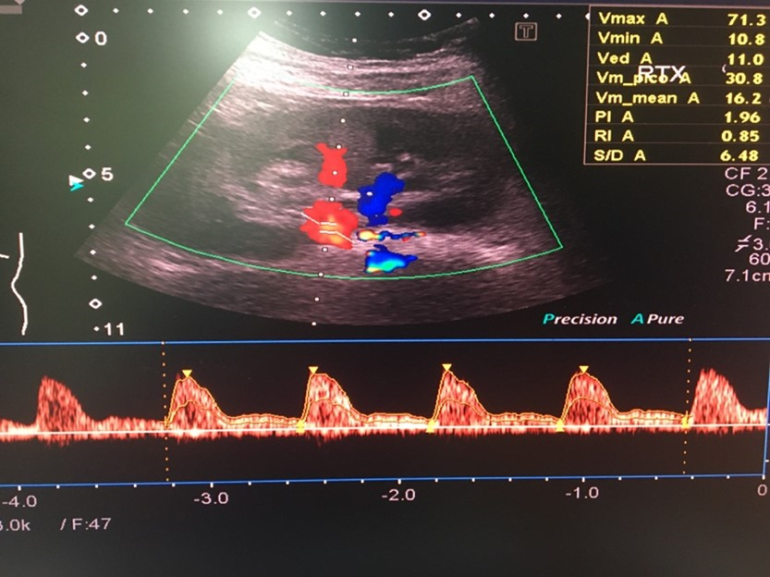
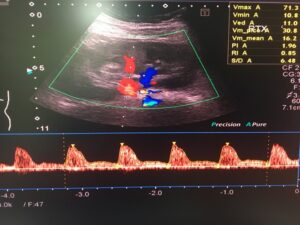
La función del injerto en el período postoperatorio inmediato se ve influida por una combinación de factores del donante, el receptor y el intraoperatorio. Casi el 50% de los trasplantes se complican por retraso de la función del injerto, que en última instancia es secundaria a la lesión por isquemia-reperfusión (7). En este sentido, la ecografía doppler renal (imagen 1) y los estudios radioisotópicos (gammagrafía renal) suponen una gran ayuda a la hora de identificar complicaciones precoces, proporcionando una información basal muy valiosa a la hora de realizar la evaluación del injerto. La ecografía doppler renal realizada a pie de cama permite descartar complicaciones agudas como el sangrado, la hidronefrosis, la dehiscencia vascular, la estenosis arterial, la trombosis venosa o el infarto renal. Además, permite cuantificar alteraciones en el flujo del injerto (3).
Tratamiento farmacológico
Reposición de fluidos
Una de las razones del fracaso del injerto después del trasplante renal es una mala perfusión ocasionada por un inadecuado manejo de la hidratación perioperatoria. Se ha descrito que la insuficiencia del injerto aumenta la susceptibilidad de rechazo y está asociada a un 20-40% en la disminución de su supervivencia, por lo que prevenirla e intervenir antes de que se instaure el daño es esencial (1).
Los pacientes sometidos a trasplante renal están sujetos a una amplia variedad de complicaciones intraoperatorias, como inestabilidad hemodinámica, alteraciones en el equilibrio ácido-base y electrolitos debido a la alteración de la función renal y sus comorbilidades asociadas. El mantenimiento del volumen intravascular durante la cirugía es fundamental para garantizar la perfusión y la función óptimas del injerto (9). El objetivo es la expansión intraoperatoria del volumen para aumentar el flujo sanguíneo renal y mejorar la función de los injertos2.
Los cristaloides son los líquidos de reposición mayoritariamente utilizados y, entre éstos, el suero salino fisiológico al 0,9% ha sido el más comúnmente utilizado por la ausencia de potasio, minimizando el riesgo de arritmias inducidas por electrólitos (1). Sin embargo, este tipo de solución puede producir hipercloremia y acidosis. Es habitual que se utilice también una combinación de salino fisiológico y glucosalino en diabéticos para evitar hipoglucemias. Se han publicado estudios comparando diferentes soluciones cristaloides (Ringer Lactato, suero salino fisiológico y Plasmalyte), concluyendo que las tres pueden ser utilizadas con seguridad; sin embargo, el mejor perfil metabólico se mantiene en los pacientes que reciben Plasmalyte (9).
Otro de los aspectos relacionados con la reposición de volumen son los balances hídricos. Se suele recomendar que estos balances sean neutros o ligeramente positivos. De acuerdo con la evolución, las soluciones intravenosas suelen disminuirse progresivamente en las primeras 24-48 horas coincidiendo con el inicio de la ingesta hídrica oral adecuada a las necesidades del paciente.
Si la diuresis no es óptima (<1 mL/kg/h) se pueden añadir coloides para aumentar la presión oncótica, así como el uso de diuréticos de asa. Se ha propuesto la utilización de coloides en un intento de evitar la sobrecarga excesiva de volumen y evitar el edema intersticial por el perfil de este tipo de soluciones (7). Sin embargo, no se ha logrado demostrar los beneficios de estas soluciones en comparación con los cristaloides (2).
Por otro lado, el uso de agonistas adrenérgicos está asociado a vasoconstricción renal y deterioro de la función del injerto, lo cual debe ser tenido en cuenta considerando, por otro lado, la necesidad de mantener una presión arterial adecuada para garantizar el flujo sanguíneo hacia el injerto (7).
La administración de soluciones intravenosas se ha guiado tradicionalmente en función de la presión venosa central (PVC), utilizándose valores objetivo en torno a 10-15 mmHg (1). No obstante, la terapia con fluidos debe ser individualizada y, hoy en día, la tendencia es basarla en parámetros dinámicos del volumen intravascular derivados del análisis de la onda de pulso arterial, en caso de estar disponible (variación de la presión sistólica, variación de la presión del pulso y variación del volumen sistólico). Estos parámetros, que son la base de la terapia quiada por objetivos (GDT, del inglés Goal Directed Therapy) son actualmente un predictor más preciso de la capacidad de respuesta de los fluidos, en comparación con los parámetros estáticos o tradicionales (10). La GDT durante el trasplante de riñón podría reducir considerablemente la tasa de complicaciones perioperatorias y aumentar la tasa de supervivencia del injerto, así como a evitar las consecuencias de la sobrecarga hídrica del paciente (10).
Durante el postoperatorio, un buen indicador del estado óptimo de hidratación del paciente lo constituye el peso del paciente, intentando mantener éste en torno al 5% de variación por encima del peso seco (1).
Tratamiento diurético
No existe suficiente evidencia acerca de que el uso perioperatorio de diuréticos disminuya la incidencia de necrosis tubular aguda (NTA) ni mejore la supervivencia del injerto renal (1). El tratamiento diurético se utilizará para forzar la diuresis en presencia de NTA oligúrica y en situaciones de sobrecarga hídrica (6). Cada paciente necesita un régimen intra y postoperatorio individualizados respecto al uso de diuréticos según el estado de volumen, las comorbilidades asociadas, etc. El gasto urinario debe ser medido de forma horaria durante las primeras 24 horas y diariamente hasta que la función del injerto esté estable, de acuerdo con las guías KDIGO (1).
Tratamiento analgésico
Diversas series internacionales han documentado que el 80% de los sujetos que son intervenidos quirúrgicamente presentan dolor postoperatorio. El manejo analgésico durante el periodo postoperatorio del trasplantado renal es muy importante, debido a que una analgesia insuficiente se puede asociar a oliguria o retención urinaria (11). Por otro lado, el incremento de la frecuencia cardiaca asociada al dolor modifica el gasto cardiaco y favorece la presencia de isquemia renal (1).
Dado que el enfermo candidato a recibir un trasplante renal tiene, por definición, anormalidades importantes en la tasa de filtrado glomerular y a que durante el postoperatorio presenta alto riesgo de trombosis e isquemia renal, los antiinflamatorios no esteroideos (AINEs), incluyendo los inhibidores selectivos de la ciclooxigenasa-2 (COXIB), están contraindicados en este grupo de enfermos (11). Por otro lado, el paracetamol, aunque presenta una reducción en la excreción urinaria de sodio y agua de forma similar a los AINEs, no inhibe la función plaquetaria ni produce irritación de la mucosa gastrointestinal, haciéndolo un analgésico seguro para este grupo de pacientes (11).
Algunos opioides, como la morfina, la hidromorfona, la meperidina y la oxicodona presentan eliminación renal en mayor o menor medida, por lo que, en enfermos con una reducción de la tasa de filtrado glomerular, existe el riesgo de acumulación y de potenciación de los efectos adversos (11). Por otro lado, otros opioides como el remifentanilo parecen disponer de un mejor perfil de seguridad al ser metabolizados por esterasas plasmáticas, presentar vidas medias cortas o ultra-cortas y no acumularse en los enfermos con insuficiencia renal terminal (11). Los efectos adversos de este tipo de fármacos incluyen depresión respiratoria, hipertensión, náuseas, vómitos y prurito. Estos efectos son más comunes en personas con enfermedad renal e insuficiencia renal terminal. Por otro lado, otros analgésicos opioides como la buprenorfina y la nalbufina carecen de eliminación renal y en teoría pueden utilizarse en este grupo de enfermos (1).
Respecto a la analgesia locorregional, el uso de técnicas neuroaxiales para el control del dolor postoperatorio de los pacientes trasplantados renales se ha visto limitado debido a las alteraciones de la coagulación propias del paciente urémico, a la heparinización residual de la diálisis preoperatoria y a la elevada frecuencia de tratamiento antiagregante en este grupo de pacientes. La analgesia epidural parece eficaz para el control del dolor postoperatorio, pero debe evitarse cuidadosamente la vasodilatación excesiva y los posibles episodios de hipotensión asociados (12). En cuanto a los bloqueos nerviosos del plano ilioinguinal e iliohipogástrico y del plano transverso del abdomen (TAP), los estudios realizados no han mostrado disminución de los requerimientos de opiáceos en el periodo postoperatorio (2).
Profilaxis infecciosa
Diversos estudios observacionales han encontrado elevada incidencia de infección de vías urinarias en receptores de trasplante renal (13). Una complicación frecuente es la pielonefritis, la cual se ha visto que puede causar rechazo del injerto, sepsis e incluso muerte. La prescripción profiláctica de trimetoprim-sulfametoxazol ha demostrado reducir la frecuencia de infecciones bacterianas, aunque no existen estudios que señalen un aumento en la supervivencia del injerto o una reducción de la mortalidad a largo plazo con el uso de este antibiótico. Se recomienda, no obstante, que todos los pacientes sometidos a trasplante renal reciban este antibiótico durante, al menos, 6 meses (13).
La neumonía por Pneumocystis jirovecii se trata de una micosis oportunista que suele afectar las vías respiratorias inferiores. Suele aparecer entre las 6-8 semanas después de iniciar la terapia inmunosupresora. Por ello, está indicada la profilaxis con trimetoprim-sulfametoxazol durante 6 meses para reducir el riesgo de la infección (14).
La infección por tuberculosis suele aparecer como reactivación de algún foco previo por Mycobacterium tuberculosis. Los pacientes con mayor riesgo son quienes padecen infección tuberculosa latente, manifestada por una prueba cutánea de derivado proteico purificado positiva, con antecedente de tuberculosis o evidencia radiológica, sin tratamiento adecuado. Estos pacientes son candidatos para recibir profilaxis con isoniazida durante dos meses (6).
Varios estudios observacionales han evidenciado una elevada incidencia de candidiasis oral y esofágica (13). La prescripción de inmunosupresores convencionales aumenta su incidencia. La fuente de infección más común es la colonización de la cavidad oral. No existen suficientes estudios que fundamenten el tratamiento antifúngico de rutina (13).
Inmunosupresión
Tras el trasplante renal, es fundamental conseguir un equilibrio entre el efecto inmunosupresor de los fármacos y la respuesta inmunológica del huésped con el fin de evitar las infecciones oportunistas (15).
La introducción de los inmunosupresores anticalcineuríticos (Tacrolimus), antilinfoproliferativos (Micofenolato de Mofetil) e inhibidores de la enzima diana de rapamicina (Sirolimus/Everolimus) disminuyó las tasas de rechazo agudo en el trasplante renal y aumentó la supervivencia del injerto en el postrasplante inmediato. No obstante, el uso de estos fármacos también parece estar asociado a un mayor índice de complicaciones quirúrgicas postrasplante (16).
La pauta de inmunosupresión ha de ser estrechamente vigilada para mantener una cobertura antirrechazo adecuada. La monitorización de los niveles de estos fármacos constituye una herramienta primordial en el tratamiento del trasplante. Existe un estrecho margen terapéutico entre la toxicidad y el riesgo de presentar un rechazo (6).
No hay consenso universal sobre el mejor régimen inmunosupresor (15). Se suele utilizar una triple terapia con metilprednisolona, micofenolato y tacrolimus. En casos de pacientes con alto riesgo inmunológico (trasplante previo, donante vivo no relacionado, número de incompatibilidades HLA, donante fallecido), se puede asociar una inducción con globulinas antilinfocito o anti-IL-2a receptor (ATGAM, timoglobulina, OKT3, basiliximab, daclizumab) (1).
Complicaciones médicas
Oliguria/anuria
Cualquier disminución aguda de la producción de orina (oliguria definida como diuresis < 500 mL en 24 horas o < 0,5 mL/kg/h; y anuria como diuresis < 100 mL en 24 horas) ha de ser investigada de forma inmediata (2). Puede ser de origen mecánico prerrenal, por falta de flujo vascular en forma de estenosis o trombosis venosa o arterial. Los factores mecánicos postrenales incluyen la obstrucción o dehiscencia ureteral y la compresión extrínseca renal.
Una vez descartadas estas causas mecánicas habrá que vigilar la posible hipovolemia, la hipotensión, la NTA o el rechazo hiperagudo, que se pueden objetivar monitorizando los parámetros de volemia o con una biopsia del injerto.
La oligoanuria y la anuria, especialmente en pacientes en los que se espera una diuresis inmediata, es una urgencia diagnóstica y va a requerir pruebas de imagen para comprobar la vascularización del injerto o la presencia de colecciones que compriman la vía urinaria (17).
Anemia
No existen evidencias que justifiquen el uso sistemático de agentes estimuladores de eritropoyetina en el postrasplante renal inmediato (18). Sin embargo, se ha descrito que el tratamiento de la anemia postrasplante con agentes estimuladores de la eritropoyesis en pacientes con disfunción crónica del injerto disminuía el requerimiento de transfusiones, se asociaba con un mayor requerimiento de tratamiento antihipertensivo, enlentecía la progresión de la insuficiencia renal y mejoraba la calidad de vida de los pacientes (18).
Debido a la alta incidencia de patología cardiovascular asociada, es aconsejable mantener una hemoglobina mínima en torno a 8-9 g/dL en el postoperatorio inmediato, utilizando si es preciso las transfusiones de hematíes. Se ha estudiado que cifras de hemoglobina superiores a 10 g/dL no son necesarias e incluso pueden ser contraproducentes (1).
Complicaciones cardiovasculares
Está demostrado que el paciente trasplantado renal presenta un elevado riesgo cardiovascular (6). Las complicaciones cardiovasculares son la causa más frecuente de muerte en pacientes trasplantados renales (7).
La hipertensión arterial (HTA) es muy común en pacientes que se someten a un trasplante renal, describiéndose una prevalencia de hasta el 80%. Ésta es a menudo exacerbada durante el periodo postrasplante por múltiples factores, como el aumento del volumen intravascular, el dolor postoperatorio, la suspensión preoperatoria de fármacos antihipertensivos, el uso de inmunosupresores (esteroides, inhibidores de calcineurina) y con menor frecuencia, la estenosis de la arteria renal (1).
La HTA contribuye a la morbimortalidad del paciente trasplantado y tiene efectos nocivos en el injerto renal, puesto que la denervación conlleva una inapropiada autorregulación hemodinámica del injerto. A diferencia de los riñones nativos, el tejido renal del donante carece de capacidad para autorregular el flujo sanguíneo renal (1).
El control temprano de la TA tiene el potencial de influir en el desarrollo de la función retrasada del injerto e, inclusive, del rechazo. Si la TA es superior a 160/90 mmHg debe suspenderse todo fármaco vasoactivo, incluso en presencia de oligoanuria (1). Como es lógico, se debe evitar el uso de inhibidores selectivos de la enzima convertidora de angiotensina (IECAS) y de antagonistas de los receptores de angiotensina-II (ARA-II) por el riesgo de disfunción renal.
Necrosis tubular aguda
La NTA se define como la necesidad de diálisis durante la primera semana postrasplante debido a un estado de oliguria o anuria con presencia de deterioro de la función renal (6). Es la causa más frecuente de disfunción precoz del injerto (17). Los factores de riesgo más importantes para su aparición son el tiempo de isquemia prolongado, la edad avanzada del donante o del receptor y la hipotensión arterial.
Se trata de un daño por isquemia-reperfusión en el que la restitución de flujo al injerto, tras horas de isquemia, incrementa el daño celular (17). Se manifiesta por oliguria o anuria que aparecen generalmente en las primeras 24 horas postrasplante, y suele resolverse espontáneamente en menos de 15 días en la mayoría de los casos (6).
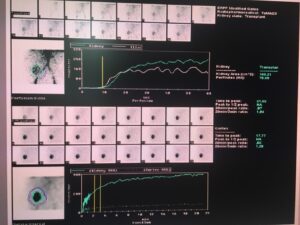
Su diagnóstico es clínico. Sin embargo, es necesario realizar en las primeras 24 horas postrasplante una ecografía renal y un estudio isotópico (imagen 2) para demostrar la presencia de vascularización intrarrenal (6). La realización de una biopsia renal a partir de los 7 días posteriores al trasplante suele permitir descartar la presencia de rechazo agudo sobreañadido o nefrotoxicidad (19).
Complicaciones quirúrgicas
Las complicaciones quirúrgicas constituyen una entidad peligrosa después del trasplante renal y pueden desembocar en la pérdida del injerto (20). Estas complicaciones afectan a un paciente monorreno y debilitado por una enfermedad renal crónica y por la recién instaurada inmunosupresion. Por ello, es importante el diagnóstico y tratamiento precoces
La incidencia de complicaciones quirúrgicas después del trasplante renal oscila, según las series, entre el 1 y el 25%. El perfeccionamiento de la técnica quirúrgica ha reducido en gran medida las complicaciones quirúrgicas y las tasas de morbilidad y mortalidad en los receptores (4). Aunque la mayoría de las complicaciones quirúrgicas provienen principalmente de aspectos técnicos, las características de los receptores y del donante también tienen una influencia decisiva (20).
El desarrollo de complicaciones quirúrgicas parece disminuir la supervivencia del injerto, aunque algunos estudios indican que la supervivencia del injerto a largo plazo no se ve afectada (20).
Trombosis de la arteria renal
La trombosis de la arteria renal es la complicación vascular menos frecuente, y su incidencia varía del 0,9 al 3,5% (20). El signo más importante en la trombosis de la arteria renal es el cese instantáneo del flujo de salida de orina debido a la ausencia de perfusión del injerto y la presencia de HTA no explicada por otras causas. En estos pacientes se recomienda la realización de una ecografía Doppler a pie de cama (4). La trombosis de la arteria renal es una emergencia quirúrgica, siendo necesaria una exploración inmediata en quirófano con el objetivo de restaurar el flujo sanguíneo renal (4).
Estenosis de la arteria renal
La estenosis de la arteria renal representa la complicación vascular más frecuente, con una incidencia entre el 1% y el 23% (4). Es una causa relativamente frecuente y potencialmente reversible de HTA refractaria y de disfunción de los injertos, y se presenta aproximadamente entre el 1% y el 5% de los casos de HTA postrasplante (4). Normalmente aparece entre los 3 meses y los 3 años después del trasplante renal, pero pueden presentarse en cualquier momento (4). El diagnóstico se basa en un deterioro inicial de la función renal con aparición de HTA refractaria (20). Como pruebas complementarias se pueden emplear técnicas de imagen como la ecografía doppler o la resonancia magnética, aunque el gold estándar sigue siendo la arteriografía (20). Para el tratamiento, se pueden considerar tres opciones: tratamiento médico con IECAs, intervención quirúrgica (by-pass de la arteria renal) o angioplastia transluminal percutánea con o sin colocación de stent (4).
Trombosis de la vena renal
La trombosis de la vena renal suele ocurrir durante los primeros 7 días después del trasplante, con una incidencia del 4-6% (20). Las presentaciones clínicas de esta complicación incluyen oliguria o anuria repentinas acompañadas de dolor o hematuria y/o hemorragia que pueden poner en peligro la vida del paciente debido a la ruptura del injerto (4). La ecografía doppler informaría de un injerto aumentado de tamaño y una ausencia de flujo venoso con una inversión de éste en la diástole (20). El tratamiento se basa en la exploración quirúrgica inmediata con trombectomía venosa para restablecer el flujo sanguíneo. Si este tratamiento no es posible, se puede llegar a realizar la nefrectomía del injerto (4).
Conclusión
El desarrollo de complicaciones, así como su diagnóstico y tratamiento precoz, va a influir en la supervivencia del injerto y del paciente a corto, medio y largo plazo, por lo que resulta fundamental conocerlas bien y saber actuar en base a su diagnóstico y tratamiento oportuno.
Es esencial mantener una buena hidratación, con objetivo de que el paciente esté ligeramente hipervolémico, para asegurar la perfusión del injerto. Debe monitorizarse de forma horaria la diuresis y realizar las pruebas diagnósticas necesarias en caso de anuria u oliguria.
El manejo analgésico durante el periodo postoperatorio del trasplantado renal es muy importante, debido a que una analgesia insuficiente se asocia a peores resultados.
Tras el trasplante renal, es fundamental conseguir un equilibrio entre el efecto inmunosupresor de los fármacos y la respuesta inmunológica del huésped con el fin de evitar las infecciones oportunistas
Bibliografía
- Rivera Luna EN, Cruz Santiago J, Meza Jiménez G, Bernáldez Gómez G, Moreno Ley PI. Manejo perioperatorio en el receptor de trasplante renal. Hospital de Especialidades Centro Médico Nacional «La Raza» IMSS. Rev Mex Traspl. 2016; 5(1): 27-33. (PDF)
- Uptodate. Hendrikus JM Lemmens. Anesthesia for kidney transplantation [sede Web]. 2020. UpToDate, Waltham, MA. (HTML)
- Roldán Reina AJ, Egea Guerrero JJ, Palomo López N, Cuenca Apolo DX, Adriaensens Pérez M, Martín Villén L. Postoperatorio de trasplante renal en unidad de cuidados intensivos: evaluación del injerto mediante técnicas de imagen. Medicina Intensiva. 2019; 43(6): 384-386. (HTML)
- Haberal M, Boyvat F, Akdur A, Kırnap M, Özçelik Ü, Yarbuğ Karakayalı F. Surgical Complications After Kidney Transplantation. Exp Clin Transplant. 2016; 14(6): 587-595. (PubMed)
- Steadman RH, Wray CL. Anestesia para el trasplante de órganos abdominales. En: Miller RD, Cohen NH, Eriksson LI, Fleisher LA, Wiener-Kronish, Young WL. Miller Anestesia. 8a edición. Madrid: Elsevier; 2015. 2262-2291.
- Cofan F, Torregrosa JV. Manejo clínico del paciente trasplantado renal de donante vivo. Arch Esp Urol. 2005; 58(6): 531-536. (HTML)
- Mittel AM, Wagener G. Anesthesia for Kidney and Pancreas Transplantation. Anesthesiol Clin. 2017; 35(3): 439-452. (PubMed)
- Tocancipá DR, Tejada Perdomo JH, Medina Herrea A, et al. Complicaciones anestésicas en trasplante renal. Rev Col Anest. 2011; 39(1): 30-37. (PDF)
- Hadimioglu N, Saadawy I, Saglam T, Ertug Z, Dinckan A. The effect of different crystalloid solutions on acid-base balance and early kidney function after kidney transplantation. Anesth Analg. 2008; 107(1): 264-9. (PubMed)
- Cavaleri M, Veroux M, Palermo F, Vasile F, Mineri M, Palumbo J, et al. Perioperative Goal-Directed Therapy during Kidney Transplantation: An Impact Evaluation on the Major Postoperative Complications. J Clin Med. 2019;8 (1): 80. (PubMed)
- Covarrubias Gómez A. Manejo del dolor postoperatorio en el enfermo con trasplante renal. Rev Mex Anest. 2009; 32(1): 148-153. (HTML)
- Kar SK, Khurna HS, Ganguly T. Anesthesia management of renal transplantation: an update. Anaesth Pain & Intensive Care. 2018; 22(3): 383-390. (HTML)
- Cortázar Benítez LF, González Patiño MA, Barbosa Zamora A, Pardinas Llergo MJ, Rodríguez Weber F, et al. Infecciones tempranas postrasplante renal. Med Int Mex. 2018; 31(5): 559-566. (PDF)
- Garg N, Jorgenson M, Descourouez J, Saddler CM, Parajuli S, Astor BC, et al. Pneumocystis jiroveci pneumonia in kidney and simultaneous pancreas kidney transplant recipients in the present era of routine post-transplant prophylaxis: risk factors and outcomes. BMC Nephrol. 2018; 19(1): 332. (BMC)
- Oppenheimer F, Pascual J, Pallardó L. Inmunosupresión en el trasplante renal. En: Lorenzo V, López Gómez JM (Eds). Nefrología al día. Inmunosupresión en el trasplante renal. Disponible en: https://www.nefrologiaaldia.org/241. Consultado 16 Dec 2020.
- Quicios Dorado C, Burgos Revilla FJ, Pascual Santos J, Marcén Letosa R, Gómez García I, García Navas R, et al. Inmunosupresión y complicaciones quirúrgicas post-trasplante renal. Arc Esp Urol. 2006; 59(7): 697-705. (HTML)
- Pérez Tamajon L. Complicaciones médicas precoces en el trasplante renal. En: Lorenzo V, López Gómez JM (Eds). Nefrología al día. Complicaciones médicas precoces tras el trasplante renal. Disponible en: https://www.nefrologiaaldia.org/140. Consultado 09 Dec 2020.
- Moreso F, Alegre R, Ariceta G, Beneyto I, Bernis C, Calvo N, et al. Tratamiento de la anemia postrasplante renal. Nefrología Sup Ext. 2011; 2(2): 16-24. (PDF)
- Garay Padrón RA, López Romero J, Cruz Abascal RE, Pérez de Armas RA, Hernández Hernández PE, López Soler JC. Complicaciones médicas en el trasplante renal inmediato. Medicentro. 2004; 8(2). (HTML)
- Barba Abad J, Rincón Mayans A, Tolosa Eizaguirre E, Romero Vargas L, Rosell Costa D, Robles García JE, et al. Complicaciones quirúrgicas en el trasplante renal y su influencia en la supervivencia del injerto. Actas Urol Esp. 2010; 34(3), 266-273. (HTML)