Ferreras Vega R (1) Ahern Espinosa H (1) Méndez Marín, MD (1) Jiménez Huerta I (2)
(1) FEA adjunto anestesia pediátrica del H.U 12 de Octubre, Madrid.
(2) FEA adjunto otorrinolaringología del H.U 12 de Octubre, Madrid.
Cómo citar este artículo: Ferreras Vega, R., Ahern Espinosa, H., Méndez Marín, M. D., & Jiménez Huerta, I. . (2023). Abordaje de una vía aérea difícil conocida en paciente pediátrico con síndrome de Pfeiffer. Utilidad de la oxigenoterapia de alto flujo. Revista Electrónica AnestesiaR, 15(8). https://doi.org/10.30445/rear.v15i8.1149
La vía aérea del niño tiene una entidad propia, con diferencias anatómicas y fisiológicas con el adulto como por ejemplo: presencia de occipucio prominente con tendencia en supino a la posición en flexión de la cabeza que, junto al mayor tamaño de la lengua y la hipertrofia del tejido linfoide predispone a la obstrucción de la vía aérea y a la mayor resistencia al paso del aire (1).
Se considera una vía aérea difícil (VAD) aquella en la que un médico experimenta dificultad en la ventilación con mascarilla facial, laringoscopia o la intubación. En un entorno de emergencia, esto también incluye la dificultad para realizar una vía aérea quirúrgica, como la cricotiroidotomía (2).
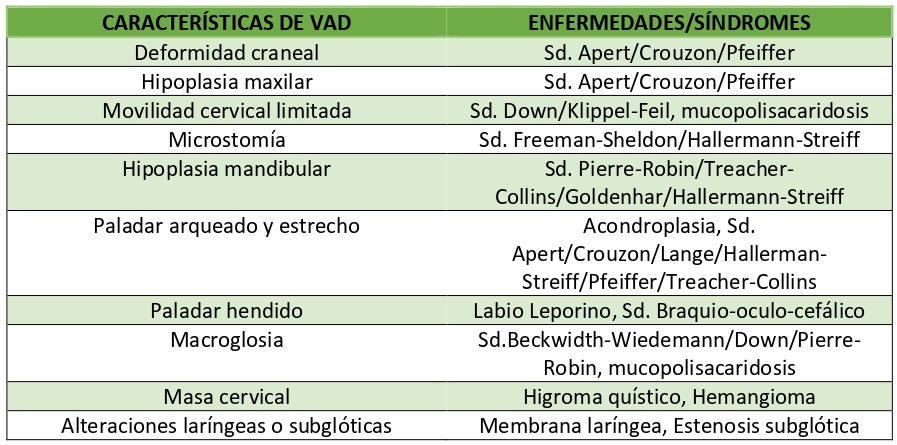
Las malformaciones congénitas que afectan a la anatomía facial o a la restricción del movimiento de las estructuras mandibulares o cervicales son de especial relevancia, debido a que son causa de vía aérea difícil (Tabla I). Dentro de estas se encuentra el síndrome de Pfeiffer. Se trata de una rara afectación congénita (1/ 100.000), que se expresa como acrocefalosindactilia asociada a craneosinostosis (generalmente bicoronal), hipoplasia mediofacial y malformaciones de las manos y de los pies (3). Además, puede presentarse malformación de Chiari asociada o adquirida a consecuencia de las deformidades craneales (4), con lo que existe limitación del movimiento cervical en las maniobras de manipulación de la vía aérea.
El objetivo de este caso clínico es presentar el manejo de una VAD en un varón de 13 años con diagnóstico de Síndrome de Pfeiffer tipo 2 asociado a malformación de Arnold-Chiari, con antecedentes de VAD (dificultad de ventilación con mascarilla facial, dificultad en la colocación de mascarilla laríngea e imposibilidad de intubación con fibrobroncoscopia nasal debido a las necesidades quirúrgicas).
Descripción
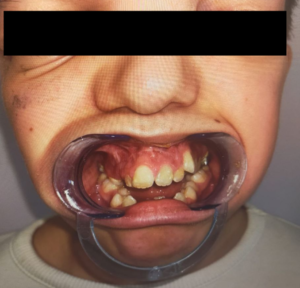
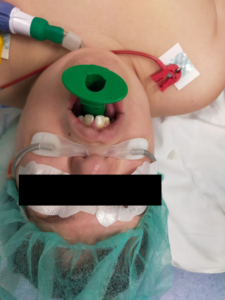
Varón de 13 años con antecedentes de síndrome de Pfeiffer tipo 2 y asociado a Chiari; portador de derivación ventrículoperitoneal por hidrocefalia, proptosis ocular, apnea obstructiva del sueño, con necesidad de CPAP (presión positiva continua en vía aérea) buconasal nocturna, obstrucción de coana derecha en un 75% (fotografia 1-3), limitación de la movilidad de la articulación temporomandibular, macroglosia y presencia de expansor palatino. Se trata de un paciente colaborador con desarrollo psicomotor normal.
Intervenido de: craniectomía bifrontal (2009) y avance frontal, reapertura y avance anterior (2010), craniectomía occipital y resección arcos posteriores C1 y C2 (2011), avance monobloc (2011), fijación cervical (elementos posteriores de C2-C3), retirada de distractores mandibulares (2020) y corrección de pie valgo (2021).
Dado el empeoramiento en la obstrucción nasal se realiza evaluación por otorrinolaringología (ORL) por sospecha de mucocele de senos parafrontales. En la exploración, realizada por el otorrinolaringólogo, de la vía aérea superior se describe: fosa nasal derecha colapsada, fosa nasal izquierda con buen paso. Cavum libre. Orofaringe libre I/IV. Amígdalas linguales levemente hipertróficas. Epiglotis en omega y leve anteversión aritenoidea pero sin colapso supraglótico y permitiendo ver cuerdas vocales con movilidad normal. Ante esta exploración se decide realizar cirugía endoscópica nasosinusal (CENS) tipo draf III, de ambas fosas nasales, que permitirá la apertura del seno frontal para conectar las fosas.
Preoperatorio
El paciente, es evaluado en la consulta de preanestesia. Se reseñan sus antecedentes de VAD conocida recogida en informes anteriores: VAD conocida, laringoscopia directa (Cormack Lehane IV), se ha conseguido intubación orotraqueal (IOT) usando fibrobroncoscopia nasal desde narina izquierda. Además, aparecen descritos fracasos previos en: videolaringoscopia e intubación orotraqueal (IOT) mediante fibrobroncoscopia vía oral a través de mascarilla laríngea (LMA), por no conseguir la adaptación correcta de la misma, aunque si permitía ventilación. Sin embargo, en la última cirugía de pie valgo se describe empeoramiento en el manejo de la ventilación manual (HAN III) e imposibilidad de colocar LMA tipo Auragain ® nº 3 como rescate por limitación de flexo-extensión cervical, macroglosia e hipertrofia amigdalar, realizando IOT a través de fibrobroncoscopia nasal de urgencia.
Tras detallar en el historial la VAD y sus características (mediciones e historial), los padres son informados de riesgos perioperatorios, remarcando la previsión de un abordaje de vía aérea dificultoso con posibilidad de traqueostomía urgente si fallasen las técnicas alternativas, así como de ingreso posoperatorio en la Unidad de Reanimación pediátrica. También, desde consulta se pone en conocimiento del anestesista que será programado en la cirugía para facilitar la planificación previa.
El anestesiólogo responsable del intraoperatorio revisa el caso en conjunto con equipo quirúrgico. Cirugía precisa de una intubación oral (dado el abordaje quirúrgico), y el anestesiólogo decide que la estrategia más segura para conseguir este objetivo, en este paciente, es el uso del fibrobroncoscopio de inicio, manteniendo respiración espontanea. Dada la edad del paciente estas maniobras precisan tener lugar bajo sedación. También informa del caso a un segundo anestesiólogo para solicitar su ayuda durante este proceso.
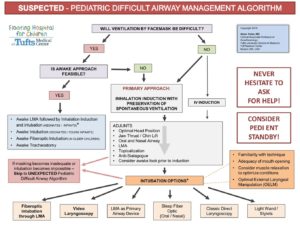
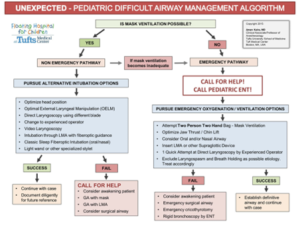
Teniendo en cuenta planes alternativos, que van desde despertar al paciente hasta el abordaje traqueal quirúrgico (planes del algoritmo de VAD) (Algoritmo-1), el equipo de anestesia analiza antes del procedimiento los siguientes puntos de dificultad:
Tiempo y oxigenación: Los antecedentes previos hacen previsible un procedimiento prolongado por lo cual la oxigenación adecuada del paciente es un reto. Para facilitarlo se opta por la oxigenoterapia con alto flujo aprovechando narina permeable, que de otro modo se tendría que hacer con gafas nasales convencionales o incrementando las pausas durante la maniobra de intubación oral con el fibrobroncoscopio.
Sedación: en el prequirófano puede optarse por la vía oral o nasal pero durante el intraoperatorio dadas las dificultades descritas recientemente en la ventilación manual, el uso de la vía intravenosa es planteado como primera opción sobre la inhalatoria. Se prioriza la ventilación espontánea, por ello la ketamina es un fármaco con interés en este caso, sin embargo, la sialorrea puede plantear un problema. Por lo que finalmente, se decide desarrollar un plan sedoanalgésico mediante la premediación con atropina y la terapia combinada con anestesia local y dexmedetomidina para disminuir dosis de ketamina.
Ventilación manual: conociendo los problemas previos se opta por mascarilla facial con sellado neumático dada la posibilidad de adaptarla mejor a la malformación maxilar.
Intubación oral: selección de la cánula oral (VAMA) para facilitar el avance del FB y la intubación. Sin embargo, solo existe un tamaño disponible da la cánula VAMA, por lo que como alternativa al fracaso se adapta una cánula de Guedel nº 3 mediante apertura de la misma con bisturí.
Extubación: la retirada del tubo endotraqueal como primera opción se decide efectuarla en el quirófano y con colocación de un intercambiador de Cook, pero también se considera la posibilidad de traslado de paciente en ventilación mecánica invasiva, y extubación en Unidad de Reanimación pediátrica, o incluso la necesidad de traqueostomía durante el procedimiento.
Fungibles: el quirófano debe tener disponible mascarilla facial con sellado neumático. Laringoscopio Macintosh con palas del número 2, 3. Pala recta 3, Videolaringoscopio Airtraq ® con tuboendotraqueal (TET) con balón nº 5 fiado, Cánula de Guedel ® nº 3, cánula VAMA y Guedel ®preparado con muesca para guía, Fibrobroncoscopio con tubo flexometálico con balón nº 5 fiado y Set de traqueotomía urgente.
Intraoperatorio
En sala de recepción prequirúrgica tras realizar lista de verificación, el niño nos permitió la canalización de vía periférica. Además de instilación en ambos pilares posteriores faríngeos de Xilonibsa ® (lidocaína 2% con adrenalina 0,0125 mg/ml) con el objetivo de bloquear ambos nervios glosofaríngeos.
Presencia de todo el personal: 2 enfermeras, anestesiólogos 2 y cirujanos con entrenamiento en realización de traqueostomías. Equipo presente en todo momento.
Traslado de paciente a quirófano y monitorización básica mediante pulsioximetría (saturación basal 96%), electrocardiograma continúo y tensión arterial no invasiva. No disponibilidad de medición transcutánea de CO2
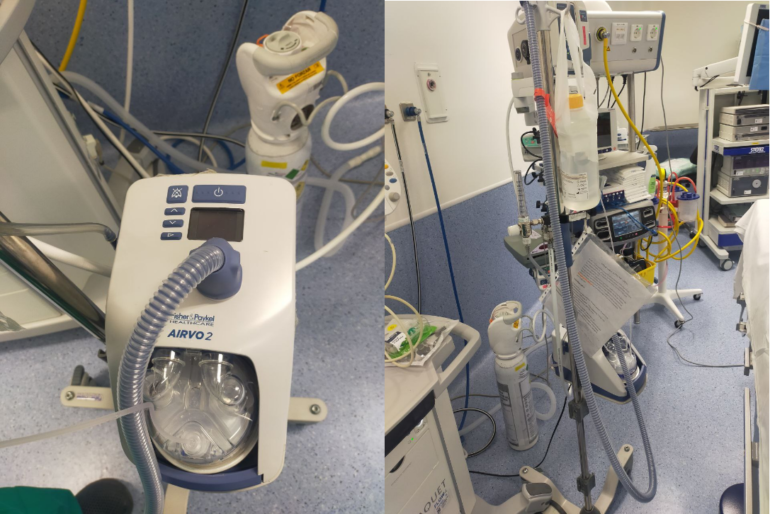
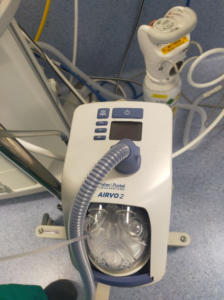
Comenzamos a instaurar oxigenoterapia de alto flujo (OAF) con los siguientes parámetros 20 L/min y FIO2 100% (fotografía 3-4). Tras 20 minutos de terapia se administra atropina 0,01mg/Kg intravenosa, dexmedetomidina (bolo de 2 mcg/kg en 10 min seguido de perfusión a 1mcg/kg/min) y Ketamina 1mg/kg.
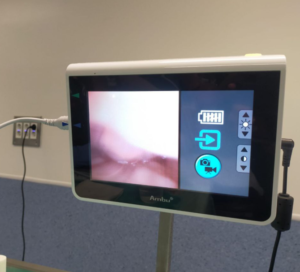
El paciente mantiene ventilación espontanea con Saturación O2 periférica 99-100%, la curva de capnografía es óptima con la adaptación de la mascarilla facial, por lo que se asume una adecuada ventilación manual en este plano anestésico. Nueva instilación de Xilonibsa ® en pilares y faringe posterior e introducción de cánula de VAMA. El plano de sedación y anestesia local permite realizar de forma reglada una intubación mediante fibrobroncoscopio oral a través de VAMA, con anestesia de vía aérea mediante técnica “spray as you go” (5) a través de canal de fibrobroncoscopio con lidocaína 1% (fotografía 5).
La disposición de la epiglotis en omega junto a los aritenoides prominentes que prolapsan las cuerdas vocales, causando obstrucción durante la espiración (fotografía 6), la limitación de flexo-extensión cervical, la limitación de apertura bucal y la presencia expansor palatino dificultan el avance del fibrobroncoscopio. Son necesarios 4 intentos y 2 operadores (2 por cada operador) para conseguir la intubación con tubo flexo-metálico nº 5 con neumotaponamiento. La duración desde inicio de monitorización hasta IOT es de 55 minutos.
Tras comprobación de la correcta visualización de la carina, administramos propofol 2mg/kg y fentanilo 2 mcg/kg. Mantenimiento con sevoflurano (2.7% inspirado), perfusión de dexmedetomidina 0.6 mcg/kg/h y Remifentanilo 0.05 mcg/kg/min intravenoso. Mantiene estabilidad hemodinámica durante todo el procedimiento (3 horas) en ventilación mecánica invasiva modo presión control. Profilaxis con amoxicilina-clavulánico 30 mg/kg y uso de dexametasona 4 mg y pantoprazol 40 mg intravenosos.
Tras finalización de cirugía, educción y extubación con intercambiador de COOK (fotografía 7) en quirófano. Traslado a Unidad de Reanimación pediátrica, estable, con intercambiador y CPAP buconasal con oxígeno a 9 lpm (presión 10 cm H20).
Posoperatorio
En la Unidad Reanimación pediátrica, iniciamos soporte ventilatorio con su CPAP buconasal con oxígeno. Tras recuperar estado de alerta y reactividad, se retira oxigenoterapia y CPAP. En las 4 horas siguientes es posible extraer el intercambiador de COOK e iniciar tolerancia oral. Permanece monitorizado durante la noche con su CPAP domiciliaria. Al alta se entrega informe de VAD describiendo técnica de sedación y planes de intubación empleados.
Discusión
Todo caso de VAD que va a ser sometido a una cirugía programada bajo anestesia general debe ser cuidadosamente preparado, en las fases del procedimiento: pre, intra y postoperatorio con la implicación y definición de las actuaciones de los profesionales implicados. En el caso que presentamos, confluyen diferentes condiciones: escasa apertura bucal, macroglosia, limitación de hiperextensión cervical y presencia de expansor palatino, además la técnica quirúrgica precisa evitar el acceso nasal.
Siguiendo las guías de vía aérea difícil pediátrica prevista es recomendable comenzar con una preparación previa del caso, con colaboración de dos anestesiólogos dada la complejidad del caso, además de la implicación del resto del equipo. Todos ellos deben tener conocimiento de los planes de actuación y las alternativas en caso de fracaso.
Las unidades de anestesia, según las recomendaciones de Helsinki, disponen de protocolos y carros de vía aérea difícil en el quirófano, con todos los fungibles que puedan llegar a utilizarse; pero en la población pediátrica no disponemos siempre del tamaño adecuado a la edad y a la anatomía del paciente. Cada unidad debe adaptar su protocolo de VAD al material disponible y al entrenamiento del personal.
La adecuada colaboración del paciente permitió canalizar una vía periférica, y optar por una sedación intravenosa con mantenimiento de la ventilación espontanea; además de la administración de anestesia pulverizada faríngea (6). En caso de falta de colaboración se podría haber optado por la sedación oral o intramuscular con ketamina.
La estructuración del modo de actuación es fundamental. Los objetivos eran: mantener ventilación espontánea, obtener un nivel de sedación adecuado como para explorar vía aérea y colocar dispositivo supraglótico VAMA. Para ello, el plan principal era la intubación oral mediante fibrobroncoscopio a través de cánula de VAMA; pero un aspecto fundamental era conocer la facilidad de ventilación. Siguiendo las guías, lo indicado ante una ventilación difícil es profundizar el nivel anestésico, colocar una LMA y posteriormente decidir si intubar a través de LMA o despertar al paciente (7). Sin embargo, para nuestro paciente, existía un informe previo, donde se hacía constar una ventilación manual HAN III, fracaso en la colocación de mascarilla laríngea, que condiciona todo el planteamiento. Por esta razón, se comprobó con mascarilla facial visualizando una adecuada capnografía con el paciente sedado y en ventilación espontánea. Si no se hubiera conseguido capnografía y se produjera un deterioro respiratorio, el siguiente escalón hubiera sido profundizar al paciente (en caso de ser necesario uso de relajantes se optaría por uno de corta duración) y colocar LMA. Si, a pesar de ello, siguiera sin poder ser adecuadamente ventilado (pero manteniendo una aceptable oxigenación), el siguiente paso habría sido realizar IOT guiada por fibronasal. Como última medida se optaría por acceso el quirúrgico traqueal. Despertar al paciente debe ser considerado en todos los pasos si no hay un deterioro en la oxigenación que no permita esperar a que recobre la ventilación.
Una vez conseguida una adecuada capnografía, se necesita tiempo de maniobra. El apoyo con OAF, fue de especial relevancia en este caso dada la duración esperada de la técnica. El uso de la oxigenación convencional no parecía la opción más segura, ante una posible ventilación dificultosa (informe previo HAN III) y la previsión una maniobra prolongada en el tiempo. Sin embargo, la hiperoxigenación apneica mediante OAF, supuso un pilar fundamental en el éxito de este caso clínico. Actúa produciendo “una nube rica en oxígeno” en la cavidad orofaríngea que se intercambia con el aire menos oxigenado de la vía aérea distal (8), mejorando el lavado de dióxido de carbono en el espacio muerto anatómico permitiendo minimizar el desarrollo de acidosis respiratoria. Además, produce un efecto de presión positiva, favorable dados los antecedentes del paciente (9), no obstante, la relevancia de este efecto puede estar disminuida por la introducción cánula de VAMA y el uso del acceso a través de la cavidad oral. Aprovechando estos efectos, a pesar de la limitación anatómica en una fosa nasal del paciente, la OAF logró prolongar el tiempo disponible sin desaturación para instrumentar la vía aérea, como ya se ha descrito en otros casos en la literatura (10).
Como opción adicional, en el caso se planteó la realización de una ventilación jet de alta frecuencia supraglótica para posteriormente realizar una intubación oral mediante fibrobroncoscopio. Pero hubiese sido necesario profundizar y relajar al paciente además de que la ventilación podía alterarse por la mala alineación del jet con la vía aérea durante la manipulación con el fibrobroncoscopio. Esta técnica tampoco es capaz de monitorizar la PAWP o la EtCO2 y además teniendo en cuenta la escasa apertura bucal, el espesor del paladar, la introducción del laringoscopio de Kleinsasser seria dificultosa desde el inicio.
Para ayudar a las maniobras de fibrobroncoscopia, el uso de anestesia local sobre el tracto respiratorio y el bloqueo del nervio glosofaríngeo puede ser beneficioso ya que la pulverización tópica de lidocaína para el bloqueo del nervio glosofaríngeo ha demostrado facilitar estas técnicas (11). Dada la colaboración activa del niño fue posible llevarla a cabo en el prequirófano, pero en caso de pacientes no colaboradores se puede usar la nebulización de lidocaína 1%, que además permite mantener la inmovilidad cervical.
La cánula VAMA, fue usada como guía de apoyo a la fibrobroncoscopia. Es conocido que en el paciente pediátrico el uso de la LMA como guía es más común, pero la dificultad mostrada en los antecedentes del niño hacía pensar en un posible fracaso. Por ello, guías tipo Guedel como la cánula de VAMA muestran una alternativa. Como limitación, la VAMA dispone de un tamaño único lo que supone una limitación en procedimientos en la población infantil. En el caso de no haber podido usarla, la posibilidad de modificar una cánula de Guedel de tamaño adecuado, para simular la apertura anterior de la VAMA, es una alternativa poco deseable, debido a los bordes imprecisos. Una opción más adecuada es disponer de una unidad de impresión 3D en el centro hospitalario. En el caso descrito no fue posible a pesar de disponer de esa unidad debido al margen de tiempo con la programación quirúrgica.
La extubación de la VAD siempre que sea posible (descartando edema, sangrado…), se debe llevar a cabo de forma precoz y en un medio en el que se dispongan de los materiales adecuados para hacer frente a una reintubación. En este caso extubar en quirófano se muestra como una opción segura. Con el objetivo de mejorar las posibilidades de éxito, el mantenimiento una adecuada presión positiva en la vía aérea con la CPAP basal podría disminuir el riesgo de obstrucción. En caso de fracaso, el intercambiador de COOK facilitaría una intubación de rescate. A pesar del destete favorable, la preparación posoperatoria sigue siendo necesaria, reservando en su habitáculo de REA el material de rescate de la vía aérea al igual que en quirófano. Además, es imperativo que el plan de actuación realizado sea conocido por los profesionales que participan en el cuidado posoperatorio y que estén entrenados en manejo de la VAD.
Conclusiones
Los pacientes con malformaciones craneofaciales pueden suponer un reto para la intubación. Son pacientes que requieren o han requerido cirugías con IOT, por lo que es fundamental la correcta elaboración y revisión de su historial clínico. Prestar especial atención a informes con experiencias previas de intubación ayuda a ajustar una estrategia de abordaje.
Es necesaria una comunicación entre el equipo quirúrgico, que debe tener lugar con el tiempo suficiente, para que los integrantes tengan claras las pautas de actuación durante el perioperatorio. El uso de talleres de simulación puede ayudar a mejorar las interacciones entre los profesionales que se enfrentan a estos casos, en especial la simulación de fase III (que fomentan el uso de habilidades específicas en entornos con varios distractores).
Dado que la intubación en una VAD supone mayor tiempo de intubación que la convencional, impera la búsqueda de terapias que mantengan la oxigenación en condiciones de sedación profunda o apnea. Las OAF pueden ser un aliado en el manejo de estos pacientes. No sólo, manteniendo oxemias adecuadas durante la fibrobroncoscopia, sino proporcionando una presión positiva y disminuyendo el colapso de la vía aérea superior y atelectasias. Si bien, se debería considerar un aumento de monitorización en estos pacientes, como el CO2 transcutáneo, especialmente si se plantea una hiperoxigenación apneica. No obstante, se requieren estudios comparativos para evaluar la importancia de la terapia con alto flujo en enfermos con malformaciones craneales para recomendar su uso sistemático.
En la población pediátrica (sobre todo escolar y lactantes), la falta disponibilidad de dispositivos adaptados puedes suponer un reto e incluso impedir una intervención. Incorporar a las unidades pediátricas la impresión 3D facilitaría disponer de recursos y material diseñados para diferentes rangos de edad.
Nota final: Todas las fotografías aportadas tienen el consentimiento y autorización de los padres del paciente.
Bibliografía
- UpToDate [Internet]. www.uptodate.com. [cited 2022 Aug 20]. Available from: https://www.uptodate.com/contents/emergency-airway-management-in-children-unique-pediatric-considerations?topicRef=6391&source=see_link).
- Brown CA, Walls RM. Identification of the difficult and failed airway. In: Manual of Emergency Airway Management, 5th ed, Brown CA, Sakles JC, Mick NW (Eds), Wolters Kluwer, Philadelphia 2018. p.11.].
- RESERVADOS IU — TLD. Orphanet: Síndrome de Pfeiffer [Internet]. www.orpha.net. [cited 2022 Aug 20]. Available from: https://www.orpha.net/consor/cgi-bin/OC_Exp.php?lng=ES&Expert=710#:~:text=Es%20una%20acrocefalosindactilia%20asociada%20a
- Ranger A, Al-Hayek A, Matic D. Chiari Type 1 Malformation in an Infant With Type 2 Pfeiffer Syndrome. Journal of Craniofacial Surgery. 2010 Mar;21(2):427–31. (PubMed)
- Ovassapian A. Topical anesthesia of the airway. In: Ovassapian A, ed. Fiberoptic endoscopy and the difficult airway. 2nd ed. New York: Lippincott-Raven Press, Ltd., 1996:47-59. (HTML)
- Andreu E, Schmucker E, Drudis R, Farré M, Franco T, Monclús E, Montferrer N, Munar F, Valero R; Grupo SEVA. Algoritmo de la vía aérea difícil en pediatría [Algorithm for pediatric difficult airway]. Rev Esp Anestesiol Reanim. 2011 May;58(5):304-11. (PubMed)
- Difficult mask ventilation (MV) -during routine induction of anaesthesia in a child aged 1 to 8 years [Internet]. Available from: https://das.uk.com/files/APA1-DiffMaskVent-FINAL.pdf
- Gleason JM, Christian BR, Barton ED. Nasal Cannula Apneic Oxygenation Prevents Desaturation During Endotracheal Intubation: An Integrative Literature Review. West J Emerg Med. 2018;19(2):403-411. doi:10.5811/westjem.2017.12.34699 (PubMed)
- UpToDate [Internet]. www.uptodate.com. Available from: https://www.uptodate.com/contents/preoxygenation-and-apneic-oxygenation-for-airway-management-for-anesthesia
- Schroeder, D.C., Wetsch, W.A., Finke, SR. et al. Apneic laryngeal oxygenation during elective fiberoptic intubation – a technical simulation. BMC Anesthesiol 20, 300 (2020). https://doi.org/10.1186/s12871-020-01216-2 (PubMed)
- Simmons ST, Schleich AR: Airway regional anesthesia for awake fiberoptic intubation. Reg Anesth Pain Med. 2002, 27:180-92. 10.1053/rapm.2002.30659 (PubMed)