Zamudio Penko D, Delgado García D, Fernández Téllez L, Rodríguez Esteve A.
Adjunto del Servicio de Anestesiología y Reanimación del Hospital Universitario Fundación Alcorcón, Madrid, España
Cómo citar este artículo: Zamudio Penko, D., Delgado García, D. ., Fernández Téllez, L., & Rodríguez Esteve, A. (2023). Bloqueo del plano del erector espinal tras artrodesis de columna lumbar: eficacia analgésica y resultados clínicos. Revista Electrónica AnestesiaR, 15(9). https://doi.org/10.30445/rear.v15i9.1152
1.Introducción
La cirugía de artrodesis de columna lumbar puede asociarse a dolor postoperatorio de intensidad moderada a severa. La administración de opioides intravenosos mediante analgesia controlada por el paciente (PCA, patient controlled analgesia) es de las técnicas más frecuentemente empleadas para el alivio del dolor en este tipo de pacientes (1).
Para intentar reducir la aparición de efectos secundarios y complicaciones relacionadas con los opioides (náuseas y vómitos, retención urinaria, depresión respiratoria, íleo paralítico, sedación y otros), se han propuesto diversas técnicas complementarias. Sin embargo, por el momento, no existe suficiente evidencia del beneficio global de la mayoría de las técnicas analgésicas regionales, de los gabapentinoides, de la infusión de lidocaína intraoperatoria y de la mayoría de los antiinflamatorios no esteroideos (AINEs) (1-4).
El bloqueo del plano del erector espinal (BPEE) es un bloqueo interfascial paraespinal, descrito inicialmente por Forero et al. para el dolor neuropático torácico (5). La inyección de anestésico local (AL) entre el músculo erector espinal y la apófisis transversa puede producir analgesia de las ramas dorsal y ventral de los nervios espinales y, como han demostrado algunos estudios (6-7), el AL puede difundirse al espacio paravertebral torácico para ejercer también sus efectos analgésicos, aunque esta difusión no se ha observado a nivel lumbar (8).
Desde su publicación, muchos estudios se han centrado en las aplicaciones clínicas del BPEE en multitud de intervenciones quirúrgicas (por ejemplo, mastectomía (9), histerectomía abdominal (10), cirugía torácica asistida por vídeo (11), etc.). Pero hasta la fecha, pocos estudios han investigado el papel del BPEE en la cirugía de la columna lumbar.
El objetivo de este estudio es evaluar el efecto analgésico y los resultados clínicos del BPEE postoperatorio tras la cirugía de la columna lumbar, en comparación con la técnica estándar de sólo uso de opioides intravenosos.
2. Material y métodos
El Comité Ético de Investigación Clínica del Hospital Universitario Fundación Alcorcón, Madrid, España, aprobó este estudio (número 21/50) el 5 de mayo de 2021 y eximió del requisito de consentimiento informado debido al diseño retrospectivo. Este estudio se adhiere a las directrices STROBE (Strengthening the Reporting of Observational Studies in Epidemiology).
2.1 Diseño y entorno del estudio
Se trata de un estudio de cohortes retrospectivo realizado en el Hospital Universitario Fundación Alcorcón de Madrid, España, un hospital universitario en el que se realizan aproximadamente 150 cirugías de columna lumbar al año.
2.2 Participantes
Se incluyeron a todos los pacientes adultos con estado físico de la Sociedad Americana de Anestesiólogos (ASA, American Society of Anesthesiologists physical) I a III, que se sometieron a una cirugía de columna lumbar y/o lumbosacra que incluía hasta 4 niveles de fusión, entre diciembre de 2019 y febrero de 2021.
Se excluyeron los pacientes menores de 18 años, cirugía urgente, con infecciones de la columna vertebral, a los pacientes que recibieron otros tipos de anestesia regional diferentes al BPEE o regímenes de analgesia multimodal con fármacos adyuvantes (por ejemplo, ketamina, lidocaína, dexmedetomidina y magnesio).
Los pacientes se agruparon en función de si habían recibido el bloqueo del plano erector espinal (grupo BPEE) o sólo morfina intravenosa (grupo MOR) para la analgesia postoperatoria.
2.3 Técnica del BPEE
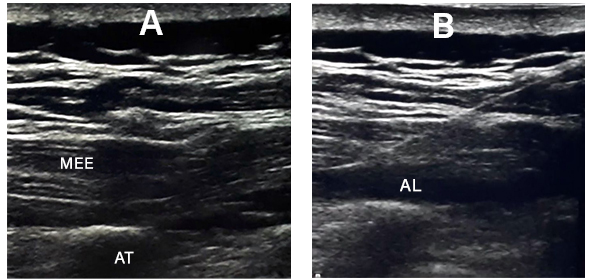
El bloqueo se realizó una vez finalizada la cirugía, con el paciente en posición de decúbito prono y bajo anestesia general. Se colocó sagitalmente un transductor de ultrasonido lineal de alta frecuencia, aproximadamente dos niveles por encima del sitio quirúrgico. Una vez identificada la apófisis espinosa, se desplazó el transductor 2-3 cm lateralmente hasta que se visualizó la apófisis transversa; entonces, se introdujo una aguja de nervio periférico de calibre 22 G de 100 mm (Stimuplex® Ultra 360®, B. Braun Medical Inc.) en plano con el transductor hasta alcanzar la punta de la apófisis transversa (Fig. 1). Finalmente, se inyectó una dosis de 1,5-2 mg/kg de levobupivacaína diluida en 60-80 ml (30-40 ml por lado).
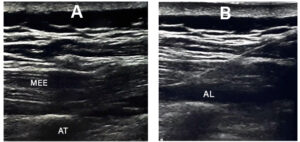
AT= apófisis transversa; MEE = músculo erector espinal; AL = anestésico local
2.4 Técnica anestésica y protocolo de analgesia postoperatoria
Todos los pacientes recibieron propofol, fentanilo y rocuronio para la inducción intravenosa. La anestesia general se mantuvo con sevoflurano en una mezcla de 50% de oxígeno y 50% de aire, y se utilizó fentanilo para la analgesia intraoperatoria. Todos los fármacos se titulaban a discreción del anestesista a cargo del paciente.
Al final de la operación, se les administró 50 mg de dexketoprofeno IV (o 2 g de metamizol en caso de alergia a los AINEs) y 4 mg de ondansetrón IV. Algunos pacientes también recibieron morfina intravenosa, según la preferencia del anestesista. Tras la reversión del bloqueo neuromuscular, se extubaron y fueron trasladadod a la unidad de cuidados postanestésicos, donde se inició una bomba de PCA de morfina intravenosa y se programó para administrar 1 mg con un tiempo de bloqueo de 15 minutos, sin infusión continua. Se administró Paracetamol IV 1g/8h alternado con dexketoprofeno IV 50 mg/8h (o metamizol 2g/8h en caso de alergia a los AINEs) como analgesia suplementaria. Se utilizaron bolos de morfina intravenosa como analgesia de rescate si el dolor no se controlaba con la PCA.
2.5 Variables
Los datos recogidos incluían la edad, el sexo, el índice de masa corporal (IMC), la clasificación ASA, el uso de medicación para el dolor crónico (opioides y adyuvantes como gabapentina y pregabalina), la dosis de fentanilo intraoperatorio, el número de niveles fusionados, el abordaje quirúrgico (fusión posterolateral o fusión lumbar transforaminal [TLIF, transforaminal lumbar interbody fusion]) y si se trataba de una cirugía primaria o de una reintervención.
Variable primaria
Consumo de morfina intravenosa durante las primeras 48 horas postoperatorias, incluyendo la administración intraoperatoria, el rescate postoperatorio y vía PCA.
Variables secundarias
Puntuaciones de la Escala Visual Analógica (EVA) a los 30 minutos, 6, 12, 24 y 48 horas después de la cirugía, efectos secundarios relacionados con la morfina durante los primeros 3 días, incluyendo náuseas y vómitos, depresión respiratoria, retención urinaria (definida como la incapacidad de miccionar y la necesidad de una sonda urinaria), hipotensión (definida como una presión arterial media de < 60 mmHg), mareos, prurito y estreñimiento (definido como la ausencia de defecación durante 3 días consecutivos o la necesidad de laxantes), necesidad de analgesia de rescate durante las primeras 24 horas, día de la primera movilización, sedestación y deambulación, y duración de la estancia hospitalaria. También se registraron las complicaciones relacionadas con el bloqueo, como neumotórax, toxicidad de AL, bloqueo motor, infección local o hematoma.
2.4 Fuentes de datos
Los pacientes sometidos a cirugía de columna lumbar se seleccionaron utilizando la base de datos del hospital. Todos los datos relacionados con el paciente, el procedimiento y el manejo anestésico se obtuvieron de la historia clínica electrónica del paciente.
2.5 Tamaño del estudio y métodos estadísticos
Se estimó un tamaño muestral de 28 pacientes por grupo para demostrar una diferencia del 35% en el consumo de morfina entre los grupos, con a=0,05 y una potencia del 80%. Los datos demográficos de los pacientes, las características preoperatorias y los datos de la cirugía se compararon entre los grupos mediante las pruebas de chi-cuadrado, la prueba exacta de Fisher y la pruea de la t de student, según el caso. Se consideró que un valor P inferior a 0,05 era estadísticamente significativo. Las variables categóricas se presentan en número y en porcentaje, mientras que las variables continuas se expresan como medias con DE o medianas con rangos intercuartílicos (RIC). Las puntuaciones de la escala EVA se compararon mediante la prueba U de Mann-Whitney.
3. Resultados
Se incluyeron en el estudio 72 pacientes, 37 en el grupo BPEE y 35 en el grupo MOR. Las características basales se encuentran adecuadamente equilibradas entre los grupos del estudio (Tabla 1).
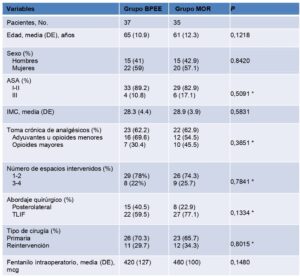
ASA= American Society of Anesthesiologists, IMC = Indice de masa corporal, TLIF= Transforaminal Lumbar Interbody Fusion
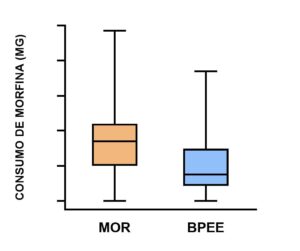
El consumo medio de morfina durante las primeras 24 horas postoperatorias fue significativamente menor en el grupo BPEE (media de 13,4, DE 9,6 mg) que en el grupo MOR (media de 26,1, DE 12,6 mg) (P <0,0001). El consumo medio de morfina durante el segundo día postoperatorio también fue menor en el grupo BPEE (media de 5,8, DE de 7,8 mg) que en el grupo MOR (media de 9,9, DE de 11,2 mg); sin embargo, estas diferencias no fueron estadísticamente significativas (P =0,072). En total, el consumo de morfina durante las primeras 48 horas postoperatorias fue significativamente menor en el grupo BPEE (media 19, DE 15,4 mg) que en el grupo MOR (media 35,9, DE 20,4 mg), con una reducción media de -16,7 (DE 4,2 mg; IC 95% -25,2 a -8,2; P =0,0002) (Fig. 2).
Las puntuaciones de la escala EVA fueron menores en el grupo BPEE en todos los momentos analizados, excepto en la 6ª hora postoperatoria en la que no se encontró diferencia estadísticamente significativa (Fig. 3, Tabla 2).
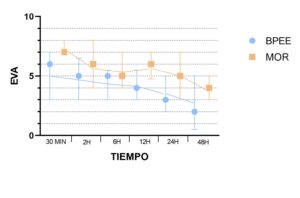
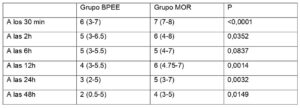
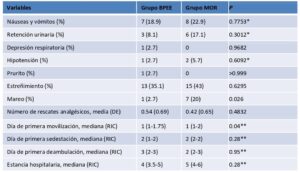
Asimismo, no se halló una diferencia estadísticamente significativa en la frecuencia de efectos secundarios derivados de los opioides entre ambos grupos (Tabla 3). Sólo los mareos fueron significativamente menos frecuentes en el grupo BPEE que en el grupo MOR (P=0,026). Otras variables secundarias (necesidad de analgesia de rescate durante las primeras 24 horas, día de la primera sedestación y de la primera deambulación, y duración de la estancia hospitalaria) también fueron similares entre los grupos. Sólo el día de la primera movilización fue ligeramente más precoz en el grupo BPEE (P=0,04).
No se observaron complicaciones relacionadas con el bloqueo.
4. Discusión
El tratamiento eficaz del dolor agudo postoperatorio en intervenciones de cirugía de columna sigue siendo un reto para los anestesiólogos. Además del dolor incisional, suelen experimentar dolor procedente de tejidos más profundos, como huesos, ligamentos, músculos, discos intervertebrales, articulaciones facetarias y raíces nerviosas dañadas (1). Muchos de estos pacientes también sufren de dolor lumbar crónico y reciben opioides antes de la cirugía, lo que provoca una mayor tolerancia a los opioides y la necesidad de dosis más altas de estos para lograr un adecuado control del dolor postoperatorio (1,12). El riesgo de efectos adversos y complicaciones relacionadas con los opioides ha llevado a la búsqueda de fármacos o técnicas alternativas o complementarias. En este sentido, el BPEE podría proporcionar un alivio del dolor en la cirugía de la columna al alcanzar las ramas dorsal y ventral de los nervios espinales. Pero, aunque algunos estudios han investigado la eficacia analgésica del BPEE en la cirugía de la columna lumbar, no se ha estudiado bien el posible beneficio de este bloqueo en términos de resultados clínicos, recuperación y duración de la estancia hospitalaria.
La difusión del anestésico y el mecanismo de acción del BPEE sigue siendo una fuente de gran controversia (8,13). Los estudios anatómicos muestran que la propagación del AL es variable y puede depender del nivel de la columna vertebral y del volumen administrado (13). En algunos estudios (6,7), se ha observado una diseminación al espacio paravertebral, en diferentes porcentajes, sobre todo en inyecciones torácicas; pero De Lara González et al. mostraron que en las inyecciones lumbares (a nivel de L4), el BPEE siempre actúa sobre las ramas posteriores de los nervios espinales, pero rara vez se extiende al espacio paravertebral (8). Adicionalmente, Choi et al. encontraron una propagación paravertebral con inyecciones de 30 mL, pero no de 10 mL, lo que sugiere que la propagación paravertebral puede depender del volumen y es más probable que aparezca con volúmenes mayores (14).
Efectuamos todos los bloqueos una vez finalizada la cirugía y si no se producían desgarros durales incidentales, para evitar una teórica propagación del anestésico local al espacio intradural. Además, como los bloqueos se realizaron dos espacios por encima de la incisión quirúrgica, elegimos volúmenes elevados de AL (30-40 ml) y una infiltración de craneal a caudal, para poder llegar a la zona quirúrgica. En otros estudios (15-18), los bloqueos se realizaron de forma preoperatoria y al mismo nivel de la cirugía, lo que también podría producir una analgesia preventiva y ayudar a mitigar la activación de neuronas centrales y la posterior respuesta exagerada al dolor por parte de las neuronas en la periferia(19,20) , pero la duración de la analgesia postoperatoria podría ser menor, comparado con la realización del bloqueo al terminar la cirugía.
En nuestro estudio, observamos una disminución significativa del consumo de morfina durante las primeras 24 horas postoperatorias (media de 13,4, DE 9,6 mg en el grupo BPEE frente a la media de 26,1, DE 12,6 mg en el grupo MOR). Pero esta disminución no se observó durante el segundo día postoperatorio; no obstante, el consumo de morfina fue bajo en ambos grupos durante el segundo día postoperatorio, indicando que el dolor es más intenso durante las primeras 24 horas del postoperatorio. Estos resultados son congruentes con la duración del anestésico local administrado (levobupivacaína) y por tanto no era esperable que la duración de la analgesia en el grupo BPEE se extienda más allá de las 10-14 horas. Las puntuaciones de dolor también fueron menores en el grupo BPEE en todos los momentos analizados, excepto en la sexta hora postoperatoria, en la que no se encontraron diferencias estadísticamente significativas. Estos resultados son coherentes con un metanálisis reciente (21), que demostró que el BPEE proporcionó una disminución significativa de las puntuaciones de dolor en varios momentos durante las primeras 48 horas después de la cirugía.
Aunque el grupo BPEE tuvo un menor consumo de morfina, no se encontraron diferencias en los efectos adversos relacionados con los opioides, excepto los mareos, que fueron menos frecuentes en el grupo BPEE. También encontramos un alto porcentaje de estreñimiento en ambos grupos. El estreñimiento inducido por los opiáceos es un problema común, que se produce entre el 40% y el 95% de los pacientes tratados con opiáceos y puede ocurrir incluso con una sola dosis de morfina (22). Nuestros hallazgos son coherentes con la literatura, pero pueden estar sobreestimados ya que no diferenciamos el estreñimiento crónico del agudo y varios de estos pacientes tomaban opioides de forma crónica. Asimismo, se produjeron náuseas y vómitos postoperatorios (NVPO) en un número importante de pacientes. Las NVPO son el efecto secundario más común y desagradable relacionado con los opioides (21). Encontramos tasas similares de NVPO en ambos grupos; sin embargo, otros estudios han encontrado menores NVPO en pacientes que recibieron BPEE (17,21).
Otros resultados, como sedestación, deambulación y duración de la estancia hospitalaria fueron similares entre los grupos. Sólo el día de la primera movilización fue ligeramente más precoz en el grupo de BPEE; pero, aunque esta diferencia fue estadísticamente significativa, no fue clínicamente relevante. La duración de la estancia hospitalaria también fue un poco más corta en el grupo de BPEE; sin embargo, no se alcanzó una diferencia estadísticamente significativa.
En este estudio no se observaron complicaciones relacionadas con el bloqueo, como infección, hemorragia, toxicidad por AL, bloqueo motor o neumotórax. Muchos estudios han demostrado el perfil de seguridad del BPEE y la baja incidencia de eventos adversos significativos relacionados con el bloqueo (13,15,17,21)
La principal limitación de nuestro trabajo es el diseño retrospectivo y el número limitado de pacientes incluidos en el estudio, debido principalmente a la disminución del número de cirugías debido a la pandemia por coronavirus COVID-19. Es posible que la inclusión de un mayor número de pacientes pudiera haber detectado diferencias clínicamente relevantes en los efectos adversos de los opioides, la recuperación y la duración de la estancia hospitalaria. La ausencia de diferencia en algunas de estas variables, a pesar de un menor consumo de morfina en el grupo BPEE, también podrían explicarse por la práctica habitual. En nuestro hospital, habitualmente la movilización se inicia en el primer día postoperatorio, la sedestación en el segundo y la marcha en el tercero. Los protocolos actuales de recuperación acelerada después de la cirugía (ERAS, Enhanced Recovery after Surgery), para la cirugía de la columna vertebral (23), abogan por el uso de técnicas locales o regionales para el tratamiento del dolor y el uso de regímenes analgésicos multimodales para reducir el consumo de opioides. Estas directrices también hacen hincapié en la movilización temprana, empezando incluso el mismo día de la cirugía, si es posible. Por lo tanto, la inclusión del BPEE en un protocolo de recuperación acelerada o en un régimen de analgesia multimodal podría proporcionar mejores resultados.
5. Conclusiones
El BPEE realizado de forma postoperatoria, bilateral y guiado por ecografía, puede disminuir significativamente el consumo de morfina y las puntuaciones de dolor durante las primeras 48 horas postoperatorias tras cirugía de artrodesis de columna lumbar. Sin embargo, en este estudio, su uso no se asoció a una menor incidencia de efectos secundarios relacionados con la morfina, mejora en la recuperación postquirúrgica ni menor estancia hospitalaria.
Futuros estudios deberían centrarse en determinar la técnica óptima, volumen y concentración de AL, su uso como parte de un protocolo analgésico multimodal y los beneficios con respecto a los resultados clínicos.
Bibliografía
- Sharma S, Balireddy RK, Vorenkamp KE, Durieux ME. Beyond opioid patient-controlled analgesia: a systematic review of analgesia after major spine surgery. Reg Anesth Pain Med. 2012; 37:79-98. doi:10.1097/AAP.0b013e3182340869 (HTML)
- Benyahia NM, Verster A, Saldien V, Breebaart M, Sermeus L, Vercauteren M. Regional anaesthesia and postoperative analgesia techniques for spine surgery – a review. Rom J Anaesth Intensive Care. 2015; 22:25–33. (HTML)
- Kjærgaard M, Møiniche S, Olsen KS. Wound infiltration with local anesthetics for post-operative pain relief in lumbar spine surgery: a systematic review. Acta Anaesthesiol Scand. 2012; 56(3):282-290. doi:10.1111/j.1399-6576.2011.02629.x (PubMed)
- Dewinter G, Moens P, Fieuws S, Vanaudenaerde B, Van de Velde M, Rex S. Systemic lidocaine fails to improve postoperative morphine consumption, postoperative recovery and quality of life in patients undergoing posterior spinal arthrodesis. A double-blind, randomized, placebo-controlled trial. Br J Anaesth. 2017; 118(4):576-585. doi:10.1093/bja/aex038 (PubMed)
- Forero M, Adhikary SD, Lopez H, Tsui C, Chin KJ. The Erector Spinae Plane Block: A Novel Analgesic Technique in Thoracic Neuropathic Pain. Reg Anesth Pain Med. 2016; 41(5):621-627. doi:10.1097/AAP.0000000000000451 (PubMed)
- Adhikary SD, Bernard S, Lopez H, Chin KJ. Erector Spinae Plane Block Versus Retrolaminar Block: A Magnetic Resonance Imaging and Anatomical Study. Reg Anesth Pain Med. 2018; 43(7):756-762. doi:10.1097/AAP.0000000000000798 (PubMed)
- Vidal E, Giménez H, Forero M, Fajardo M. Bloqueo del plano del músculo erector espinal: estudio anatómico-cadavérico para determinar su mecanismo de acción. Rev Esp Anestesiol Reanim (Engl Ed). 2018; 65(9):514-519. doi:10.1016/j.redar.2018.07.004 (PubMed)
- De Lara González SJ, Pomés J, Prats-Galino A, Gracia J, Martínez-Camacho A, Sala-Blanch X. Estudio anatómico de la distribución del volumen administrado tras bloqueo en el plano profundo del erector espinal a nivel lumbar. Rev Esp Anestesiol Reanim (Engl Ed). 2019; 66(8):409-416. doi:10.1016/j.redar.2019.07.001 (PubMed)
- Gürkan Y, Aksu C, Kuş A, Yörükoğlu UH, Kılıç CT. Ultrasound guided erector spinae plane block reduces postoperative opioid consumption following breast surgery: A randomized controlled study. J Clin Anesth. 2018; 50:65-68. doi:10.1016/j.jclinane.2018.06.033 (PubMed)
- Hamed MA, Goda AS, Basiony MM, Fargaly OS, Abdelhady MA. Erector spinae plane block for postoperative analgesia in patients undergoing total abdominal hysterectomy: a randomized controlled study original study. J Pain Res. 2019; 12:1393-1398. doi:10.2147/JPR.S196501 (PubMed)
- Zhao H, Xin L, Feng Y. The effect of preoperative erector spinae plane vs. paravertebral blocks on patient-controlled oxycodone consumption after video-assisted thoracic surgery: A prospective randomized, blinded, non-inferiority study. J Clin Anesth. 2020; 62:109737. doi:10.1016/j.jclinane.2020.109737 (PubMed)
- Bajwa SJ, Haldar R. Pain management following spinal surgeries: An appraisal of the available options. J Craniovertebr Junction Spine. 2015; 6(3):105-110. doi:10.4103/0974-8237.161589 (PubMed)
- Saadawi M, Layera S, Aliste J, Bravo D, Leurcharusmee P, Tran Q. Erector spinae plane block: A narrative review with systematic analysis of the evidence pertaining to clinical indications and alternative truncal blocks. J Clin Anesth. 2021; 68:110063. doi:10.1016/j.jclinane.2020.110063 (PubMed)
- Choi YJ, Kwon HJ, O J, et al. Influence of injectate volume on paravertebral spread in erector spinae plane block: An endoscopic and anatomical evaluation. PLoS One. 2019;14(10):e0224487. doi:10.1371/journal.pone.0224487 (PMC)
- Singh S, Choudhary NK, Lalin D, Verma VK. Bilateral Ultrasound-guided Erector Spinae Plane Block for Postoperative Analgesia in Lumbar Spine Surgery: A Randomized Control Trial. J Neurosurg Anesthesiol. 2020;32(4):330-334. doi:10.1097/ANA.0000000000000603 (PubMed)
- El Ghamry MR, Elgebaly AS, Anwar AG, Shaddad MN. Ultrasound-guided erector spinae plane block for acute pain management in patients undergoing posterior lumbar interbody fusion under general anaesthesia. Southern African J Anaesthesia and Analgesia 2019; 25: 26-31. doi:10.36303/SAJAA.19.6.A4 (HTML)
- Zhang Q, Wu Y, Ren F, Zhang X, Feng Y. Bilateral ultrasound-guided erector spinae plane block in patients undergoing lumbar spinal fusion: A randomized controlled trial. J Clin Anesth. 2021; 68:110090. doi:10.1016/j.jclinane.2020.110090 (PubMed)
- Chen K, Wang L, Liu X, Lu Y. Ultrasound-Guided Erector Spinae Plane Block Reduces Perioperative Opioid Consumption in Lumbar Spinal Fusion. Am J Ther. 2021; 28(2):e266-e268. doi:10.1097/MJT.0000000000001092 (PubMed)
- Woolf CJ, Chong MS. Preemptive analgesia–treating postoperative pain by preventing the establishment of central sensitization. Anesth Analg. 1993;77(2):362-379. doi:10.1213/00000539-199377020-00026 (PubMed)
- Yoo JS, Ahn J, Buvanendran A, Singh K. Multimodal analgesia in pain management after spine surgery. J Spine Surg. 2019; 5(Suppl 2):S154-S159. doi:10.21037/jss.2019.05.04 (PubMed)
- Oh SK, Lim BG, Won YJ, Lee DK, Kim SS. Analgesic efficacy of erector spinae plane block in lumbar spine surgery: A systematic review and meta-analysis. J Clin Anesth. 2022; 78:110647. doi:10.1016/j.jclinane.2022.110647 (PubMed)
- Benyamin R, Trescot AM, Datta S, et al. Opioid complications and side effects. Pain Physician. 2008; 11(2 Suppl):S105-S120. (PubMed)
- Debono B, Wainwright TW, Wang MY, et al. Consensus statement for perioperative care in lumbar spinal fusion: Enhanced Recovery After Surgery (ERAS®) Society recommendations. Spine J. 2021; 21(5):729-752. doi:10.1016/j.spinee.2021.01.001 (PubMed)
Agradecimientos
Al Dr. Santiago García Del Valle por su apoyo en la realización de este estudio.