Marcos Hernández Vásquez,Jesús López Pérez, Bruno Alfonso Colomer, Raquel López López
Hospital Universitario Virgen de la Arrixaca, Murcia
Introducción
Presentamos un caso clínico de hipoxemia secundaria a Edema Agudo de Pulmón (EAP) en el postoperatorio inmediato de una cesárea bajo anestesia general. En este documento, revisamos el proceso de diagnóstico diferencial aplicado a nuestra paciente.
Caso
Paciente de 38 años de edad, con embarazo de 34 semanas ingresada a cargo de ginecología por RPM. Recibió tratamiento con Ampicilina/Gentamicina y maduración pulmonar fetal. A los 4 días se indica inducción de trabajo de parto con PROPESS y posteriormente Oxitocina. Después de 12 horas en sala de dilatación, se indica cesárea urgente por no progresión del parto.
Antecedentes: Anamnesis complicada por barrera idiomática. Cirugías previas: apendicectomía. Ingreso en Servicio de Neurología en 2.009, por: atrofia córtico-subcortical; imágenes de TAC y RMN: atrofia moderada de predominio cortical y subcortical y múltiples lesiones de aspecto crónico en centros ovales y sustancia blanca subcortical frontal que podrían traducir cambios hipóxico-isquémicos crónicos, en probable relación con anoxia perinatal. Primer control del embarazo: semana 28. G2P0C0A1. GS y Rh: A+. Menarca: 14 años.
Analítica de hace 3 días: PCR: 0.1 HB: 8.0 VCM: 78 HCM: 24 Plaq: 294000 WBC: 12110 N:80%
Ante la remota posibilidad de que los hallazgos en las pruebas de imagen pudieran ser debidos a enfermedad desmielinizante del sistema nervioso central, se decidió practicar técnica de anestesia general.
Monitorización básica. Pre-oxigenación. Inducción con Propofol, Succinilcolina y Cisatracurio. Intubación de secuencia rápida con maniobra de Sellick, sin incidencias. Mantenimiento con sevorane + N2O (70%). Después de la extracción fetal recibió además: oxitocina, metamizol, Amoxicilina/clavulánico, ondansetrón, ranitidina, dexametasona. Aporte hídrico intra-operatorio: Ringer 1.500 ml. Reversión del bloqueo neuro-muscular con Neostigmina. No se detectaron hallazgos llamativos en la monitorización intraoperatoria. Se observó ligero retardo para despertar y recuperar ritmo inspiratorio propio, logrando finalmente extubación sin incidencias. Salida de quirófano recibiendo Oxígeno suplementario con Ventimask al 50%.
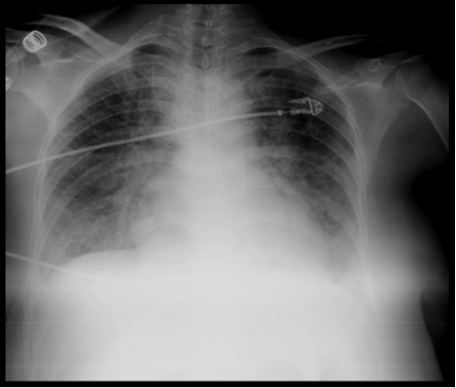
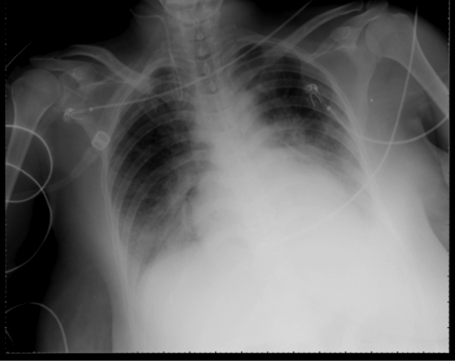
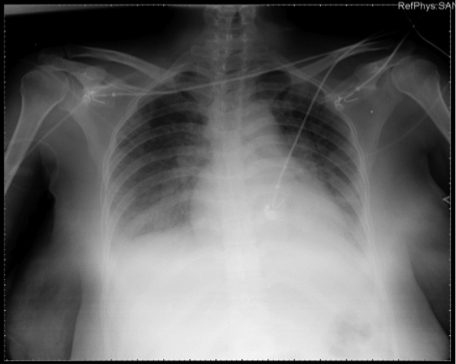
Dos horas después, en sala de recuperación, la paciente evoluciona asintomática, recibe perfusión de analgesia con Ketorolaco, y oxitocina. Recibe oxígeno por gafas nasales a 3 L/min. Se detectan cifras de presión arterial elevadas (sistólica 160-170, diastólica 90-99) y disminución progresiva de la SatO2 hasta 88%. Se observa buen estado general, sin aumento del trabajo respiratorio. Gasometría arterial: pH 7,39 HCO3: 21,6 PaO2: 51 PCO2: 36. Se auscultan roncos espiratorios en ambas bases pulmonares que progresan posteriormente a estertores crepitantes en ambos cuadrantes basales. No se auscultan ruidos cardíacos patológicos, ritmo sinusal en monitor a 80-90 lpm. Diuresis escasa. Se instaura tratamiento con Oxígeno al 50%, furosemida IV, nebulización con salbutamol y bromuro de ipratropio. Se canaliza vía central trilumen en VYID y arteria radial izquierda. Rx de tórax portátil: infiltrados alvéolo-intersticiales en los dos tercios inferiores de ambos pulmones, refuerzo perihiliar. Ligera cardiomegalia. EKG: ritmo sinusal a 90 lpm, eje QRS y repolarización normal.
Se pasa a la unidad de reanimación (REA) del hospital general para vigilancia y tratamiento postoperatorio. PVC: 6-9 mmHg. Valorada por cardiología de guardia que practica Ecocardiografia de urgencias: contractilidad normal, sin alteraciones estructurales evidentes.
Analítica al ingreso a REA: ProBNP: 672, Creatinina: 0,57, PCR: 0,7, Na: 140, K: 3,1, Cl: 104.
La paciente siguió tratamiento con oxígeno suplementario y diuresis forzada, obteniendo evolución favorable, mejoría del ritmo diurético, parámetros de oxigenación arterial, auscultación pulmonar y la congestión en la radiografía de tórax. Recibió el alta a planta en menos de 12 horas. Las cifras de presión arterial regresaron a valores normales, sin tratamiento específico. No recibió transfusión de hemoderivados. Permaneció afebril durante todo su ingreso.
Analítica al alta de REA: HB: 8, Plaq: 246.000, WBC: 12.500, AP: 94%, proBNP: 798, PCR: 1,6, PCT: 0,17, Urea: 23, Creat: 0,63.
Analítica al alta de planta (4 días después): HB: 11,5, Plaq: 521.000, WBC: 12.030, N: 71%, VCM: 78 , HCM: 25
Discusión
Las causas más frecuentes de hipoxemia en el postoperatorio inmediato son las atelectasias y la hipoventilación alveolar. Aunque es menos habitual, el edema pulmonar puede producirse, entre otras causas, por obstrucción de la vía aérea, sepsis o transfusión de hemoderivados (TRALI)([i]).
En nuestra paciente no se evidenció retención de dióxido carbónico, y el nivel de conciencia y patrón respiratorio eran normales, por lo que descartamos la hipoventilación alveolar como causa (p.ej.: efecto residual de anestésicos, opioides, relajantes musculares). La auscultación pulmonar y radiografía de tórax no eran compatibles con atelectasias como etiología causal.
Interpretamos el cuadro clínico de nuestra paciente como un edema agudo de pulmón (EAP) en el contexto de puerperio y postoperatorio inmediatos por cesárea bajo anestesia general.
La tasa de filtración de líquido transcapilar está definida por fuerzas (resumidas en la ecuación de Starling) que normalmente se mantienen en equilibrio: presión hidrostática, presión coloidosmótica y permeabilidad capilar. Se deduce que los factores que aumentan la presión hidrostática que disminuyen la presión coloidosmótica o que aumentan la permeabilidad capilar predisponen al EAP. Frecuentemente existe más de un factor de riesgo presente([ii]).
El diagnóstico diferencial incluye: pre-eclampsia, EAP cardiogénico (cardiopatía estructural, miocardiopatía periparto), TRALI, tromboembolismo pulmonar, embolismo de líquido amniótico, EAP post-obstructivo (de presión negativa), EAP neurogénico, iatrogenia.
En las mujeres embarazadas existen diferencias fisiológicas subyacentes que aumentan la predisposición a padecer EAP. Los principales cambios fisiológicos durante la gestación normal son el incremento del volumen plasmático, la frecuencia y el gasto cardíaco y el descenso de las resistencias vasculares periféricas. El incremento del gasto cardíaco no es constante debido a fluctuación de la compresión uterina sobre la vena cava inferior según la posición materna, lo que disminuye el retorno venoso. La contractilidad del ventrículo izquierdo se deprime ligeramente pero la fracción de eyección se mantiene. Además, el embarazo se asocia a disminución del cociente: presión coloidosmótica/presión ventricular izquierda telediastólica, predisponiendo a las embarazadas a desarrollar EAP([ii]). Durante el parto, se producen cambios hemodinámicos importantes a causa del dolor, la ansiedad y las contracciones uterinas. Las contracciones uterinas implican un incremento agudo de un 50% en el volumen intravascular, dado que en cada contracción se trasfieren de 300 a 400 ml de sangre desde el útero a la circulación. El postparto inmediato implica un riesgo cardiovascular especial, ya que el gasto cardíaco aumenta de un 60 a un 80% a pesar de la hemorragia externa, debido a la descompresión de la VCI y a la transferencia de sangre desde el útero contraído([iii]).
La preeclampsia es causa infrecuente de EAP incluso en procesos severos. Ocurre en alrededor del 3% de todas las preeclampsias, 70% de ellos, después del parto. Implica enfermedad severa y es una de las mayores causas de mortalidad en preeclampticas([ii]). No había historia clínica compatible: No se documentó proteinuria ni datos de Síndrome HELLP. Aunque una crisis hipertensiva puede ser desencadenante de EAP, la hipertensión arterial en nuestra paciente únicamente se presenció durante el inicio de la desaturación, sin llegar a valores críticos, y se resolvió sin tratamiento específico al mejorar los parámetros de intercambio gaseoso, todo lo cual sugiere que podría ser secundaria a la liberación de catecolaminas por la propia hipoxemia.
La miocardiopatía periparto es la disfunción sistólica ventricular izquierda que se desarrolla en el último mes de gestación o en la mayoría de los casos en el postparto inmediato. No se conoce bien la etiopatogenia. Tiene una elevada mortalidad referida superior al 20%([iii]). La ligera cardiomegalia observada en la Rx de tórax de nuestra paciente puede deberse a que es una técnica portátil, tomada en antero-posterior, por lo cual la silueta cardíaca se proyecta magnificada. Clásicamente se ha dividido el EAP en cardiogénico y no cardiogénico. En el EAP cardiogénico se asume un aumento de la presión hidrostática en el capilar pulmonar como desencadenante del EAP. Anteriormente se teorizaba que la medición de la presión venosa central (PVC) podría orientar a la etiología del EAP y a optimizar el tratamiento. En la actualidad, cada vez está más cuestionado el papel de la PVC como valoración del estado de precarga. En nuestra paciente observamos como el catéter insertado por VYID hace un bucle y retorna hacia el cuello, quedando en una posición subóptima para medición de PVC. El ecocardiograma sin alteraciones valvulares, o funcionales, con FEVI de 59%, nos permite descartar alteraciones estructurales cardíacas (cardiopatía preexistente, miocardiopatía de estrés o miocardiopatía periparto).
El TRALI (lesión pulmonar aguda relacionada con la transfusión) produce un cuadro de EAP secundario a la transfusión de hemoderivados. Se discuten mecanismos inmunológicos y no inmunológicos. Nuestra paciente no recibió transfusiones de hemoderivados; solamente con el tratamiento diurético, pasó de tener una Hb de 8 a una Hb de 11,5 en el transcurso de 4 días de puerperio. Esto señala la notoria hemodilución presente desde el momento de su ingreso.
El tromboembolismo pulmonar (TEP) puede producir un cuadro similar de hipoxemia con hipocarbia, pero lo más frecuente es encontrar una auscultación pulmonar y radiografía de tórax normal. Los signos patognomónicos son infrecuentes tanto en Rx como en EKG. Además en nuestra paciente la evolución posterior con respuesta clínica rápida y favorable al tratamiento depletor de volumen no concuerda con la historia natural de este proceso.
El embolismo de líquido amniótico se presenta clínicamente como una insuficiencia respiratoria grave con requerimiento de ventilación mecánica, colapso cardiovascular, coagulopatía. La radiografía de tórax es compatible con EAP. Más del 80% de los casos desemboca en parada cardíaca. Nuestra paciente mantuvo en todo momento un buen estado general, sin signos de bajo gasto cardíaco o coagulopatía.
EL EAP post-obstructivo (de presión negativa) suele desarrollarse a consecuencia de laringoespasmo. La incidencia varía de 0,05 a 1% de pacientes bajo anestesia general. La mayoría ocurren durante la educción anestésica. Típicamente son hombres jóvenes con fuerza muscular normal o aumentada (necesaria para generar la presión negativa suficiente). Posterior a la extubación desarrollan obstrucción de la vía aérea superior secundaria a laringoespasmo, hipoxemia y rápidamente desarrollan EAP (menos de 10 minutos), llegando en algunos casos a requerir reintubación. Este cuadro puede ser secundario a estimulación repetida de la vía aérea (p.ej., intubación difícil), acumulación de sangre o secreciones en la faringe, vómitos, tabaquismo, asma y reflujo gastro-esofágico. Otros factores de riesgo son obesidad, cirugía de vía respiratoria alta, SAOS. También puede presentarse en pacientes sin factores de riesgo, especialmente aquellos extubados en plano anestésico 2 (no completamente despiertos)([iv]). La radiografía de tórax suele ser de EAP con infiltrados perihiliares alveolares, bilaterales y simétricos (en alas de mariposa)([v]). Nuestra paciente se intubó y extubó sin complicaciones; presentó ligero retardo en el despertar anestésico y en recuperar ritmo respiratorio propio, pero no se extubó hasta estar consciente y obedecer órdenes. No se evidenciaron datos de laringoespasmo ni tenía factores de riesgo.
EL EAP neurógeno se debe sospechar en enfermos que presentan lesión aguda y grave en el sistema nervioso central que de manera súbita desarrollan insuficiencia respiratoria y disminución de la PaO2/FiO2. La presentación clínica es aguda y proporcional a la magnitud de la lesión neurológica. Los disparadores son el incremento de la PIC que induce un estado global de disminución de la perfusión cerebral y/o la lesión de centros específicos. EL EAP neurógeno es resultado de una gran descarga simpática que resulta en incremento de la presión hidrostática con la consecuente ruptura de la barrera capilar pulmonar e incremento de la permeabilidad para agua y proteínas([vi]). Nuestra paciente tenía alteraciones estructurales cerebrales precedentes compatibles con hipoxia perinatal, sin evento agudo desencadenante.
La iatrogenia es una causa importante de EAP en ausencia de hipertensión. Nuestra paciente estuvo ingresada durante 4 días previos, recibiendo tratamiento con Betametasona y antibioticoterapia combinada intravenosa. Recibió Prostaglandina E2 vaginal y Oxitocina en perfusión para inducción del parto, estando durante 12 horas en paritorio, con sueroterapia no controlada. Durante el alumbramiento recibe nueva dosis de Oxitocina 20 UI IV, según protocolo del servicio en nuestro hospital. Teóricamente la betametasona tiene un mínimo efecto mineralocorticoide. Los antibióticos IV durante 4 días implican un aporte hidro-salino adicional. La oxitocina causa un aumento de la PAP media del 33% respecto a su valor basal y de la presión capilar pulmonar del 35% lo que sumado a su efecto antidiurético en dosis altas o en partos prolongados en los que se ha administrado gran volumen de líquidos puede desencadenar EAP([vii]).
Conclusión
La etiología del EAP de nuestra paciente probablemente es multifactorial: anemia, hemodilución, disminución de la presión coloidosmótica, autotransfusión del puerperio, iatrogenia (esteroides, oxitocina, prostaglandinas, aporte hidrosalino IV no restringido).
El embarazo y especialmente el período periparto entrañan un mayor riesgo de EAP. Parece prudente mantener un control estricto del aporte hídrico para no aumentar aún más el riesgo de nuestras pacientes a presentar esta complicación.
Bibliografía
[i] Miller R, Eriksson L, Fleisher L, Wiener-Kronish J, Young W editores. Miller Anestesia. Vol 2. 7a edición. Barcelona: Elsevier; 2010. (web)
[ii] Dennis A, Solnordal C. Acute pulmonary oedema in pregnant women. Anaesthesia 2012, 67, 646-659. (PubMed)
[iii] Pijuan A, Gatzoulis M. Embarazo y cardiopatía. Rev Esp cardiol. 2006; 59(9): 971-84.
[iv] Mulkey Z, Yaarbrough S, Guerra D, Roongsritong C, Nugent K, Phy MP. Postextubation pulmonary edema: a case series and review. Respiratory Medicine. 2008; 102, 1659-1662. (PubMed)
[v] Carels K, Herpels V, Cardoen L, lecluyse C, Traen S, Verschakelen J. Postextubation pulmonary edema: an unusual causeof transient pulmonary edema. JBR-BTR. 2013; 96, 17-18. (PubMed)
[vi] Carrillo R, Castro F, Leal P, Carrillo JR, Carrillo LD. Actualidades en terapia intensiva neurológica. Edema pulmonar neurogénico. Rev Asoc Mex Med Crit y Ter Int. 2010; 24(2): 59-65. (pdf)
[vii] Rodríguez de la Torre M, Gallego J, Gil M. Edema pulmonar en una cesárea relacionado con la administración de 15-metil prostagandina F2α. Rev. Esp. Anestesiol. Reanim. 2004; 51: 104-107. (PubMed) (pdf)
Marcos Hernández Vásquez1
Jesús López Pérez2
Bruno Alfonso Colomer3
Raquel López López4 1,3 Médico Interno Residente, Anestesiología y Reanimación
Hospital Universitario Virgen de la Arrixaca, Murcia, España.
2,4 Facultativo Especialista Adjunto, Anestesiología y Reanimación
Hospital Universitario Virgen de la Arrixaca, Murcia, España.



Magnífica revisión sobre las causas de EAP en pacientes obstétricas. Tan solo un pero en la forma, no en el fondo. «Severo», en castellano, significa estricto o rudo («un castigo severo»). También se puede aplicar a determinadas condiciones climáticas. El igual del «severe» inglés es en español, simplemente grave («un infarto grave»).
Por otra parte, la construcción de frases ampulosas («movilidad exterior» por emigración, por ejemplo) es algo cada vez más habitual. «Barrera idiomática», es una construcción que chirría en mi modets opinión, por mucho que se use en todas nuestra historias clínicas.
Excelente exposición del caso, solo faltaría agregar sus balances, hídricos, porque al parecer recibió muchos medicamentos con alto poder nefrotoxicos, que disminuyen mucho la filtración glomerular y la perfusión renal, aunado a que la embarazada tolera muy mal los cambios bruscos en las presiones de perfusion renal, tal vez y debido a los tiempos pico de actuación sobre todo de AINES, pareciera que fue la causa principal desencadenante. La oxitocina pudo ser un disparador.
Saludos y felicidades.
Que opina acerca de las relaciones entre medicos casados cuando se hacen sus especialidades y que terminan divorciandose y desintegrando familias? Dr. Mario Francisco Aguilar Arzapalo
Cordial saludo.
Muchas gracias por sus comentarios.
Desafortunadamente, no tenemos disponible registro del balance hídrico de la paciente previo a entrada a quirófano. Sabemos que había estado oligúrica, los días previos, pero no se cuantificó la diuresis en planta ni en paritorio. Tampoco se llevó un control estricto del aporte hídrico. Con esto en mente, lo más probable es que entre la oliguria y el aporte hídrico no controlado, durante varios días, se produjo un balance hídrico muy positivo, y que en presencia de anemia, hemodilución, disminución de la presión coloidosmótica, la autotransfusión del puerperio, y la administración de oxitocina durante horas de inducción del parto desencadenaran el EAP sin identificar alteraciones en la ecocardiografía (todas estos aspectos favorecen según la ecuación de Starling la fuga de liquido desde el capilar hacia el intersticio como se explica en el artículo).
Pero ¿a qué obedeció esa oliguria inicial?
Esa parte no está clara: No se objetivó alteración objetiva en las pruebas analíticas de función renal, por lo que no sería atribuible el evento a nefrotoxicidad por aminoglucósidos. Los AINES fueron administrados en perfusión lenta y a posteriori de la oliguria observada como para atribuirles la etiología del EAP. El aumento de la presión abdominal por el útero grávido condiciona algún grado de alteración de la perfusión renal pero no parece ser el factor único y suficiente.
Así, existen múltiples factores que aportan cada uno su alícuota en la fisiopatología de la aparición de este evento. Algunos pueden ser controlados por nosotros pero otros hacen parte inexorable del embarazo y el puerperio inmediato y no son modificables. Para prevenir la aparición de complicaciones en las pacientes, probablemente deberíamos trabajar sobre estos factores que sí podemos modificar (desde llevar registro adecuado del balance hídrico en planta y paritorio hasta conocer a fondo la farmacología de los medicamentos que utilizamos a diario para poder identificar sus efectos adversos cuando aparecen).
De nuevo, gracias.
Este artículo está excelente. Muy completo. Gracias x ayudarnos a ser mejores profesionales.
A ti por comentarlo. Un saludo.