Gerónimo Pardo, M., Monsalve Naharro, JA., López Pérez, A.
Complejo Hospitalario Universitario de Albacete.
Cómo citar este artículo: Gerónimo Pardo, M., Monsalve Naharro, J. Ángel, & López Pérez, A. (2014). Administración intencionada de bupivacaína /levobupivacaína intravenosa: revisión de la literatura. Caso clínico. Revista Electrónica AnestesiaR, 6(3), 2. https://doi.org/10.30445/rear.v6i3.216
Resumen
Comunicamos el empleo de levobupivacaína en perfusión intravenosa para control del dolor agudo intenso de características neuropáticas en un paciente afecto de metástasis hepáticas y pulmonares tras ser sometido a una quimioembolización hepática.
Introducción
Desde hace décadas se contempla el empleo de anestésicos locales por vía intravenosa con intención terapéutica, si bien el control del dolor ha sido la indicación más habitual y los anestésicos locales más comunmente empleados han sido la procaína (1) y posteriormente la lidocaína (2). Es bien conocido que la bupivacaína posee un efecto anestésico/analgésico más potente que los 2 anestésicos anteriormente citados, pero los autores no conocemos referencias de su empleo sistémico. Es más, desde que el residente inicia su andadura como anestesiólogo es advertido de que la administración intravenosa accidental de bupivacaína causa serios efectos adversos e incluso el fallecimiento del paciente, lo cual sí ha sido documentado (3-7).
La levobupivacaína, el isómero levógiro de la bupivacaína racémica, fue introducida en la práctica clínica para la realización de técnicas locorregionales con el fin de reducir el potencial tóxico pues, a priori, posee un mejor perfil de seguridad que el isómero dextrógiro (8-9). No obstante, también han sido comunicados casos de toxicidad por levobupivacaína tras la realización de bloqueos locorregionales (10-12) o tras su administración errónea intravenosa directa (13).
A continuación comunicamos el caso de un paciente afecto de dolor neuropático agudo, dolor que quedó satisfactoriamente controlado tras la administración intencionada de levobupivacaína en perfusión intravenosa.
Caso Clínico
Paciente varón de 51 años y 75 kg. de peso, con antecedentes de resección anterior de recto y de resección de metástasis hepáticas y pulmonares por adenocarcinoma de recto.
En la actualidad, afecto de nuevas metástasis pulmonares y hepáticas, pendiente de confirmación de metástasis vertebrales.
Sufría un cuadro de dolor irruptivo de características neuropáticas a nivel torácico irradiado en cinturón a epigastrio, agravado por el decúbito supino y con interferencia del reposo nocturno.
En tratamiento por la Unidad del Dolor, con la siguiente pauta: oxicodona/naloxona 25/12,5-0-40/20 mg., dexibuprofeno 400 mg./12h., paracetamol 1 g. nocturno, y rescates de fentanilo intranasal 100 mcg. ad libitum.
Como parte del manejo de su dolor fue indicada la realización de quimioembolización de metástasis hepáticas, la cual se realizó mediante acceso por arteria femoral.
En la técnica anestésica la colocación de un catéter epidural fue desestimada por la posibilidad de que existiesen metástasis vertebrales, y se realizó una sedación profunda basada en perfusiones de propofol (1 mg./kg./h.) y remifentanilo (0,15 mcg./kg./min.).
Al final del procedimiento se le administró un bolo intravenoso de 75 mcg. de fentanilo y se ingresó en la Unidad de Recuperación Postanestésica (URPA) para vigilancia con la recomendación por parte de los radiólogos intervencionistas de permanecer durante 24 horas en reposo absoluto.
En el postoperatorio inmediato presentó cuadro de dolor intenso, EVA 10, requiriendo un nuevo bolo de 150 mcg. de fentanilo junto con 6 mg. de morfina, así como la administración de 1 g. de paracetamol y de 50 mg. de dexketoprofeno, con resultado de mínima reducción en la intensidad del dolor.
Ante las características de dolor neuropático se decidió administrar un bolo de 100 mg. de lidocaína intravenosa, con mínima reducción del dolor.
Tras ello, se decidió administrar una perfusión de levobupivacaína intravenosa. Se solicitó el consentimiento del paciente, el cual fue obtenido verbalmente. Se inició la administración intravenosa de 50 mg. de levobupivacaína diluida en 500 mL. de suero salino fisiológico a una velocidad de infusión de 250 mL./h., con vigilancia monitorizada continuada y presencia del anestesiólogo de guardia encargado de la URPA. Como medida preventiva adicional fue localizado un frasco de emulsión lipídica al 20%.
La evolución del dolor fue favorable. Al inicio de la infusión de levobupivacaína tenía un valor de 8 puntos en la escala EVA y en unos 10 minutos comenzó a descender hasta llegar a un mínimo de 2, mantenido hasta el final de la perfusión.
El paciente permaneció confortable y calmado, y no refirió experimentar ningún síntoma compatible con toxicidad leve por el anestésico local. Se mantuvo hemodinámicamente estable con reducción, dentro de rango de normalidad, de los valores de frecuencia cardíaca y tensión arterial, atribuibles al control del dolor.
Hasta su alta de la URPA requirió 2 bolos adicionales de rescate con Fentanilo IV.
El tratamiento analgésico para el alta fue modificado según indicaciones de la Unidad del Dolor.
Discusión
Hemos comunicado un caso en el que la administración de levobupivacaína en perfusión intravenosa permitió rescatar una situación de dolor neuropático agudo tras una quimiembolización hepática. Varios aspectos merecen ser comentados.
La situación clínica del paciente demandaba una actuación rápida, tanto por el intenso dolor que sufría como por el continuo movimiento al que le obligaba el dolor. Situaciones clínicas similares a ésta son difíciles de prever y cuando ocurren generan actuaciones diversas en función de la experiencia del médico responsable y del contexto socioeconómico en el que trabaje.
En nuestro caso la naturaleza neuropática del dolor nos condujo a emplear anestésicos locales por vía sistémica, y elegimos de inicio la lidocaína porque es el anestésico local que mayor confianza nos ofrecía por experiencia propia y por soporte bibliográfico (2). Sin embargo, un primer bolo intravenoso de lidocaína fue ineficaz y, por ello, en lugar de continuar con una perfusión, nos planteamos administrar un anestésico local más potente.
Elegimos la levobupivacaína porque, teóricamente, presenta un perfil de eficacia similar a la bupivacaína racémica con un perfil de seguridad mejorado (8-9), y con esta nueva actuación el dolor quedó controlado. Estamos convencidos de que otros anestesiólogos habrían empleado alternativas diferentes de haberse visto involucrados en esta tesitura y también de que nuestra actuación puede ser calificada como temeraria por algunos lectores, pero a continuación queremos mostrar que el peligro de la administración de levobupivacaína intravenosa no deriva tanto de la vía de administración (intravenosa) como del modo de empleo, siendo la perfusión mucho más segura que el bolo.
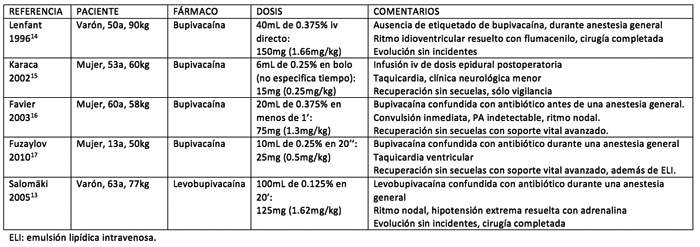
Efectivamente, existe numerosa literatura soportando la idea de que la administración intravenosa accidental en bolos de dosis de bupivacaína o levobupivacaína calculadas para la realización de técnicas locorregionales ha ocasionado efectos adversos importantes en los pacientes. Dado que siempre existe incertidumbre acerca de la cantidad de anestésico que ha podido alcanzar la circulación sistémica, de entre los numerosos ejemplos comunicados de toxicidad por bupivacaína o levobupivacaína hemos destacado aquellos casos en los que el anestésico ha sido infundido directamente por vía intravenosa y, por tanto, se conoce precisamente la dosis y la cronología de los efectos (13-17) (Tabla 1). Salvo un caso de error humano, en el que la administración se hizo intravenosa en lugar de epidural (15), los otros 4 fueron debidos a confusiones del anestésico con el antibiótico por no identificar adecuadamente la medicación (13,14,16,17), error que es fácilmente prevenible realizando un correcto etiquetado pero que sigue sucediendo (18). Todos estos casos de administración intravenosa por error evolucionaron favorablemente (Tabla 1).
Tabla 1.- Administración intravenosa por error de bupivacaína/levobupivacaína
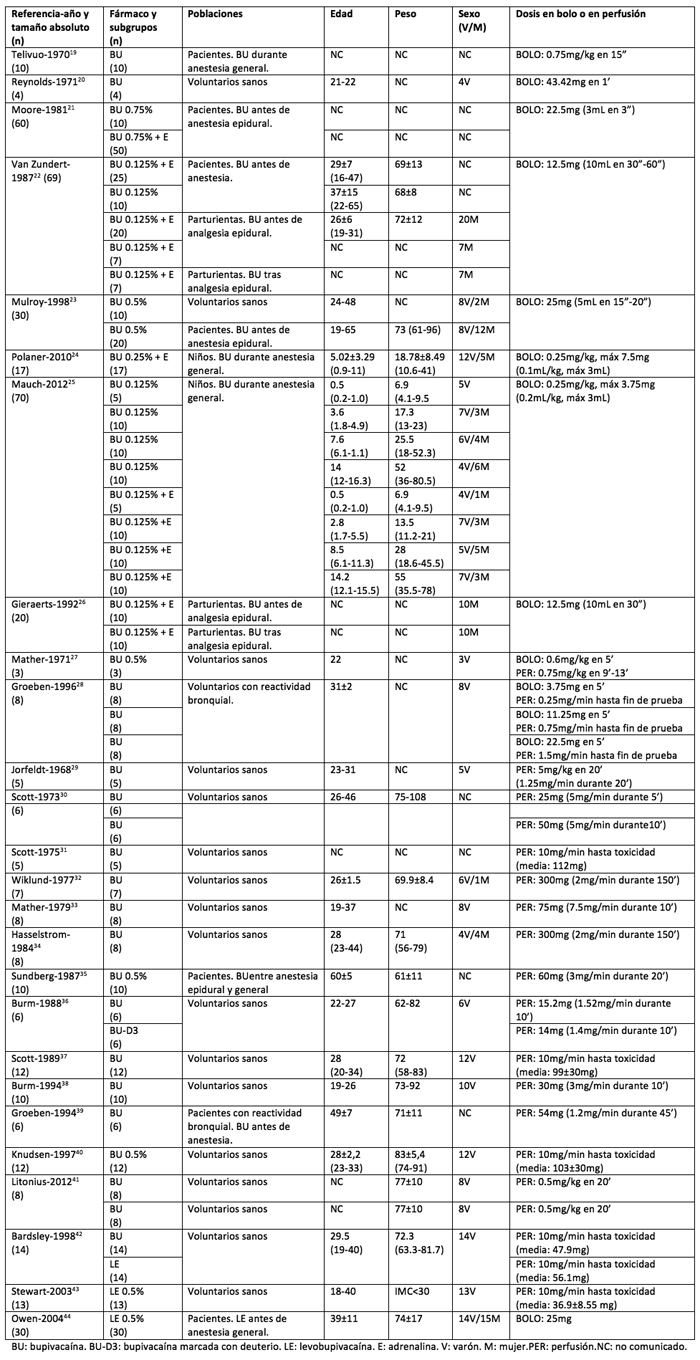
Por otra parte, la infusión intravenosa intencionada de bupivacaína (19-42) o de levobupivacaína (42-44) no es una novedad en la literatura médica (Tabla 2). En estos 26 trabajos se puede observar heterogeneidad tanto en los objetivos del estudio como en los sujetos participantes en ellos. En voluntarios sanos ha sido estudiado el comportamiento farmacocinético (20,27,30,31,36-38,41) y el potencial de toxicidad mediante el estudio de los efectos neurológicos centrales (27,31,33,40,43), los efectos cardiovasculares (27,29,32-34,37,40,42,43) y los efectos sobre la capacidad respiratoria (29). En pacientes sometidos a anestesia también han sido estudiados los efectos cardiovasculares (35) y respiratorios (19).
Muchos de los trabajos publicados tienen como objetivo estudiar la eficacia de la dosis test para detectar inyección intravascular inadvertida durante la realización de técnicas locorregionales, lo cual ha sido estudiado en gestantes con epidural de parto (22,26) y en pacientes sometidos a anestesia, tanto adultos (21,23,44) como niños (24-25).
Finalmente, queremos resaltar una línea de investigación en especial ya que, al igual que en el caso presentado, los investigadores pretendían estudiar el potencial terapéutico de la administración intravenosa intencionada de bupivacaína, en concreto para atenuar el efecto broncoconstrictor en situaciones de hiperreactividad bronquial, y esto lo estudiaron en sujetos afectos de reactividad bronquial, tanto voluntarios (28) como pacientes sometidos a anestesia (39).
Tabla 2.- Administración intravenosa intencionada de bupivacaína/levobupivacaína
La seguridad de estas actuaciones ha sido muy elevada. En estas 26 comunicaciones citadas se describen 444 administraciones intravenosas de bupivacaína racémica a 408 pacientes, y 57 de levobupivacaína a otros 57 pacientes, para un total de 501 administraciones en 451 pacientes (14 pacientes recibieron ambos preparados (42)). Sólo hay descrito 1 caso de efecto adverso severo: se trataba de una voluntaria joven que presentó 2 crisis convulsivas 135 minutos tras el inicio de una perfusión de bupivacaína a 2 mg./min., con la que las concentraciones plasmáticas obtenidas fueron a priori seguras (inferiores a 1,2 mg./L., muy lejos de los 4 mg./L. considerados tradicionalmente como umbral convulsivo) (45). La joven se recuperó sin secuelas.
En esas comunicaciones también hay descritos efectos adversos no severos. Lógicamente estos efectos adversos fueron numerosos en los 56 voluntarios participantes en las 5 investigaciones cuyo objetivo era infundir el fármaco hasta la aparición de algún signo o síntoma de toxicidad (31,37,40,42,43). Pero en el resto de 430 administraciones a 394 sujetos la administración de bupivacaína o levobupivacaína fue bien tolerada a las dosis administradas o sólo causó molestias leves. En nuestro caso la perfusión de levobupivacaína fue muy bien tolerada.
El modo de empleo de levobupivacaína elegido merece una amplia reflexión en cuanto a la elección de la dilución, de la velocidad de infusión y del tiempo de infusión.
Carecemos de referentes válidos para guiar la dosificación de levobupivacaína intravenosa administrada con intención analgésica. La velocidad de infusión que decidimos emplear fue de 25 mg./h. (0,42 mg./min.) durante 120 minutos para una dosis total de 50 mg. (0,67 mg./kg. en este paciente concreto). Esta pauta surge de la conveniencia arbitraria de diluir una ampolla de 10 mL. de levobupivacaína 0,5% en un suero salino fisiológico de 500 mL., y administrarla durante 2 horas, dilución que además garantiza la imposibilidad de que pueda ser administrado por accidente una cantidad elevada de fármaco en poco tiempo con las consecuencias que ya hemos comentado (13-17) (Tabla 1).
Las velocidades de infusión empleadas por los autores de los trabajos resumidos en la tabla 2 son diversas. Existe coincidencia en la velocidad de infusión elegida por los autores cuyo objetivo era investigar la toxicidad, 10 mg./min. (31,37,40,42,43), pero el resto oscilan entre un máximo de 7,5 mg./min. y un mínimo de 0,25 mg./min. (Tabla 2). Algunos de estos trabajos eligieron la velocidad de infusión basándose en que a dicha velocidad se alcanzan concentraciones plasmáticas similares a las que se obtienen tras la realización de una técnica locorregional (28,33,34,39).
Comparadas con ellas nuestra velocidad de infusión parece muy reducida, pues sólo es superior a los 0,25 mg./min.empleados en voluntarios con reactividad bronquial (28), pero realmente se desconoce qué concentración plasmática libre podría ser efectiva para lograr analgesia cuando la bupivacaína/levobupivacaína es administrada por vía sistémica ya que en humanos no ha sido llevada a cabo ninguna investigación sobre su capacidad analgésica cuando es infundida por vía intravenosa. De hecho, en el contexto de la administración intravenosa existe un número escaso de investigaciones sobre la concentración plasmática libre (38,40,41) comparado con las que investigaron la concentración plasmática total (20,27-42).
La bupivacaína/levobupivacaína circula unida en un elevado porcentaje a proteínas plasmáticas (albúmina y especialmente alfa-1-glicoproteína ácida), por lo que la relación entre la fracción plasmática libre y total depende del estado proteico del paciente (46-47). Por tanto, desde un punto de vista farmacocinético está justificado reducir las velocidades de infusión en situaciones de hipoproteinemia.
En el caso de nuestro paciente no existía hipoproteinemia (6,8 g./dL.) ni hipoalbuminemia (4 g./dL.), por lo que era poco probable que estuviese baja la concentración de alfa-1-glicoproteína ácida (no estaba determinaba). A pesar de ello, nuestra intención fue titular la velocidad inicial al alza según los requerimientos de dolor, pero esta velocidad no fue modificada porque el dolor quedó rápidamente controlado. No obstante, debemos recordar que la administración de levobupivacaína no fue un hecho aislado, sino que se hizo en un contexto en el que ya habían sido administrados opioides y lidocaína, por lo que es lógico suponer que se produjo algún efecto analgésico si no sinérgico sí, al menos, aditivo.
El tiempo de infusión fue producto igualmente de una mezcla de conveniencia y prudencia. Una vez completada la dosis de 50 mg.. y con el paciente notablemente satisfecho en cuanto al control del dolor y libre de efectos adversos, decidimos no continuar con la infusión por precaución. Si la velocidad de infusión excede la velocidad de eliminación los niveles plasmáticos de levobupivacaína aumentarán continuamente y, finalmente, podrían aparecer signos de toxicidad. Lógicamente, en el contexto de la perfusión continua las concentraciones plasmáticas de un fármaco irán elevándose con el tiempo conforme se aproximan a la situación de estado de equilibrio (29,32,34,35,40).
Además de ello, conforme el dolor del paciente iba desapareciendo iría reduciéndose también el efecto dilucional del estado hiperdinámico generado por dicho dolor, lo cual contribuiría al incremento de las concentraciones plasmáticas del fármaco (48). En el caso de la voluntaria sana joven que sufrió una convulsión, Hasselstrom y Mogensen atribuyen dicha convulsión en parte a un descenso del 33% en el gasto cardíaco, lo cual contribuiría al incremento de la concentración plasmática de bupivacaína (45).
Y, por último, debemos considerar que en la degradación oxidativa de la levobupivacaína intervienen los sistemas microsomales de la isoforma CYP3A4 del citocromo p450 (49), los cuales están localizados predominantemente a nivel hepático (50). Desconocíamos la reserva funcional hepática del paciente, pero sospechábamos que no debía ser buena debido tanto a su patología de base como al procedimiento realizado.
Por estas 3 razones decidimos prudentemente no continuar con la infusión de levobupivacaína.
La conclusión es que la infusión intravenosa cuidadosa de levobupivacaína puede ser una alternativa válida para el manejo de situaciones de dolor neuropático agudo de difícil control. Por supuesto, somos conscientes de que esta actuación merece ser estudiada en el contexto de un ensayo clínico reglado, lo cual no es óbice para que los facultativos que no estamos en disposición de realizar tales ensayos nutramos la literatura médica con casos clínicos o series de casos.
Bibliografía
1.- Gordon RA. Intravenous procaine. Clinical applications. Can Med Assoc J 1948;59(6):534-535. (PubMed) (pdf)
2.- Challapalli V, Tremont-Lukats IW, McNicol ED, Lau J, Carr DB. Systemic administration of local anesthetic agents to relieve neuropathic pain. Cochrane Database Syst Rev 2005;(4):CD003345. (PubMed)
3.- Albright GA. Editorial: Cardiac arrest following regional anesthesia with etidocaine or bupivacaine. Anesthesiology 1979;51(4):285-287. (PubMed) (pdf)
4.- Heath ML. Deaths after intravenous regional anesthesia. Br Med J (Clin Res Ed) 1982;285(6346):913-914. (PubMed) (pdf)
5.- Heath ML. Bupivacaine toxicity and Bier blocks. Anesthesiology 1983;59;(5):481. (PubMed) (pdf)
6.- Guay J. Adverse events associated with intravenous regional anesthesia (Bier block): a systematic review of complications. J Clin Anesth 2009;21(8):585-594. (PubMed)
7.- Errando CL, Freijo JJ, Vila M, Tardón L. Toxicidad de los anestésicos locales. Prevención y tratamiento. Rev Esp Anestesiol Reanim 2013;60(Supl 1):65-72. (pdf)
8.- Gristwood R, Bardsley H, Baker H, Dickens J. Reduced cardiotoxicity of levobupivacaine compared with racemic bupivacaine (Marcaine): new clinical experience. Exp Opin Invest Drugs 1994;3(11):1209-1212.
9.- Leone S, Di Cianni S, Casati A, Fanelli G. Pharmacology, toxicology, and clinical use of new long acting local anesthetics, ropivacaína and levobupivacaine. Acta Biomed 2008;79(2):92-105. (PubMed) (pdf)
10.- Kopacz J, Allen HW. Accidental intravenous levobupivacaine. Anesth Analg 1999;89(4):1027-1029. (PubMed)
11.- Pirotta D, Sprigge J. Convulsions following axillary brachial plexus blockade with levobupivacaine. Anesthesia 2002;57(12):1187-1189. (PubMed)
12.- Khan H, Atanasoff PG. Accidental intravascular injection of levobupivacaine and lidocaine during the transarterial approach to the axillary brachial plexus. Can J Anaesth 2003;50(1):95. (PubMed)
13.- Salomí¤ki TE, Laurila PA, Ville J. Successful resuscitation after cardiovascular collapse following accidental intravenous infusión of levobupivacaine during general anesthesia. Anesthesiology 2005;103(5):1095-1096. (PubMed) (pdf) (epub)
14.- Lenfant F, Volot F, Freysz M, Wilkening M. Le flumazenil corrige-t-il les troubles de la conduction intracardiaque induits par l“™injection intraveineuse accidentelle de bupivacaine? Ann Fr Anesth Réanim 1996;15(8):1196-1198. (PubMed)
15.- Karaca S, íœnlí¼soy Eí–. Accidental injection of intravenous bupivacaine. Eur J Anaesthesiol 2002;19(8):616-617. (PubMed)
16.- Favier JC, da Conceií§ao M, Fassassi M, Allanic L, Steiner T, Pitti R. Successful resuscitation of serious bupivacaine intoxication in a patient with pre-existing heart failure. Can J Anesth 2003;50(1):62-66. (PubMed)
17.- Fuzaylov G, Ying B, Tang Y, Sethnas NF. Successful resuscitation after inadvertent intravenous injection of bupivacaine in an adolescent. Pediatr Anesth 2010; 20(10):958-959. (PubMed)
18.- Gómez Arnau JI, Bartolomé A, García del Valle S, Puebla G, Santa íšrsula JA, Marzal JM, Arnal D, González A, González R. Errores de medicación y etiquetado de las jeringas. Rev Esp Anestesiol Reanim 2013;60(Supl 1):27-33. (PubMed)
19.- Telivuo L, Katz RL. The effects of modern intravenous local analgesics on respiration during partial neuromuscular block in man. Anaesthesia 1970;25(1):30-35. (PubMed)
20.- Reynolds F. Metabolism and excretion of bupivacaine in man: a comparison with mepivacaine. Br J Anaesth 1971;43(1):33-37. (PubMed)
21.- Moore DC, Batra MS. The components of an effective test dose prior to epidural block. Anesthesiology 1981;55(6):693-696. (PubMed) (pdf)
22.- van Zundert A, Vaes L, Soetens M, de Vel M, van der Aa, van der Donck, Meeuwis H, de Wolf A. Every dose given in epidural analgesia for vaginal delivery can be a test dose. Anesthesiology 1987;67(3):436-440. (PubMed) (pdf)
23.- Mulroy M, Neal JM, Mackey DC, Harrington BE. 2-chloroprocaine and bupivacaine are unreliable indicators of intravascular injection in the premedicated patient. Reg Anesth Pain Med 1998;23(1):9-13. (PubMed)
24.- Polaner DM, Zuk J, Luong K, Pan Z. Positive intravascular test dose criteria in children during total intravenous anesthesia with propofol and remifentanil are different than during inhaled anesthesia. Anesth Analg 2010;110(1):41-45. (PubMed)
25.- Mauch JY, Spielmann N, Hartnack S, Weiss M. Electrocardiographic and haemodynamic alterations caused by three different test solutions of local anaesthetics to detect accidental intravascular injection in children. Br J Anaesth 2012;108(2):283-289. (PubMed)
26.- Gieraerts R, van Zundert A, de Wolf A, Vaes L. Ten ml bupivacaine 0.125% with 12.5µg epinephrine is a reliable epidural test dose to detect inadvertent intravascular injection in obstetric patients. A double-blind study. Acta Anaesthesiol Scand 1992;36(7):656-659. (PubMed)
27.- Mather LE, Long GJ, Thomas J. The intravenous toxicity and clearance of bupivacaine in man. Clin Pharmacol Ther 1971;12(6):935-943. (PubMed)
28.- Groeben H, Schwalen A, Irsfeld S, Stieglitz S, Lipfert P, Hopf HB. Intravenous lidocaine and bupivacaine dose-dependently attenuate bronchial hyperreactivity in awake volunteers. Anesthesiology 1996;84(3):533-539. (PubMed) (pdf) (epub)
29.- Jorfeldt L, Lí¶fstrí¶m B, Pernow B, Persson B, Wahren J, Widman B. The effect of local anaesthetics on the central circulation and respiration in man and dog. Acta Anaesthesiol Scand 1968;12(4):153-169. (PubMed)
30.- Scott DB, Jebson PJR, Boyes RN. Pharmacokinetic study of the local anaesthetics bupivacaine (Marcain) and etidocaine (Duranest) in man. Br J Anaesth 1973;45(10):1010-1012. (PubMed)
31.- Scott DB. Evaluation of the toxicity of local anaesthetic agents. Br J Anaesth 1975;47(1):56-61. (PubMed)
32.- Wiklund L. Human hepatic blood flow and its relation to systemic circulation during intravenous infusion of bupivacaine or etidocaine. Acta Anaesth Scand 1977;21(3):189-199. (PubMed)
33.- Mather LE, Tucker GT, Murphy TM, Stanton-Hicks MA, Bonica JJ. Cardiovascular and subjective central nervous system effects of long-acting local anaesthetics in man. Anaesth Intensive Care 1979;7(3):215-221. (PubMed)
34.- Hasselstrom LJ, Mogensen T, Kehlet H, Christensen NJ. Effects of intravenous bupivacaine on cardiovascular function and plasma catecholamine levels in humans. Anesth Analg 1984;63(12):1053-1058. (PubMed)
35.- Sundberg A, Wattwil M, Wiklund L. Haemodynamic effects of intravenous bupivacaine during high thoracic epidural anaesthesia. Acta Anaesthesiol Scand 1987;31(2):143-147. (PubMed)
36.- Burm AG, de Boer AG, van Kleef JW, Vermeulen NP, de Leede LG, Spierdijk J, Breimer DD. Pharmacokinetics of lidocaine and bupivacaine and stable isotope labeled analogues: a study in healthy volunteers. Biopharm Drug Dispos 1988;9(1):85-91. (PubMed)
37.- Scott DB, Lee A, Fagan D, Bowler GMR, Bloomfield P, Lundh R. Acute toxicity of ropivacaína compared with that of bupivacaine. Anesth Analg 1989;69(5):563-569. (PubMed)
38.- Burm AGL, van der Meer AD, van Kleef JW, Zeijlmans PWM, Groen K. Pharmacokinetics of the enantiomers of bupivacaine following intravenous administration of the racemate. Br J Clin Pharmacol 1994;38(2):125-129. (PubMed) (pdf)
39.- Groeben H, Schwalen A, Irsfeld S, Tarnow J, Lipfert P, Hopf HB. High thoracic epidural anesthesia does not alter airway resistance and attenuates the response to an inhalational provocation provocation test in patients with bronchial hyperreactivity. Anesthesiology 1994;81(4):868-874. (PubMed) (pdf)
40.- Knudsen K, Beckman-Suurkí¼la M, Blomberg S, Sjí¶vall J, Edvardsson N. Central nervous and cardiovascular effects of i.v. infusions of ropivacaína, bupivacaine and placebo in volunteers. Br J Anaesth 1997;78(5):507-514. (PubMed)
41.- Litonius E, Tarkkila P, Neuvonen PJ, Rosenberg PH. Effect of intravenous lipid emulsion on bupivacaine plasma concentration in humans. Anaesthesia 2012;67(6):600-605. (PubMed)
42.- Bardsley H, Gristwood R, Baker H, Watson N, Nimmo W. A comparison of the cardiovascular effects of levobupivacaine and rac-bupivacaine following intravenous administration to healthy volunteers. Br J Clin Pharmacol 1998;46(3):245-249. (PubMed) (pdf) (epub)
43.- Stewart J, Kellett N, Castro D. The central nervous system and cardiovascular effects of levobupivacaine and ropivacaína in healthy volunteers. Anesth Analg 2003;97(2):412-416. (PubMed)
44.- Owen MD, Gautier P, Hood DD. Can ropivacaine and levobupivacaine be used as test doses during regional anesthesia? Anesthesiology 2004;100(4):922-925. (PubMed) (pdf) (epub)
45.- Hasselstrom LJ, Mogensen T. Toxic reaction of bupivacaine at low plasma concentration. Anesthesiology 1984;61(1):99-100. (PubMed) (pdf)
46.- Tucker GT, Mather LE. Pharmacokinetics of local anesthetic agents. Br J Anaesth 1975;47suppl:213-224. (PubMed)
47.- Mather LE, Copeland SE, Ladd LA. Acute toxicity of local anesthetics: underlying pharmacokinetic and pharmacodynamic concepts. Reg Anesth Pain Med 2005;30(6):553-566. (PubMed)
48.- Scott DB. Toxic effects of local anaesthetic agents on the central nervous system. Br J Anaesth 1986;58(7):732-735. (PubMed)
49.- Gantenbein M, Attolini L, Bruguerolle B, Villard PH, Puyoou F, Durand A, Lacarelle B, Hardwigsen J, Le-Treut YP. Oxidative metabolism of bupivacaine into pipecolylxylidine in humans is mainly catalyzed by CYP3A. Drug Metab Dispos 2000;28(4):383-385. (PubMed) (pdf)
50.- Venkatakrishnan K, Von Moltke LL, Greenblatt DJ. Human drug metabolism and the cytochromes P450: application and relevance of in vitro models. J Clin Pharmacol 2001;41(11):1149-1179. (PubMed)
Manuel Gerónimo Pardo Doctor en Medicina. Especialista en Farmacología ClínicaEspecialista en Anestesiología y Reanimación
Complejo Hospitalario Universitario de Albacete José Angel Monsalve Naharro Especialista en Anestesiología y Reanimación
Complejo Hospitalario Universitario de Albacete Alfonso López Pérez Especialista en Anestesiología y Reanimación
Complejo Hospitalario Universitario de Albacete


Primero quiero felicitar a los medicos responsables del caso, tanto por implicarse a ayudar un paciente en tan malas condiciones como este.. asi como la actitud temeraria y hasta cierto punto con seguras implicaciones legales … Como medicos que yo tambien lo soy tomamos decisiones a diario y casi siempre lo hacemos según la medicina basa en la evidencia .. tanto para ayudar el paciente con la mejor opción terapeutica disponible. sino tambien para poder justificar nuestra actuación ante un tribunal .. (de ser necesario) .. me quito el sombrero ante esa toma de decisión tan dificil.. y sobre todo porque le fue beneficioso al paciente.. saludos
por cierto muy buena web..