Quel Collado, M.T. (1), Vela de Toro, A. (2), Guerrero Jiménez, M. (3)
(1) MIR Anestesiología, Reanimación y Terapia del Dolor. Complejo Hospitalario de Granada.
(2) FEA Anestesiología, Reanimación y Terapia del Dolor. Complejo Hospitalario de Granada.
(3) MIR Psiquiatría. Hospital de Santa Ana. Motril. Granada.
Introducción
La anestesia neuroaxial (epidural y subaracnoideo) causa bloqueo simpático, analgesia sensitiva y bloqueo motor en distintos grados dependiendo de la técnica utilizada, la dosis, la concentración y el volumen de fármaco utilizado. Son técnicas muy útiles en gran cantidad de procedimientos quirúrgicos. Sin embargo, el debate de la seguridad y eficacia de estas técnicas ha aumentado desde finales del siglo XX (1). Sus complicaciones neurológicas suelen ser leves y transitorias. Pero las mayores, aunque infrecuentes, suelen ser muy graves (1).
La gestante constituye un grupo muy especial, ya que son jóvenes y sanas, y son las personas que con mayor frecuencia reciben anestesia-analgesia neuroaxial, ya sea para la cesárea y/o analgesia obstétrica2. Las complicaciones neurológicas más frecuentes en este grupo son la cefalea pospunción dural (CPPD), dolor lumbar postparto, y el daño de nervios periféricos. Sin embargo, el proceso mismo del nacimiento puede producir daño neurológico por compresión de arterias pélvicas que son parte del aporte vascular medular, o lo que es más frecuente, por compresión nerviosa (2).
La CPPD en obstetricia fue descrita en 1898 por Bier, que la atribuyó a la pérdida de líquido cefalorraquídeo (LCR) (3). Se produce por lesión de la duramadre en la anestesia subaracnoidea (1%), en la punción dural accidental (PDA) durante la anestesia epidural (incidencia de 0,5-2,5%, con aparición de CPPD hasta en un 85%), implantación de dispositivos intratecales, punción intratecal diagnóstica, quimioterapia intratecal o mielografía (3).
El nervio craneal más frecuentemente afectado es el VI par (motor ocular externo o abducens), generalmente por compresión local o variación en la presión del LCR, debido a su largo recorrido intracraneal. El VI par puede afectarse uni o bilateralmente (4,5).
Presentación del caso
Puérpera de 35 años de edad con antecedentes de trastorno de la conducta alimentaria (bulimia). Abortos de repetición. Gestación normoevolutiva sin incidencias.
Realizamos técnica epidural para analgesia del parto, mediante técnica de ¨perdida de resistencia¨, con suero, con aguja 18 Gauge Touhy, siendo el test aspirativo, de LCR y sangre, y la dosis test con bupivacaina 0.25% con adrenalina negativas.
Parto eutócico con ingreso del recién nacido por aspiración de meconio durante 72 horas. A las 24 horas de la punción lumbar (PL), comienza con cefalea fronto-occipital de intensidad leve, sin relación con el ortostatimo, sin nauseas, vómitos, foto-sonofobia, ni otra clínica acompañante. Se le instaura analgesia y es dada de alta a domicilio tras 48 horas. La cefalea le pareció trivial y relacionada con las pocas horas de sueño, el estrés propio de la situación de madre primeriza, y el ingreso de su bebe, por lo que no consultó inicialmente.
Tres días después del alta hospitalaria, desarrolla diplopía, asociada a dolor orbitario con los movimientos oculares horizontales y a la supraversión. No presentó vértigo, nauseas, vómitos, fiebre ni otros síntomas.
En la exploración general se observó tensión arterial de 190/110 mmHg, y neurológicamente se detectó la paresia del músculo recto externo del ojo izquierdo secundaria a afectación del VI par craneal izquierdo, siendo el resto de la exploración normal.
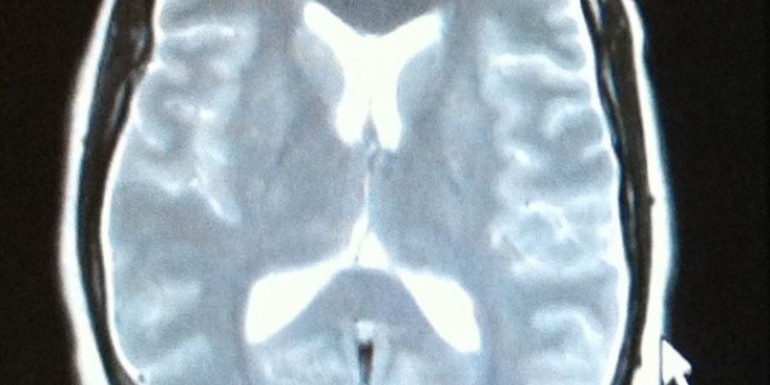
La analítica general (hemograma, bioquímica, coagulación, estudio de trombofilia, y autoinmunidad), electrocardiograma, radiografía de tórax y TAC craneal fueron normales. En la resonancia magnética (RNM) craneal se observa engrosamiento y aumento de intensidad en secuencias pT2 y FLAIR de la duramadre de ambas convexidades y dilatación del sistema venoso generalizado en probable relación con hipotensión intracraneal (hTIC). Hipoplasia del segmento P1 de ambas arterias cerebrales posteriores (imagen 1). En la RNM de columna lumbar observamos aumento de señal en secuencias pT2 de los espacios interespinosos L3-4 y L4-5, con leve captación de contraste e ingurgitación de las venas epidurales en probable relación con hipotensión de LCR, sin evidenciarse fístula de LCR.
Inicialmente el tratamiento fue conservador (reposo, hidratación, corticoides intravenosos y cafeína oral). Pero tras una semana sin mejoría se decide realizar PHE (parche hemático), sin incidencias. Tras 24 horas desaparece la cefalea y mejora la diplopía, por lo que la paciente es dada de alta a las 72 horas de la técnica.
Imagen 1: Hipoplasia del segmento P1 de ambas arterias cerebrales posteriores
Discusión
La cefalea es un hallazgo común en el periodo postparto (11-80%) (3). En ausencia de focalidad neurológica, el primer diagnóstico a considerar es una cefalea primaria (cefalea tensional, migraña). Pero si existe el antecedente de una técnica neuroaxial, y se relaciona con el ortostatismo, debe sospecharse una CPPD. En nuestro caso, no tenía antecedentes de cefalea primaria, y al presentar antecedentes de una técnica neuroaxial, se postuló la CPPD con afectación de nervio craneal, como primera opción etiológica.
En las gestantes que reciben analgesia epidural, la incidencia de PDA oscila entre 0-6,5% y la PDI se estima en un 16-33%, siendo la cefalea en el puerperio el primer dato de la PDA. En mujeres que en el trabajo de parto sufren una PDA con una aguja 18G Touhy, la incidencia de CPPD llega al 76-85%.
La afectación del VI par craneal suele acontecer en el contexto de un síndrome de hTIC con la cefalea característica y el resto de síntomas típicos (mareo, nauseas o vómitos) (6). En nuestro caso la diplopía se precedió de cefalea, pero esta no tenía relación con el ortostatismo, y no se acompañaba de otros síntomas. Puede asociar pérdida auditiva, que se recupera por completo cuando se restaura la presión del LCR, náuseas y vómitos, por tracción del nervio vago, parálisis oculomotora, estrabismo y diplopía, por tracción de los pares craneales IV y VI, y tracción de los nervios cervicales 1º-3º que generan dolor cervical (3).
Se desconoce la fisiopatología del síndrome de hTIC, aunque la hipótesis más aceptada es que la pérdida dural de LCR tras la PL ocasionaría una pérdida de la suspensión hidráulica del encéfalo. Esto provoca tracción mecánica de estructuras intracraneales produciendo cefalea y daño del VI par (3, 6). Y, según la hipótesis de Monro-Kellie, se produciría una vasodilatación compensatoria de las venas intracraneales (3). Por tanto, la hTIC desempeña un papel clave. De hecho, se han descrito casos de paresia del VI par en pacientes con hTIC espontánea, sin PL previa.
El cuadro clínico suele ser subagudo, y tiende a aparecer en los tres primeros días tras la lesión de la duramadre (90-99%) siendo rara su aparición entre los días 5º y 14º (3). Pero en ocasiones, puede aparecer hasta 3 semanas después, por la que el paciente e incluso un facultativo puede no relacionarla con dicha técnica, sobre todo si no es una cefalea típica de hTIC, retrasando el diagnóstico y el tratamiento. Por dicho motivo estos especialistas deben estar alerta y ante un afectación de un nervio oculomotor, tras una PL los días previos debe considerarse la PDI con hTIC (2,4).
La distribución típica de la CPPD es fronto-occipital, no pulsátil, irradiándose a cuello y hombros, de intensidad variable y con frecuencia se acompaña de rigidez de nuca. En nuestra paciente apareció a las 24 horas de la PL, de intensidad leve y opresiva.
El diagnóstico de la CPPD es clínico, siendo el componente postural un elemento distintivo y esencial. En posición erguida, la presión intracraneal (PIC) baja y la vasodilatación intracraneal aumenta, empeorando la cefalea (3). En supino, se igualan las presiones de LCR en las cisternas intracraneales y en el compartimento lumbar, con mejoría de la misma. En nuestro caso particular, la cefalea no tenía relación con el ortostatismo.
Es de extrema importancia el diagnóstico diferencial, para excluir causas potencialmente graves y tratables. Entre ellas está la hipertensión arterial (HTA) y la preeclampsia. En estos casos, habitualmente la cefalea no tiene componente postural. Y estaría indicado realizar pruebas complementarias de imagen para descartar una complicación intracraneal, siendo de elección la RNM cerebral (3). En nuestro caso, la cefalea era fronto-occipital opresiva, sin componente postural. La paciente presentó HTA posparto que se controlo con antihipertensivos habituales, sin mejoría de la cefalea, por lo que se consideró importante realizar pruebas de imagen para descartar otras causas.
Los hallazgos más frecuentes en la RNM cerebral son el realce difuso meníngeo y la disminución del tamaño de los ventrículos. Otras descripciones incluyen: descenso de las amígdalas cerebelosas, disminución de la cisterna prepontina, desplazamiento inferior del quiasma óptico, borramiento de las cisternas periquiasmáticas, compresión de las estructuras de la fosa posterior, aumento de la pituitaria, ingurgitación de los senos venosos y elongación del tallo cerebral en el plano anteroposterior. A nivel espinal, aparece fluido extradural, y realce de los senos venosos, con ingurgitación de los plexos venosos epidurales (3,7). En nuestro caso tanto en la RNM cerebral como lumbar, se apreciaba ingurgitación de los senos venosos y los plexos venos epidurales respectivamente, sugerentes de hTIC.
La CPPD suele ser leve y tiene un curso benigno con resolución en pocas semanas (3), por lo que se recomienda inicialmente tratamiento conservador (3,8). Pero en determinados casos, que no han realizado tratamiento puede durar meses, incluso años, y ser recurrente.
El tratamiento conservador consiste en reposo en cama en posición decúbito supino y analgésicos orales, incluyendo los opiáceos. La hidratación y fajas abdominales no son necesarias (3, 8). Esta terapia está indicada si el paciente no desea PHE o si la cefalea no es grave.
El PHE es el tratamiento de elección para la cefalea moderada-severa debilitante secundaria a la punción dural, refractaria a tratamiento conservador, y siendo una técnica efectiva, con un alivio casi en la totalidad de casos. Se realiza mediante la inyección de 10 a 20 ml de sangre del paciente en el espacio epidural, y bajo estrictas medidas de asepsia, siendo efecto casi inmediato, por el sellado de la fuga y la velocidad de producción de LCR (3, 8).
Otra alternativa sería el bloqueo del ganglio esfenopalatino vía transnasal. Aunque no hay ensayos que comparan este tratamiento con otros tratamientos de la CPPD, y puede considerarse en pacientes que no desean el PHE (3, 8).
El tratamiento de las lesiones oculares consiste en la hidratación y la utilización de PHE de sangre autóloga con buena respuesta, aunque no siempre esta terapia es eficaz para el tratamiento de la paresia. Esté debe hacerse en las primeras 24 horas desde el inicio del cuadro. Algunos pacientes han llegado a precisar tratamiento quirúrgico para corregir las alteraciones oculares (9, 10).
Bibliografía
1. Tornero-Tornero JC, Gómez-Gómez M, Fabregat-Cid G, Aliaga-Font L, Roqués-Escolar V, Escamilla-Cañete B, et al. Complicaciones tras técnicas de anestesia regional. Rev. Esp. Anestesiol. Reanim. 2008; 55: 552-562 (PubMed) (HTML) (PDF)
2. MacArthur AL. Neurological complications of regional obstetric anesthesia. Thech Reg Anesth Pain Manage 2003; 7: 229-234.
3. López-Correa T, Garzón-Sánchez JC, Sánchez-Montero FJ, Muriel-Villoria C. Cefalea postpunción dural en obstetricia.Rev Esp Anestesiol Reanim. 2011; 58: 563-573 (PDF)
4. Nishio I, Williams BA, Williams JP. Diplopia: a complication of dural puncture. Anesthesiology. 2004; 100: 158—164. (PubMed) (HTML+PDF)
5. Thömke F, Mika-Grüttner A, Visbeck A, Brühl K. The risk of abducens palsy after diagnostic lumbar puncture. Neurology. 2000; 54: 768—769. (PubMed)
6. Lafuente N, Mateo A, Izquierdo B, Gutiérrez N. Parálisis del sexto par craneal derecho como complicación de bloqueo epidural. Rev Esp Anestesiol Reanim. 2008; 55: 251—253. (PubMed) (HTML) (PDF)
7. Reina MA, Álvarez-Linera J, López A, Benito-León J, De Andrés JA, Sola RG. Aportaciones de la Resonancia magnética en la cefalea pospunción dural y en pacientes que cursan con hipotensión de líquido cefalorraquídeo. Rev Esp Anestesiol Reanim. 2002; 49: 89—100. (PubMed)
8. Van Kooten F, Oedit R, Bakker SL, Dippel DW. Epidural blood patch in post dural puncture headache: a randomised, observer-blind, controlled clinical trial. J Neurol Neurosurg Psychiatry 2008; 79:553-558. (PubMed) (HTML) (PDF)
9. Béchard P, Perron G, Larochelle D, Lacroix M, Labourdette A, Dolbec P. Case report: epidural blood patch in the treatment of abducens palsy after a dural puncture. Can J Anaesth. 2007; 54: 146—150. (PubMed) (HTML) (PDF)
10. Salazar F, Villalonga A, Alfaro M, Anglada T, González JL, Nalda MA. Parálisis del VI par craneal tras anestesia intradural. Rev Esp Anestesiol Reanim. 1985; 32: 193—194. (PubMed)