Bes Miras S (1), Cara Salmerón V (2), Cortiñas Sáenz M (3), Soto Ontoso M (4).
(1) MIR Anestesiología y Reanimación. Hospital Torrecárdenas de Almería.
(2) Enfermera del Bloque quirúrgico. Hospital Torrecárdenas de Almería.
(3) FEA Anestesiología y Reanimación. Hospital Torrecárdenas de Almería.
(4) FEA Psiquiatría. Hospital Torrecárdenas de Almería.
Cómo citar este artículo: Bes Miras, S., Cara Salmerón, V., Cortiñas Sáenz, M., & Soto Ontoso, M. (2020). Efectos No Analgésicos del Clorhidrato de Ketamina. Nuevas Indicaciones. Revista Electrónica AnestesiaR, 11(6), 1. https://doi.org/10.30445/rear.v11i6.751
Resumen
El clorhidrato de ketamina (CKTM) es un agente anestésico disociativo, con un lugar único en la práctica anestésica. Fue descrito por primera vez en la literatura en 1965, y aprobado por la Food and Drug Adminstration (FDA) en 1970, siendo introducido comercialmente con la descripción del fabricante como la de un «anestésico general no barbitúrico de acción rápida». Este fármaco se considera como el único anestésico completo, ya que brinda una anestesia real que incluye hipnosis, analgesia y protección neuroendocrina, además de amnesia considerable. Además, las respuestas inadecuadas que durante un tiempo conllevaron su mínimo uso podrían ser minimizadas o abolidas con el uso de fármacos adyuvantes como las benzodiazepinas y las butirofenonas.
Este fármaco ha contribuido de manera notable al conocimiento anestésico-analgésico, así como de los cuadros depresivos y esquizofrénicos. Hoy en día continúa arrojando luz sobre las bases moleculares del dolor, hipnosis y la fisiopatología de los diferentes trastornos neuropsiquiátricos. Por sus propiedades farmacológicas y clínicas únicas, así como por sus nuevas indicaciones descubiertas recientemente, el CKTM actualmente tiene una amplia variedad de aplicaciones clínicas. Tanto los efectos neuroprotectores, antiinflamatorios y antitumorales descubiertos en los últimos años, como los hallazgos sobre la utilidad de los regímenes de dosis bajas de CKTM, han contribuido a ampliar el perfil de aplicación clínica de este medicamento. El importante papel que juega en la actualidad, se corrobora por las miles de citas bibliográficas que continúan apareciendo en la literatura médica mundial.
Esta revisión presenta las principales indicaciones off label en el campo de la psiquiatría, como son su empleo en cuadros de depresión resistente a tratamiento, trastornos obsesivos compulsivos, estrés postraumático, suicidio, insomnio, terapia electroconvulsiva, etc. En resumen, se ratifica su versatilidad, tanto en las múltiples vías de administración, como en los conceptos de protección cerebral y potenciación de analgesia perioperatoria. Por el contrario, se ha informado de la presencia de tolerancia, inducción enzimática hepática, así como múltiples y diversos eventos adversos con su administración crónica.
Introducción
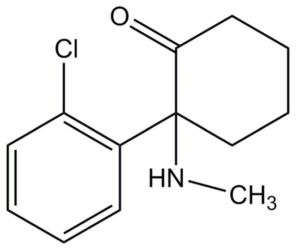
El clorhidrato de ketamina (CKTM) fue sintetizado en 1962 por Stevens, y usado por primera vez en humanos por Corsen y Domino (1). El CKTM es un derivado de la feniciclidina, perteneciente a la familia de las arilciclohexilaminas. Es un compuesto cristalino parcialmente hidrosoluble cuya formulación química es el (R, S)-2-(O-clorofenil)-2-metilaminociclohexanona, con un peso molecular de 238 kDa, y un pKa de 7,5 (2) (Figura 1).
Las vías de administración son variadas, habiéndose descrito su uso intravenoso, intramuscular, oral, intranasal, transdérmico, rectal, epidural o intradural. Sin embargo, no todas ellas están aprobadas por la FDA. Es además destacable su baja unión a proteínas plasmáticas de la que se deriva excelente penetración a través de la barrera hematoencefálica, así como su metabolismo mayoritariamente hepático a norketamina, compuesto activo, aunque menos potente (3).
Su preparado comercial más frecuentemente usado es la mezcla racémica de 2 esteroisómeros S (+) y R(-), estando disponible en algunos países el preparado formado únicamente por S(+), el cual presenta el doble de potencia y produce importantes efectos neuroprotectores y analgésicos (4).
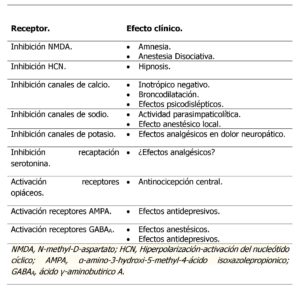
El CKTM es un fármaco antagonista no competitivo de los receptores N-Metil-D-Aspartato (NMDA) empleado como anestésico. Dicho receptor NMDA se encuentra en el sistema nervioso, especialmente en el córtex prefrontal y el hipocampo, y es un ligando del neurotransmisor excitatorio glutamato (4). Se conoce además la existencia de interacciones con los receptores opioides, monoaminergicos, colinérgicos, purinérgicos y adrenoreceptores, además de tener efectos anestésicos locales. Ha de tenerse en cuenta en su mecanismo de acción la existencia de diferentes tipos de receptor NMDA, lo cual puede adquirir importancia en la investigación y descubrimiento de nuevas indicaciones terapéuticas. En la Tabla 1 se exponen los efectos clínicos en función de la inhibición y/o activación de diferentes receptores.
Desde hace más de 4 décadas existen indicios de su papel en otras patologías, y así Domino EF (1) en un reciente artículo de revisión de esta molécula relata que recuerda a una joven tratada por él, con un cuadro de depresión mayor y adicta a drogas por vía parenteral, que en las diversas sesiones de deshabituación para abandonar el uso ilícito de CKTM, su respuesta siempre era: “Oh, doctor, mis antidepresivos no funcionan tan bien como el CKTM pero su efecto dura poco y debo emplearlo con frecuencia”.Posee un amplio espectro de efectos farmacológicos entre los que se incluyen la hipnosis, sedación, analgesia somática, broncodilatación y estimulación del sistema nervioso simpático, existiendo una mención reiterada en la literatura actual, a su papel en la prevención de la hiperalgesia y de la sensibilización central. La aparición de nuevos fármacos anestésicos, la presencia de reacciones de emergencia, un entrenamiento mínimo con el CKTM en los anestesiólogos modernos, su estigma como fármaco de la “medicina veterinaria» y su popularidad como potencial fármaco de abuso son factores que deberían haber desalentado su uso por parte de los anestesiólogos actuales (5). Sin embargo, debido a sus propiedades únicas, a sus aplicaciones clínicas recientemente encontradas, así como a su amplio margen terapéutico y bajo coste, ha resistido la prueba del tiempo.
Por tanto, parece existir una aceptación en la literatura médica respecto a la eficacia de este fármaco como tratamiento off-label a dosis subanestésicas en diversas situaciones médicas no relacionadas con la esfera del dolor, especialmente en relación con los efectos neuroprotectores, antiinflamatorios y antitumorales descubiertos en los últimos años. No existe consenso médico ni recomendaciones respecto a la dosis, ruta y frecuencia de administración ideal, habiendo sido mencionado su uso tanto en una sola sesión, como de forma crónica, durante semanas o años.
Ha sido descrito además en la literatura que posiblemente la respuesta a CKTM intravenosa pudiera ser un test predictivo para seleccionar a los pacientes susceptibles de mejorar mediante un tratamiento con CKTM oral. En cualquier caso, se recomienda en los casos de tratamiento domiciliario un seguimiento por el riesgo de abuso a esta sustancia (6).
Todas estas observaciones han abierto un camino para la investigación de otros moduladores glutamatérgicos más selectivos, como son la esketamina intranasal y el rapastinel, así como de su potencial aplicación en estas patologías (7). Por otra parte, agentes que incluyen dextrometorfano-quinidina, memantina, ketamina oral o intranasal podrían usarse para mantener el beneficio del antagonismo del receptor de NDMA después de la infusión intravenosa de CKTM.
Usos clínicos en psiquiatría
- DEPRESIÓN MAYOR RESISTENTE A TRATAMIENTO
El CKTM ha sido investigado ampliamente como una opción antidepresiva potencial para la depresión unipolar y bipolar resistente al tratamiento (8). Murrough et al (9) informan de tasas de éxito de la terapia tras infusión aislada de hasta un 64%. A diferencia de los antidepresivos tradicionales, produce efectos el mismo día de la administración de forma prácticamente inmediata, muy probablemente a través de su interacción con los neurotransmisores serotonina y norepinefrina, y de una mayor transmisión glutamatérgica y plasticidad sináptica. Diversos estudios afirman que el tratamiento con CKTM es tan efectivo como la terapia electroconvulsiva, con la ventaja de un inicio más rápido de efectos en la depresión mayor. Persiste la incertidumbre sobre si la presencia de síntomas psicóticos es una contraindicación para el uso de ketamina.
Múltiples trabajos han demostrado este importante efecto antidepresivo con el uso de CKTM endovenosa a dosis variables (0,1 – 0,75 mg/Kg) (6). El protocolo más habitualmente mencionado en la literatura médica es una dosis de 0,5 mg/Kg durante unos 40 minutos. Loo et al (10) exponen que este efecto es independiente de la vía de administración y ocurre con dosis inferiores a 0,5 mg/Kg.
Mientras que la duración del efecto antidepresivo de una única dosis de CKTM se ha estimado en torno a 4 – 7 días (mucho mayor a las 3 horas de vida media de la ketamina), su administración a intervalos semanales en pacientes con depresión resistente a diversos fármacos que respondieron a la administración de CKTM en fase aguda puede extender su duración de manera notable (3). Este efecto antidepresivo persiste durante varias semanas después de la última dosis (11). Pudiera ser, por tanto, esta terapia farmacológica recomendable como agente adyuvante en pacientes con tratamiento antidepresivo cuya respuesta sea incompleta, en aquellos con necesidad de obtener una rápida respuesta o los resistentes al tratamiento convencional.
- TERAPIA ELECTROCONVULSIVA
Con respecto a la utilización de S-ketamina durante la terapia electroconvulsiva en pacientes con patología psiquiátrica, un estudio mostró su utilidad en la disminución del número de sesiones requeridas, obteniendo tasas cognitivas más altas y una mejora en la evocación de palabras en comparación con el uso de etomidato, recomendando en la mayor parte de los trabajos sobre el tema, la utilización de dosis de 0.8 mg/Kg o superiores. Se ha postulado además, que el ketofol (compuesto formado por la combinación de ketamina:propofol 1:1) determina un incremento de la eficiencia clínica de la terapia electroconvulsiva (12,13).
El CKTM ha demostrado eficacia en la resolución rápida de la sintomatología asociada a la ideación suicida, pudiendo ser por tanto una opción prometedora cuando sea necesaria una intervención urgente. Ha sido descrita una tasa de respuesta del 65% tras la infusión de CKTM intravenosa a dosis de 0,5 mg/Kg (14). El CKTM conllevó además una disminución drástica de los pensamientos autolíticos desde las primeras 24 horas de su administración y se prolongó durante un periodo de 7 días, efecto que fue independiente de su influencia sobre el estado de ánimo. En otro trabajo, en los pacientes que presentaron buena respuesta a la infusión simple, se inició una infusión de CKTM 3 veces por semana durante 2 semanas comprobándose un mantenimiento de la respuesta a lo largo del tiempo (15).
De Gioannis (16) describe el éxito obtenido con su administración por vía oral.
- TRANSTORNOS OBSESIVOS-COMPULSIVOS
Ha sido demostrada la importancia del glutamato en la fisiopatología del trastorno obsesivo compulsivo (TOC) a través de estudios de neuroimagen, genéticos y farmacológicos, habiéndose encontrado además más altos niveles de dicho neurotransmisor en el líquido cefalorraquídeo de pacientes afectos sin tratamiento. En esta dirección fue propuesto que el CKTM, en su capacidad para antagonizar el receptor de glutamato NMDA, pudiera ocupar un lugar como terapia del TOC.
Así, ha sido demostrada la rápida eficacia antiobsesiva de la administración de un dosis intravenosa de 0.5 mg/Kg de CKTM durante 40 minutos, difiriendo sin embargo entre estudios, el tiempo durante el que se prolonga dicho efecto (17).
- TRASTORNO POR ESTRÉS POSTRAUMÁTICO
Existe una creciente evidencia en los últimos años acerca del importante rol del neurotransmisor glutamato, en lo referido a su participación en la respuesta al estrés y en la fisiopatología del estrés postraumático. En este sentido, una sola dosis de 0,5 mg/Kg de CKTM intravenoso durante 40 minutos, se asoció con una reducción muy rápida (inferior a 24 horas) de la sintomatología del estrés postraumático así como de la tendencia depresiva. Esta terapia generalmente fue bien tolerada, sin la aparición de sintomatología disociativa clínicamente significativa (18).
El insomnio y otras alteraciones del sueño asocian un mayor riesgo de suicidio y una disminución de la calidad de vida. Ha sido demostrado que el CKTM a las dosis habitualmente empleadas en la terapia antidepresiva determina una mejora en la calidad del sueño, así como un aumento en la duración del mismo (19).
- TRASTORNO POR ABUSO DE SUSTANCIAS
Dado el importante problema de salud pública que representa el trastorno por abuso de sustancias, ha sido ampliamente estudiado y se han intentado dilucidar sus mecanismos fisiopatológicos, siendo cada vez mencionada con más fuerza la participación de la disregulación glutamatérgica en el córtex prefrontal (20). En este contexto ha sido planteada la potencial eficacia del CKTM como tratamiento de la adicción a algunas sustancias de abuso como son la cocaína, los opioides y el alcohol.
Cocaína
Los trabajos realizados en torno a la adicción a la cocaína, confirman las propiedades del CKTM para disminuir el deseo de consumir, aumentar la motivación para abandonarlo, así como para disminuir la tasa de consumo hasta en un 66%. Con respecto a su duración y a la dosis propuesta, ha sido postulada la persistencia del efecto 48 horas tras la administración de 0.41 mg/Kg de CKTM, así como una disminución de la frecuencia y dosis de consumo de cocaína a las 4 semanas (20).
Opioides
Con respecto al abuso de heroína, ha sido comparada la administración de 2 mg/Kg con 0.2 mg/Kg vía intramuscular, encontrándose una mayor duración del efecto en el grupo que recibió 2 mg/Kg, con una abstinencia del 85% al mes de su infusión y del 24% a los 12 meses, así como una disminución mantenida del deseo de consumir.
Ha sido además comparado al año, el efecto de la administración de una sola dosis (que determinaba una abstinencia del 22%) y de dosis múltiples, las cuales resultaron más eficaces al determinar abstinencia de consumo en el 50% de los casos (20).
Alcohol
El alcohol potencia la neurotransmisión inhibidora mediante el estímulo del receptor tipo A del GABA e inhibe la función del receptor tipo NMDA del neurotransmisor excitador glutamato. La abstinencia alcohólica invierte la inhibición del receptor NMDA, favoreciendo la aparición de síntomas y signos de hiperexcitabilidad y estimula la transmisión dopaminérgica y noradrenérgica. Los benzodiacepinas son los fármacos más estudiados en el tratamiento del síndrome de abstinencia alcohólica y sobre los que hay más evidencias de calidad respecto a su eficacia. El CKTM podría ser una nueva opción al proporcionar un control de los síntomas en pacientes refractarios a benzodiacepinas y reducir los requerimientos de infusión de estas.
Un trabajo en esta dirección estableció la tasa inicial de infusión de CKTM en 0.75 mg/Kg/hora y la dosis máxima en 1.6 mg/Kg/hora. Fue confirmada además su capacidad para disminuir de forma significativa la tasa de infusión de benzodiacepinas (21).
Otro trabajo en esta misma línea evaluó la tasa de abstinencia 1 año tras la administración de CKTM durante 3 meses, la cual se sitúo en el 65.8% frente al 24% de los que recibieron placebo (20).
Conclusión
El CKTM, ha sido ampliamente utilizado en medicina desde su comercialización, especialmente por su gran eficacia anestésica y analgésica. Sin embargo, su capacidad para antagonizar el receptor NMDA del glutamato, ha vislumbrado nuevas propiedades neuroprotectoras, antiinflamatorias, así como antitumorales, determinado potenciales nuevas indicaciones del mismo y llevando al desarrollo de múltiples estudios para constatar su eficacia.
Así, se ha demostrado su utilidad y potencial aplicación en múltiples patologías del campo de la neuropsiquiatría, entre las que se encuentra la depresión resistente al tratamiento, la ideación suicida, el insomnio, el trastorno obsesivo-compulsivo, por estrés postraumático y por abuso de sustancias, así como los beneficios que aporta para aumentar la efectividad de la terapia electroconvulsiva y mejorar la sintomatología en la migraña crónica y disquinesias en la enfermedad de Parkinson.
Se concluye así la gran cantidad y diversidad de potenciales nuevas indicaciones de uso del CKTM, así como la necesidad de confirmación y realización de nuevos trabajos en esta dirección que resuelvan las incógnitas propuestas y afinen y caractericen las posibles futuras aplicaciones aquí expuestas.
Bibliografía
(1) Domino EF. Taming the Ketamine Tiger. Anesthesiology 2010;113:678-84. (PubMed) (HTML)
(2) Way WL, Trevor AJ, White PF. Pharmacology of the ketamine enantiomorphism, status of ketamine in anesthesiology. Edited by Domino EF. Ann Arbor, NPP Books, 1990, pp 101-07.
(3) Radvansky BM, Puri S, Sifonios AN, Eloy JD, Le V. Ketamine – A Narrative Review of Its Uses in Medicine. Am J Ther 2016; 23(6):1-13. (PubMed)
(4) Cohen SP, Bhatia A, Buvanendran A, Schwenk ES, Wasan AD, Hurley RW, et al. Consensus Guidelines on the Use of Intravenous Ketamine Infusions for Chronic Pain From the American Society of Regional Anesthesia and Pain Medicine, the American Academy of Pain Medicine, and the American Society of Anesthesiologists. Reg Anesth Pain Med. 2018;43(5):521-46. (PubMed) (HTML) (PDF)
(5) Stoelting RK, Hillier SC. Nonbarbiturate intravenous anaesthetic drugs. In: Stoelting RK, Hillier SC, editors. Pharmacology and Physiology in Anaesthetic Practice. 4th ed. Philadelphia: Lippincott Williams and Wilkin; 2006. pp 155–78.
(6) Furuhashi-Yonaha A, Iida H, Asano T, Takeda T, Dohi S. Short- and long-term efficacy of oral ketamine in eight chronic-pain patients. Can J Anesth. 2002;49(8):886-7. (PubMed)
(7) Garay RP, Zarate CA, Charpeaud T, Citrome L, Correll CU, Hameg A, et al. Investigational drugs in recent clinical trials for treatment-resistant depression. Expert Rev Neurother. 2017;17(6):593-609. (PubMed) (HTML) (PDF)
(8) Andrade C. Ketamine for Depression, 2: Diagnostic and Contextual Indications. J Clin Psychiatry 2017;78(5):e555-e558. (PubMed)
(9) Murrough JW, Iosifescu DV, Chang LC, Al Jurdi RK, Green CE, Perez AM, et al. Antidepressant efficacy of ketamine in treatment-resistant major depression: a two-site randomized controlled trial. Am J Psychiatry. 2013;170(10):1134-42. (PubMed)
(10) Loo CK, Gálvez V, O’Keefe E, Mitchell PB, Hadzi-Pavlovic D, Leyden J, et al. Placebo‐controlled pilot trial testing dose titration and intravenous, intramuscular and subcutaneous routes for ketamine in depression. Acta Psychiatr Scand. 2016;134(1):48-56. (PubMed)
(11) Vande Voort JL, Morgan RJ, Kung S, Rasmussen KG, Rico J, Palmer BA, et al. Continuation phase intravenous ketamine in adults with treatment-resistant depression. J Affect Disord. 2016;206:300-304. (PubMed)
(12) Kurdi MS, Theerth KA, Deva RS. Ketamine: Current applications in anesthesia, pain, and critical care. Anaesth Essays Res. 2014;8(3):283-90. (PubMed)
(13) Persson J. Wherefore ketamine?. Curr Opin Anaesthesiol. 2010;23(4):455-60. (PubMed)
(14) Grunebaum MF, Ellis SP, Keilp JG, Moitra VK, Cooper TB, Marver JE, et al. Ketamine versus midazolam in bipolar depression with suicidal thoughts: A pilot midazolam-controlled randomized clinical trial. Bipolar Disord. 2017;19(3):176-183. (PubMed)
(15) Aan het Rot M, Collins KA, Murrough JW, Perez AM, Reich DL, Charney DS, et al. Safety and efficacy of repeated-dose intravenous ketamine for treatment-resistant depression. Biol Psychiatry 2010; 67(2):139-45. (PubMed)
(16) De Gioannis A, De Leo D. Oral ketamine augmentation for chronic suicidality in treatment-resistant depression. Aust N Z J Psychiatry. 2014;48(7):686. (PubMed)
(17) Marinova Z, Chuang DM, Fineberg N. Glutamate-Modulating Drugs as a Potential Therapeutic Strategy in Obsessive-Compulsive Disorder. Curr Neuropharmacol. 2017;15(7):977–995. (PubMed)
(18) Feder A, Parides MK, Murrough JW, Perez AM, Morgan JE, Saxena S, et al. Efficacy of intravenous ketamine for treatment of chronic posttraumatic stress disorder: a randomized clinical trial. JAMA Psychiatry. 2014(6);71:681–8. (PubMed)
(19) Vande Voort JL, Ballard ED, Luckenbaugh DA, Bernert RA, Richards EM, Niciu MJ, et al. Antisuicidal Response Following Ketamine Infusion Is Associated With Decreased Nighttime Wakefulness in Major Depressive Disorder and Bipolar Disorder. J Clin Psychiatry. 2017;78(8):1068-1074. (PubMed)
(20) Jones JL, Mateus CF, Malcolm RJ, Brady KT, Back SE. Efficacy of Ketamine in the Treatment of Substance Use Disorders: A Systematic Review. Front Psychiatry. 2018;9(277):1-10. (PubMed)
(21) Tsai G, Gastfriend DR, Coyle JT. The glutamergic basis of human alcoholism. Am J Psychiatry. 1995;152(3):332-40. (PubMed)
Cómo citar: Bes Miras, S., Cara Salmerón, V., Cortiñas Sáenz, M., Soto Ontoso, M. (2020). Efectos No Analgésicos del Clorhidrato de Ketamina. Nuevas Indicaciones. Revista Electrónica AnestesiaR, 11(6), 1. https://doi.org/10.30445/rear.v11i6.751