Sánchez Miguel A (1), Pérez Herrero MA (2)
(1) MIR Anestesiología y Reanimación. Hospital Clínico Universitario de Valladolid.
(2) FEA Anestesiología y Reanimación. Hospital Clínico Universitario de Valladolid.
Cómo citar este artículo: Sánchez Miguel, A., & Pérez Herrero, M. A. (2020). Recomendaciones actuales en el manejo de la hemorragia masiva.: ¿Qué ha cambiado desde el documento HEMOMAS?. Revista Electrónica AnestesiaR, 10(12), 3. https://doi.org/10.30445/rear.v10i12.671
Metodología
Se hizo una búsqueda en marzo de 2018 en la base de datos Medline (Pubmed) utilizando como criterio de búsqueda “massive hemorrhage”, “management” y “guidelines” encontrando 147 resultados limitando el periodo de búsqueda en los últimos 10 años y entre ellos el documento HEMOMAS sobre el consenso en el manejo de hemorragia masiva en el que se recogieron 47 recomendaciones basadas en la evidencia científica actual y del cual pretendemos hacer un resumen que simplifique dicha práctica.
Definiciones
-Definición hemorragia masiva:
Existen distintas definiciones recogidas en la literatura, todas ellas arbitrarias y con escaso valor clínico. Entre las más utilizadas destaca la pérdida de más de 150 ml/min durante más de 10 minutos siempre que las pérdidas sean cuantificables.
Otras definiciones válidas son la pérdida de una volemia en 24 horas, pérdida de media volemia en 3 horas, hemorragia mayor que precisa la transfusión de 4 concentrados de hematíes (CH) en 1 hora o la hemorragia mayor que amenaza la vida y da como resultado una transfusión masiva (TM).
-Definición transfusión masiva
Al igual que en la definición de hemorragia masiva existen distintas definiciones siendo la más aceptada la transfusión de más de 10 CH en 1 día.
Otras igualmente aceptadas son la transfusión de más de un volumen sanguíneo en 1 día o la transfusión de medio volumen sanguíneo en 3 horas.
Etiología
- Politraumatismo
- Cirugía cardiovascular
- Hemorragia postparto
- Hemorragia digestiva
- Cirugía hepatobiliar
Fisiopatología
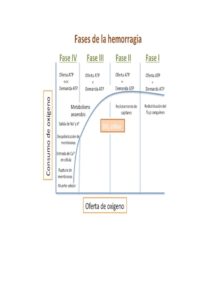
Las pérdidas agudas de sangre disminuyen el transporte de oxígeno mediante una disminución del volumen circulante y un descenso en la hemoglobina.
Inicialmente La respuesta compensadora mantiene el consumo de oxígeno mediante la redistribución del flujo hacia tejidos con una mayor demanda metabólica, un aumento de la extracción tisular de oxígeno y una disminución de las resistencias vasculares locales.
Sobrepasado el umbral entre transporte y demanda metabólica de oxígeno se produce fallo mitocondrial, metabolismo anaerobio y un descenso del consumo de oxígeno tal como se resume en la Imagen 1.
Evaluación de la extensión y/o gravedad.
Son importantes tanto el exámen clínico como la aplicación de escalas de predicción de TM como la TASH (Trauma Associated Severe Haemorrhage) que cuenta con la mayor mejor sensibilidad y especificidad. Otra escala muy empleada que no incluye parámetros de laboratorio que pudieran retrasar la decisión de activación de protocolo de activación de transfusión masiva (PTM) es el ABC (Age, Biomarkers, Clinical History).
Ambas escalas son predictoras de TM en trauma. Incluyen la presión arterial sistólica, frecuencia cardiaca, exceso de bases, niveles de hemoglobina, sexo, y examen clínico.
En cuanto a valores de laboratorio, un déficit de bases mayor a 6, hemoglobina (Hb) menor a 11 y Ph menor de 7,25 han demostrado aumentar significativamente el riesgo de TM y se incluyen en distintas escalas.
¿Mejoran el pronóstico los protocolos de transfusión masiva?
Se ha demostrado que la implementación de protocolos de transfusión masiva reducen la mortalidad y la transfusión de componentes sanguíneos y parece ser debida a la administración en proporciones elevadas de plasma y plaquetas en relación a los concentrados de hematíes tratando de prevenir la coagulopatía.
Por lo general no existe superioridad de un protocolo sobre otro pero la sola implementación y sincronización subsecuente a los PTM suponen una disminución del tiempo necesario para la administración del tratamiento adecuado.
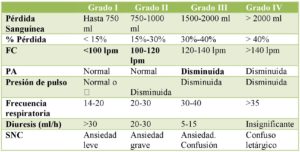
Clasificación hemorragia
Se sugiere basar la valoración inicial en la historia clínica y anamnesis así como en la determinación secuencial de la presión arterial, la frecuencia cardiaca e Índice de shock.
La determinación del exceso de bases y del lactato en la muestra arterial puede ayudar en la valoración de los pacientes de mayor gravedad.
La clasificación de la ATLS para valoración de la extensión mantiene su validez, basada en la rapidez, accesibilidad y ausencia de requerimientos de laboratorio.
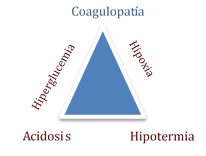
Triada letal
La componen tres factores en el shock hipovolémico que son la coagulopatía, la acidosis y la hipotermia. Recientemente se han añadido la hiperglucemia y la hipoxia como factores que también agravan el pronóstico.
Todos estos factores se encuentran interconectados formando un circulo vicioso, dónde la presencia de cualquiera de ellos, constituye un factor de riesgo para la aparición y agravamiento de los demás elementos, que confieren en conjunto un alto riesgo de mortalidad para el paciente.
Hipotermia
El umbral de temperatura desde el que empeora el pronóstico en estos pacientes es de 35 grados.
Debemos evitar la pérdida de calor e hipotermia.
La disminución del metabolismo hepático, disminución de factores de coagulación, disfunción plaquetaria e inhibición de las reacciones enzimáticas de la cascada de la coagulación surgen como efectos secundarios de la hipotermia aumentando por tanto el sangrado, requerimientos de transfusión y mortalidad.
Por cada grado que descienda la temperatura del paciente disminuirá aproximadamente un 10% la actividad de factores de coagulación y un 15% la agregación plaquetaria aumentando también el sangrado y la necesidad de transfusión.
Coagulopatía
Es un factor independiente de mortalidad siendo la complicación más temible de la hemorragia masiva. Su origen es multifactorial y su tratamiento precoz y agresivo podría mejorar el pronóstico aunque la estrategia más apropiada para su manejo sigue siendo un tema controvertido.
Reposición de volemia
Se recomienda una terapia precoz con fluidoterapia, inicialmente están indicados los cristaloides isotónicos balanceados como el Ringer Lactato salvo en el caso de TCE grave en los que podemos usar soluciones hipertónicas no debiendo retrasar nunca la administración precoz de hemoderivados.
En cuanto a la administración de coloides sigue siendo un tema controvertido porque aunque se ha asociado a daño renal y a aumento de la mortalidad en pacientes sépticos, esto no se ha demostrado en la administración como reposición de volumen en caso de shock hemorrágico. Por lo que se recomienda que si se decide usar siempre en las dosis indicadas por los fabricantes y con una vigilancia de la función renal de 90 días.
Se recomienda una restricción moderada del aporte de volumen, usando si es preciso una reanimación hipotensiva hasta control del foco de sangrado usando vasopresores si no hay respuesta a fluidoterapia hasta alcanzar el siguiente objetivo:
Monitorización
Como monitorización se recomienda la variables dinámicas como Variación del Volumen Sistólico (VVS) y Variación de la Presión de Pulso (VPP), frente a las estáticas antes mencionadas para predecir la respuesta a la administración de fluidos en los pacientes con hemorragia severa en ventilación mecánica controlada y ritmo cardiaco normal. Tanto la presión venosa central como la presión capilar pulmonar tienen escaso valor predictivo para determinar la respuesta hemodinámica a la carga de volumen.
El gold standard es la determinación continua del gasto cardiaco. La ausencia de incremento del mismo en respuesta a la carga de volumen aconsejaría ser muy cauto en la administración de fluidos para evitar la congestión venosa.
Determinaciones de laboratorio
Se recomienda la determinación precoz y seriada de parámetros como hemoglobina, lactato, exceso de bases y las pruebas de coagulación (TP, INR, TTPa, fibrinógeno y plaquetas) para detectar precozmente una coagulopatía. Estas parecen alterarse precozmente y ser un buen indicador pronóstico de estos pacientes.
A su vez, están recomendados los test viscoelásticos como ROTEM o TEG que pueden ayudar en la detección, control u orientación de forma precoz de la coagulopatía asociada a hemorragia aguda.
Administración de CH
Se recomienda evitar transfundir CH con cifras superiores a 10 g/dl. Tanto en cirugía cardiaca como en presencia de cardiopatía isquémica es aconsejable conseguir cifras superiores a 9 g/dl sin embargo una vez conseguida la estabilidad clínica y hemodinámica se debe considerar una terapia transfusional mas restringida (8 g/dl).
Como guía para la transfusión se recomienda considerar tanto parámetros clínicos como de laboratorio y siempre individualizando.
Administración de plasma fresco congelado (PFC).
En el contexto de una hemorragia masiva se recomienda una administración precoz para prevenir y/o tratar la coagulopatía. La transfusión de PFC o plaquetas (menos frecuente) puede causar TRALI (lesión pulmonar aguda secundaria a transfusión masiva) que es infrecuente y puede pasar desapercibido pero tiene una alta mortalidad.
Dosificación 15-20 ml/kg.
Administración de Pools de plaquetas.
Se recomienda la administración para mantener un recuento mayor a 50000 u/l o mayor a 75000 u/l en pacientes con sangrado activo cuando la hemorragia no cesa con cifras menores a 50000 u/l . En los casos de traumatismo craneoencefálico se recomiendan cifras mayores a 100000 u/l. La administración de plaquetas debe ser posterior a los CH y el plasma para mayor eficacia.
Albúmina
No se recomienda su empleo sistemático de albumina. La solución al 5% es la única indicada para la reposición de volumen.
Complejo protrombínico
Se recomienda el empleo de concentrados de complejo protrombinico (CPP) en pacientes en tratamiento con anti vitamina K para la reversión rápida de su efecto. La dosis es 50 UI/kg (25 UI/Kg si alto riesgo trombótico) asociado a 10 mg de vitamina k 10 mg. No emplear si el INR es inferior a 1,5.
No está recomendado como primera opción para pacientes con hemorragia si no están en tratamiento con anti vitamina K para tratar la coagulopatía pudiéndose emplear en pacientes seleccionados en función de la urgencia del tratamiento y disponibilidad de PFC, en presencia de sobrecarga de volumen o riesgo de TRALI.
Un nivel inferior a 2 g/l de fibrinógeno en esta situación no garantiza una buena hemostasia.
PFC vs CPP
El CCP requiere una dosificación de 25U/kg que es un volumen menor a 200 ml y normaliza el INR en menos de 30 minutos 1 Unidad de CCP tiene 30 veces más factores que 1 Unidad PFC y es de disponibilidad inmediata.
Por otro lado el plasma requiere una dosificación de 15-20 ml/kg para normalizar el INR por lo que se puede producir una sobrecarga de volumen. Además el 25% de los factores se pierden durante su inactivación y se necesitan 30-45 minutos para su descongelación.
Fibrinógeno
Es el principal sustrato de la coagulación y el factor más abundante en el plasma sin embargo su concentración disminuye más precozmente tras una hemorragia grave, teniendo un importante valor predictivo la precocidad y la severidad de dicho descenso.
Los valores pueden ser erróneos en las muestras de pacientes hemodiluidos, y especialmente en aquellos en los que se han administrado coloides.
Se deben mantener unos valores superiores a 2g/l administrándolo cuando no se alcance dicho valor.
DOSIS (g)= incremento de Fb deseado (g/l) x volumen plasmático (l). Vp = 0,04 l/kg.
Cada gramo aumentaría aproximadamente 0,25-0,25 g/l. Dosis inicial recomendada de 25-50 mg/kg.
Factor VIIa
No se recomienda como medida rutinaria de primer nivel en el tratamiento de la hemorragia masiva.
Indicado para profilaxis y tratamiento de hemorragia en pacientes con hemofilia congénita A o B, déficit congénito de factor VII y hemofilia adquirida a una dosis de 90 mcg/kg cada 2 horas hasta el cese del episodio hemorrágico.
Fuera de indicación ha demostrado antagonizar el efecto de numerosos anticoagulantes incluyendo los nuevos anticoagulantes orales y anti vitamina K.
Incrementa el riesgo trombótico por lo que sólo se puede considerar apropiado su uso en pacientes con complicaciones hemorrágicas que estén recibiendo tratamiento con anticoagulantes que carezcan de antídoto específico o en aquellos en los que la hemorragia sea incoercible a pesar de haber aplicado todas las medidas necesarias.
Ácido tranexámico
Se recomienda la administración precoz en las 3 primeras horas en pacientes con hemorragia masiva secundaria a trauma. La dosis inicial recomendada en el paciente adulto es de 1g en 10 minutos más una perfusión de un gramo cada 8h. Recientemente, se ha comprobado la eficacia también en la hemorragia postparto.
Desmopresina
Valorar su administración en pacientes sangrantes con enfermedad de Von Willebrand, urémicos o tomadores de aspirina. Dosis 0,3 mcg/kg.
Calcio
La hipocalcemia en las primeras 24h podría estar relacionada con un aumento de la mortalidad y mayor necesidad de politranfusión siendo mejor predictor que el nivel bajo de fibrinógeno, la acidosis o la trombopenia por lo que se recomienda monitorizar los niveles de calcio en el paciente sangrante y mantener los niveles plasmáticos en el rango de la normalidad administrando calcio si niveles plasmáticos menores a 0,9 mmol/l.
Discusión
Tras las revisiones realizadas, hemos intentado resumir las recomendaciones más aceptadas y basadas en la evidencia respecto a la hemorragia masiva, tomando como referencia el documento Hemomas, que fue pionero en su manejo multidisciplinar, donde los anestesiólogos tenemos un papel fundamental. En el manejo y protocolización deben participar otros servicios hospitalarios como Hematología y Hemoterapia, Análisis Clínicos, Cuidados intensivos, Calidad y Gestión.
Para conseguir este objetivo hemos encontrado múltiples limitaciones. En primer lugar, la evidencia existente sobre el tema es muy baja, dado que se trata de una entidad de elevada morbimortalidad, donde la actuación rápida es primordial, como es el caso de la hemorragia masiva. La mayoría de nuestras actuaciones se basan en recomendaciones y consenso entre expertos.
Otra limitación es la variedad de definiciones existentes en la literatura tanto de hemorragia masiva, como de transfusión masiva, así como la gran variabilidad existente tanto en los parámetros evaluados como en los protocolos empleados. Asimismo, la mayoría de los trabajos se refieren a la hemorragia masiva en el paciente traumático u obstétrico, que no siempre es comparable al entorno quirúrgico. Muchos estudios se han realizado en base a estudios de reclamaciones en pacientes fallecidos por esta causa, y muchas veces no se recogen todos los datos referentes a tiempos de respuesta y tratamientos realizados.
Como recomendaciones generales, las principales medidas a tener en cuenta son las preventivas de la hemorragia masiva lo más precozmente posible. Así, se debe evitar la hipotermia, la acidosis, la hipoxia, la hipocalcemia y la hiperglucemia. Todos los protocolos deben reponer la volemia, reanimación y tratamiento etiológico agresivo de la causa de la hemorragia, con medidas quirúrgicas de contención si es posible. Debemos estar atentos y activar esta serie de recomendaciones de forma suficientemente temprana para una mayor eficacia tratando de evitar de forma agresiva la coagulopatía.
Una vez instaurada la hemorragia, es de vital importancia la monitorización de la volemia, la reposición de componentes sanguíneos a la proporción más adecuada, así como de fármacos hemostáticos.
La actualización continua, la estandarización de protocolos y el entrenamiento de personas o equipos en esta materia reduciría de forma significativa los tiempos de inicio del tratamiento así como la toma de decisiones. Sin embargo, todas las acciones deben individualizarse en función del tipo de paciente, y de los medios accesibles en nuestro entorno, con el fin último de ser lo más eficientes posible para con nuestros pacientes.
Ilustración 3: Condiciones mínimas de control de hemorragia masiva.
Conclusión
Aunque el documento Hemomas fue publicado en 2015, aún continúa vigente en cuanto a definiciones y manejo de la hemorragia masiva, si bien nunca hay que olvidar adaptar los protocolos a los medios disponibles en nuestro entorno, con el objetivo de una reposición lo más precoz posible. El manejo de la hemorragia masiva sigue siendo un reto para los profesionales participantes y un claro ejemplo de una gestión de calidad.
Bibliografía
- Llau JV, Acosta FJ, Escolar G, Fernández-Mondéjar E, Guasch E, Marco P et al. Multidisciplinary consensus document on the management of massive haemorrhage (HEMOMAS document). Med Intensiva 2015; 39: 483-504.
- Shakur H, Roberts I, Fawole B, Chaudhri R, El-Sheikh M, Akitan A, Qureshi Z, Kidanto H. Effect of early tranexamic acid administration on mortality, hysterectomy, and other morbidities in women with post-partum haemorrhage (WOMAN): an international, randomised, double-blind, placebo-controlled. The Lancet 2017; 389: 2105-116. (HTML) (PDF)
- Dennis AT, Griffiths JD. Tranexamic acid for post-partum haemorrhage in the WOMAN trial. The Lancet 2017; 390: 1582. (PubMed) (HTML) (PDF)
- Practice Guidelines for Perioperative Blood Management: An Updated Report by the American Society of Anesthesiologists Task Force on Perioperative Blood Management. Anesthesiology 2015; 122: 241-275. (HTML)
- Boer C, Meesters MI, Milojevic M, Benedetto U, Bolliger D, von Heymann C et al. 2017 EACTS/EACTA Guidelines on patient blood management for adult cardiac surgery. J Cardiothorac Vasc Anesth 2018; 32: 88-120. (PubMed)
Cómo citar: Sánchez Miguel, A., Pérez Herrero, M. A. (2020). Recomendaciones actuales en el manejo de la hemorragia masiva.: ¿Qué ha cambiado desde el documento HEMOMAS?. Revista Electrónica AnestesiaR, 10(12), 3. https://doi.org/10.30445/rear.v10i12.671




Se recomienda la terapia precoz con fluidos en el paciente con hemorragia grave e hipotensión, empleando preferentemente cristaloides isotónicos en lugar de coloides 1A.
Eso recomienda el Documento HEMOMAS.
Ustedes recomiendan Ringer Lactato, porque?