Peral Sánchez D (1), Porcar Rodado E (2)
(1) Médico adjunto de Anestesia. Hospital Provincial de Castellón. Profesor Asociado Anestesiología y Terapia del Dolor Universitat Jaume I, Castellón.
(2) Médico adjunto de Medicina Intensiva. Hospital de La Plana, Vilareal, Castellón.
Cómo citar este artículo: Peral Sanchez, D., & Porcar Rodado, E. (2022). Consideraciones anestésicas en los pacientes con presencia de puentes intramiocárdicos. The milking Syndrome. Revista Electrónica AnestesiaR, 14(6). https://doi.org/10.30445/rear.v14i6.997
Introducción
Las arterias coronarias tienen trayectos generalmente epicárdicos. En ocasiones segmentos de esas arterias se introducen en el músculo cardíaco para luego volver a exteriorizarse hacia el epicardio, recibiendo el nombre de puentes intramiocárdicos (PIM). Estos segmentos pueden producir un estrechamiento excesivo del flujo sanguíneo durante la sístole cardíaca, lo que angiográficamente se define como fenómeno de milking. Se suele considerar como una entidad benigna, sin embargo, se han descrito diferentes complicaciones cardíacas ante situaciones de estrés que deben ser conocidas por los anestesiólogos para optimizar así el manejo perioperatorio de estos pacientes.
Caso clínico
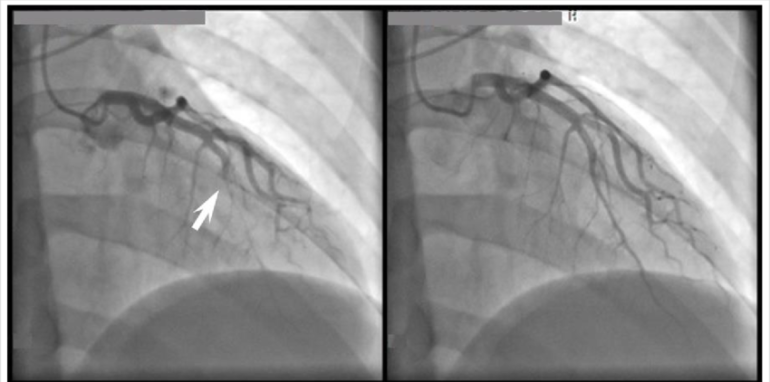
Varón de 49 años, 104 kg, 185 cm, exfumador, con antecedentes de HTA, dislipemia, hipertrigliceridemia, diabetes tipo I y cardiopatía isquémica, con presencia de PIM en la porción media de la arteria descendente anterior (DA) detectados 3 años antes en una coronariografía realizada por un episodio clínico de angor inestable, motivo por el cual se le implantó un stent en DA. Estaba en tratamiento domiciliario con omeprazol, estatinas, enalapril, insulina, AAS y bisoprolol.
Se programó para colonoscopia diagnótico-terapéutica para confirmar test positivo de sangre en heces. En el estudio preanestésico la analítica básica y el ECG de 12 derivaciones no mostraron alteraciones. Tras su valoración, se decidió mantenimiento de la medicación domiciliaria hasta el momento de la prueba, con especial énfasis en la toma el mismo día de la medicación betabloqueante. A su llegada, se canalizó vía periférica 20G en dorso de la mano, se monitorizó – pulsioximetría, ECG (electrocardiograma) y TANI (Tensión arterial no invasiva- y se administró oxígeno suplementario con gafas nasales (FiO2 0,28). Se dispuso al paciente en decúbito lateral izquierdo para realizar la exploración. La sedación se realizó con 2 mg intravenosa de midazolam, 75 mcg de fentanilo, y bolos de propofol (administrando un total de 120 mg). El procedimiento transcurrió sin incidencias, manteniendo el paciente adecuada oxigenación y estabilidad hemodinámica, con valores de FC en torno a 60 lpm. El paciente fue dado de alta tras 30 minutos de observación en la sala de recuperación.
Discusión
Los PIM son un hallazgo común en los estudios coronarios realizados en las unidades de hemodinámica. Su incidencia es variable, hay estudios angiográficos que indican unos valores del 0,5-16% en población con repercusión funcional, aunque se postula que, si se estudiara su presencia en cadáveres, ésta podría afectar a una proporción de personas mucho más elevada, entre el 15-85% de la población1. Una posible explicación a esta disparidad de datos es el hecho de que se descubren casos por angiografía en los pacientes que muestran clínica anginosa o aquellos en que se realiza la prueba por otro motivo y se detectan como hallazgo casual. En cuanto a la variabilidad encontrada en los estudios de necropsia, el origen parece residir más en la precisión a la hora de realizar la disección anatómica.
La causa de la mayor o menor presencia de estos PIM es incierta, postulándose como una variante congénita, aunque se han descrito casos adquiridos, al asociarse a un incremento de la masa de miocardio a lo largo del tiempo, como en la miocardiopatía hipertrófica2. Lo que sí parece claro es que la zona más afectada suele ser el tercio proximal y medio de la DA (más del 70% de los casos), aunque también hay descritos casos que afectan a coronaria derecha o ramas marginales3.
La fisiopatología de los PIM obedece a los cambios que se producen en el segmento tunelizado y sus zonas adyacentes durante el ciclo cardíaco. Así, en los estudios realizados se ha podido constatar una mayor tendencia al desarrollo de ateriosclerosis en el segmento proximal del puente, bien por la alteración del flujo sanguíneo tanto en sístole como en diástole en esa zona, así como la angulación del vaso al introducirse en el espesor miocárdico. Sin embargo, la ateriosclerosis en el segmento intramiocárdico es poco frecuente, quizá por el carácter pulsátil de esa zona, aunque sí se ha podido observar un remodelado constrictivo1. Se podría pensar que la obstrucción dinámica al flujo se produciría durante la sístole. No obstante, se ha comprobado que este tipo de obstrucción puede persistir en la fase meso-telediastólica.
El impacto que pueden causar estos PIM dependerán de una serie de factores, como la longitud y profundidad del segmento (siendo los más profundos los que podrían justificar los eventos isquémicos), su orientación respecto a las fibras miocárdicas, y la presencia o no de tejido conectivo o adiposo alrededor del mismo.
En cuanto a la presentación clínica, la gran mayoría de pacientes son asintomáticos. Sin embargo, el hecho de presentar PIM puede suponer una menor reserva de flujo coronario, y por tanto un umbral inferior al habitual para desarrollar eventos isquémicos. Por supuesto estas situaciones serían más frecuentes en aquellas circunstancias en las que exista un aumento de la demanda de oxígeno, como taquicardia por ejercicio físico, infecciones, o estrés durante un procedimiento anestésico-quirúrgico4. Además de la clínica isquémica, esta dolencia puede manifestarse como arritmias ventriculares, disfunción ventricular transitoria, síncope o muerte súbita.
Para confirmar el diagnóstico, existen una serie de técnicas, siendo la coronariografía la más inmediata, ya que permite objetivar el estrechamiento durante el ciclo cardíaco (efecto de ordeñamiento o milking). Otras técnicas como la ecocardiografía de estrés, el SPECT y la ecografía intravascular (IVUS) permiten también la detección de los PIM. Sin embargo, es el TAC multidetector (TCMD) el que se está imponiendo como la mejor prueba para su detección1,4.
En cuanto a su tratamiento, los cardiólogos suelen basarse en criterios anatómicos, funcionales y en la presencia o no de signos de isquemia. Así, una gran parte de pacientes asintomáticos no precisarán de tratamiento. Otro porcentaje de pacientes necesitará tratamiento farmacológico para el control de la frecuencia cardíaca, siendo los betabloqueantes el tratamiento de elección. También se han empleado con éxito los calcioantagonistas. Los vasodilatadores puros, como los nitratos, son debatidos, ya que por una parte podrían reducir la precarga y disminuir el vasoespasmo, pero por otra podrían reducir el umbral isquémico5.
En ocasiones el tratamiento médico no es suficiente, y pueden llegar a ser necesarias otras intervenciones, como la angioplastia con balón, la implantación de stents, la miectomía para liberar el vaso de la presión periférica, e incluso la revascularización mediante by-pass, sin haber demostrado claras ventajas de unas técnicas sobre otras6.
No existen demasiados casos en la literatura sobre esta dolencia relacionada con la actividad anestésica, pero en general, parece que el mantenimiento de los betabloqueantes y de los calcioantagonistas hasta el momento de la cirugía parecen aportar mayor seguridad5. En cualquier caso, el manejo anestésico debe garantizar el mantenimiento adecuado del flujo sanguíneo a los órganos y la presión de perfusión.
En cuanto a la elección del tipo de anestesia, no hay estudios concluyentes. Se ha considerado el uso de sevoflurano por sus probables efectos de cardioprotección. Sin embargo, Iwama et al publicaron un caso de muerte por infarto de miocardio de un niño anestesiado con este gas, y postularon como causa la isquemia producida por la hipotensión debida a su efecto vasodilatador7. Realmente la elección del agente anestésico suele considerarse de importancia relativa para la evolución posterior del paciente siempre que se mantenga un soporte vital adecuado. La incidencia de eventos cardíacos posperatorios en cirugía no cardíaca es demasiado baja en las diferentes series publicadas para establecer una relación entre la elección del agente anestésico y las complicaciones cardíacas posteriores8.
Como conclusión, la presencia de PIM supone una anomalía coronaría muy común que no solemos tener en cuenta en nuestras valoraciones. Pese a que existen pocas series descritas sobre el pronóstico a largo plazo de esta dolencia, se suele considerar como una entidad de buen pronóstico. Su significado clínico es controvertido, y no existe un protocolo claro que establezca el mejor método diagnóstico y terapéutico. Parece prudente, sin embargo, seguir las recomendaciones habituales de control de la frecuencia cardíaca, sobre todo mediante el mantenimiento de la medicación habitual hasta el momento del procedimiento que se vaya a realizar.
Bibliografía
1.Corban MT, Hung OY, Eshtehardi P, Rasoul-Arzrumly E, McDaniel M, Girum Mekonnen G, et al. Myocardial Bridging: Contemporary wnderstanding of pathophysiology with implications for diagnostic and therapeutic strategies. J Am Coll Cardiol. 2014;63(22):2346-2355. (PubMed)
2. Vongpatanasin W, Willard J, Hillis D, Lange R, Landau C. Acquired myocardial bridging. Am Heart J 1997; 133:463-5. (HTML)
3. Ciçek D, Kalay N, Müderriso_glu H. Incidence, clinical characteristics, and 4-year follow-up of patients with isolated myocardial bridge: a retrospective, single-center, epidemiologic, coronary arteriographic follow-up study in southern Turkey. Cardiovasc Revasc Med 2011; 12:25–8. (HTML)
4. Lee MS, Chen CH. Myocardial bridging: an upto- date review. J Invasive Cardiol 2015; 27:521–8. (PubMed)
5.Yu HS, Jeong MH, Kim W, Shon IS, Kim KH, Hong YJ, et al. The long-term clinical follow-up of the patients with myocardial bridge. Chonnam Med J 2005; 41: 161-5. (HTML)
6. Ji Q, Shen J, Xia L, Ding W, Wang C. Surgical treatment of symptomatic left anterior descending myocardial bridges: myotomy vs. bypass surgery. Surg Today. 2020;50(7):685-692. doi:10.1007/s00595-019-01935-1. (PubMed)
7. Iwama H, Kaneko T, Watanabe K, Takasu M, Terada K, Sugiyama Y. Fatal acute myocardial infarction during general anesthesia in a 7-yr-old boy associated with total intramural coronary arteries. Anesthesiology 1997; 87: 426-9. (HTML)
8. Kristensen S, Knuuti J, Saraste A, Stefan S, Bøtker HE, De Hert S, et al. Grupo de trabajo conjunto sobre cirugía no cardíaca: evaluación y manejo cardiovascular de la Sociedad Europea de Cardiología (ESC) y la European Society of Anesthesiology (ESA). Rev Esp Cardiol. 2014; 67:1052. e1-1052.e43. (HTML)