Simón Polo E, Charco Roca LM, Membrilla Moreno C, Sánchez López ML
Facultativo Especialista de Área de Anestesiología y Cuidados Intensivos.
Complejo Hospitalario Universitario de Albacete.
Introducción
La sepsis forma parte de un síndrome fisiopatológico cuya evolución puede conducir al desarrollo de shock séptico, y constituye la principal causa de muerte en las unidades de cuidados intensivos (UCI) en todo el mundo(1). La transición a shock séptico puede desarrollarse rápidamente, pero los mecanismos que impulsan el desarrollo de disfunción multiorgánica siguen sin estar del todo dilucidados(2).
Entre los fracasos orgánicos desarrollados con frecuencia en el contexto de la sepsis se encuentra involucrado el sistema renal. La insuficiencia renal aguda (IRA) se ha definido como un síndrome caracterizado por un rápido deterioro de la función renal, mantenido durante horas o días, con el consiguiente acúmulo de productos nitrogenados, y que puede acompañarse de oligoanuria y fallo en la regulación del equilibrio hidro-electrolítico y ácido-base.
La IRA se manifiesta hasta en el 50% de los pacientes con sepsis, lo que complica significativamente su manejo y se asocia con resultados desfavorables. Varios estudios epidemiológicos han evidenciado que el paciente séptico está predispuesto a un mayor riesgo de desarrollar enfermedad renal crónica y terminal tras el episodio infeccioso (3).
La IRA en el contexto de la sepsis se define por la presencia simultánea de los criterios de consenso diagnósticos de sepsis y/o shock séptico (2) así como por los criterios de consenso definidos por las guías KDIGO (4).
La presente revisión tiene como objetivo actualizar los mecanismos fisiopatológicos implicados en el fracaso renal dentro del proceso séptico, las estrategias de prevención, y las diferentes líneas de tratamiento disponibles actualmente.
Método
Para la elaboración de este manuscrito se llevó a cabo una búsqueda en la literatura a a través de la base de datos PubMed utilizando la terminología MeSH mediante la siguiente estrategia de búsqueda: [(acute kidney injury) AND (sepsis)], [(patophisiology) AND (sepsis)], (acute kidney injury) AND (prevention)]. Se revisaron artículos con fecha de publicación entre 2015 y 2020 categorizados como revisión narrativa y guías de práctica clínica. Se excluyeron los artículos con idioma distinto al inglés o español.
Desarrollo
- Evolución y definición de daño renal agudo en la actualidad. Aplicación en la sepsis:
Hasta hace pocos años, y a pesar de los avances en el conocimiento de la fisiopatología renal, la definición de IRA en la literatura científica todavía se encontraba llena de controversias, destacando la ausencia de una definición universalmente aceptada.
Los conceptos que surgieron de la Segunda Conferencia de Consenso Internacional de la Iniciativa para la Calidad de la Diálisis Aguda publicada en el 2002, permitieron la estandarización del conocimiento científico existente y la unificación de criterios.
Se desarrolló la escala RIFLE (Risk Injury Failure Loss End stage), como un instrumento de clasificación que permitió unificar los criterios clásicos de IRA y facilitaba la estratificación de los enfermos. Posteriormente, de ésta se derivó la escala AKIN, que tiene mayor especificidad y sensibilidad para la evaluación del riesgo renal y el pronóstico (5).
Sin embargo, esta clasificación parecía no tener la capacidad de identificar el tipo de fracaso renal agudo. En el año 2012 fueron publicadas las guías KDIGO para el tratamiento de la IRA, manteniendo los criterios de estratificación establecidos en la clasificación AKIN. Desde entonces es habitualmente utilizada en las unidades de cuidados críticos para el diagnóstico y estratificación de IRA (4) (Tabla 1).

Abreviaturas: Cr; Creatinina, FG; Filtrado Glomerular.
Resulta relevante destacar las limitaciones de los marcadores séricos y urinarios empleados en estas clasificaciones en la detección de daño renal agudo en el paciente crítico, pudiendo no reflejar los valores reales de filtrado glomerular (FG) y comprometiendo las posibles opciones terapéuticas y su pronóstico. Parece razonable que en el caso de requerir una monitorización estrecha de la función renal, como es el caso del paciente séptico, resulte de utilidad la medición del FG. Sin embargo, esto precisa de una situación de estabilidad y equilibrio en la perfusión renal, y puede no ser útil en situaciones con grandes cambios en la hemodinámica renal, como el paciente en shock séptico, debiendo ser este resultado interpretado con cautela (6).
En el año 2016 fueron publicadas las guías de práctica clínica “Surviving Sepsis Campaign” estableciéndose la severidad de la afectación renal en función de los criterios que forman parte de la escala SOFA (2) y que se basan en los valores de creatinina serios y en el débito urinario.
- Fisiopatología de la insuficiencia renal en la sepsis. Mecanismos implicados.
Los avances en la comprensión de la patogenia de la IRA en humanos son limitados debido a las diversas restricciones técnicas, tecnológicas y éticas. La mayor parte del conocimiento actual de la patogénesis se ha extrapolado de modelos animales de sepsis, estudios celulares in vitro y observaciones post mortem (7,8).
El paradigma fisiopatológico predominante es la disminución del flujo sanguíneo renal global con la posterior reducción del aporte de oxígeno celular y disfunción mitocondrial. Sin embargo, está cada vez más claro que la lesión por isquemia-reperfusión es sólo uno de los múltiples mecanismos que entran en juego en la IRA del paciente críticamente enfermo.
- Isquemia- reperfusión:
La evidencia actual sugiere que la IRA puede ocurrir no solo en pacientes con flujo sanguíneo deficitario, sino también en pacientes con flujo sanguíneo normal o aumentado. La causa de lesión isquémica durante el proceso séptico no parece residir en el flujo sanguíneo en sí, sino en la distribución anormal del flujo dentro del riñón que favorecería la perfusión de la corteza renal frente a la médula. Se deduce de esto que restaurar y mantener la perfusión renal podría ser insuficiente y explicaría por qué tratamientos con acción vasodilatadora no han demostrado ser beneficiosos para el tratamiento o prevención de la IRA en pacientes sépticos (9).
- Alteraciones microcirculatorias e inflamatorias
La IRA asociada a sepsis puede ocurrir en ausencia de signos evidentes de hipoperfusión y/o signos clínicos de inestabilidad hemodinámica. Se han propuesto varias teorías que involucran cambios microcirculatorios (5).
La tasa de filtración glomerular se relaciona con el flujo sanguíneo glomerular y la presión intraglomerular. La constricción de la arteria eferente produce una disminución de la presión intraglomerular con la consiguiente disminución de la tasa de filtración glomerular y de la producción de orina, favoreciendo progresivamente la alteración en el funcionamiento glomerular.
Por otra parte, los patrones moleculares asociados a patógenos (PAMP) y los patrones moleculares asociados a daño (DAMP) liberados tras la presencia de un patógeno infeccioso, tienen la capacidad de unirse a una familia de receptores conocidos como receptores de reconocimiento de patrones, especialmente tipo Toll (Toll-Like), que se expresan en la superficie de células inmunitarias, células endoteliales y células epiteliales tubulares, favoreciendo una respuesta inflamatoria desproporcionada frente a un patógeno (7,8).
- Estrés oxidativo
La respuesta inflamatoria conlleva la activación de una cascada de señales bioquímicas y una mayor síntesis de citocinas proinflamatorias, especies reactivas de oxígeno, estrés oxidativo y activación endotelial, que promueve la adhesión de leucocitos y plaquetas aumentando el riesgo de formación de trombos y alteraciones de la continuidad del flujo sanguíneo (flujo intermitente o nulo).
- Reprogramación metabólica
En la IRA asociada a la sepsis se produce una priorización de la energía buscando satisfacer las necesidades vitales metabólicas. Múltiples funciones celulares con alto consumo de trifosfato de adenosina (ATP) se regulan a la baja para ahorrar energía, incluida la síntesis de proteínas, el transporte de iones y la replicación celular. Además, se ha sugerido que las células endoteliales tubulares pueden reprogramar su metabolismo modificando la glucolisis aeróbica y la fosforilación oxidativa para cumplir con los requisitos energéticos durante la sepsis (9.10).
3. Papel de los biomarcadores
Los biomarcadores convencionales como la proteinuria, los cilindros celulares (indicadores tardíos de lesión tubular), y la excreción fraccionada de sodio (utilizado para diferenciar las formas de IRA prerrenales de las renales) han mostrado falta de sensibilidad y especificidad para el reconocimiento precoz de la IRA. De aquí la necesidad e interés que despierta la posibilidad de emplear otros biomarcadores con capacidad para realizar una detección precoz así como una valoración pronóstica.
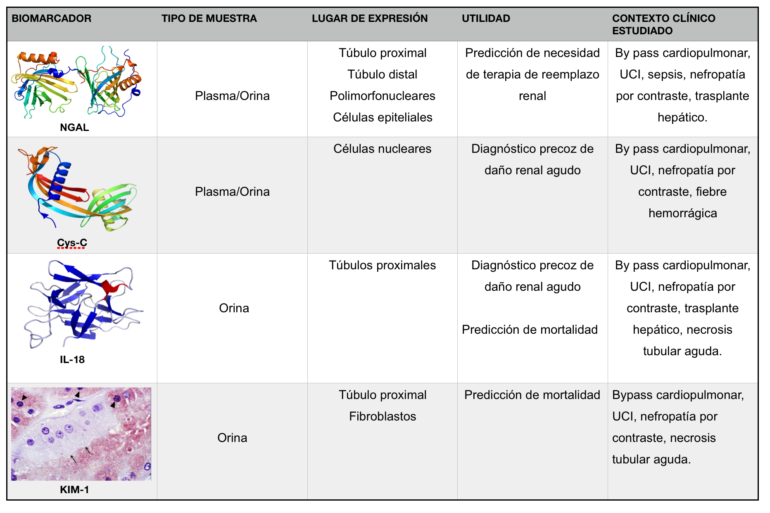
Son muchos los estudios que evalúan el rendimiento de diferentes biomarcadores séricos o urinarios en los diferentes estadios evolutivos de la IRA. De éstos, los más prometedores son dos biomarcadores séricos-urinarios, NGAL (Neutrophil Gelatinase-Associated Lipocalin) y Cistatina-C, y dos exclusivamente urinarios, KIM-1 (Kidney Injury Molecule-1) e IL-18 (Interleuquina-18) (Figura 1).
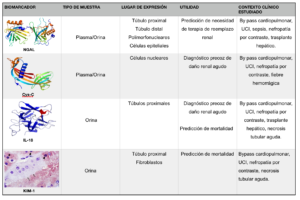
Abreviaturas: NGAL; Neutrophil Gelatinase-Associated Lipocalin, Cys-C; Cistatina-C, KIM-1; Kidney Injury Molecule-1, IL-18; Interleuquina-18.
NGAL ha sido investigada extensamente en varios genotipos. Este biomarcador es liberado por neutrófilos activados y diversas células epiteliales renales. En diversos estudios, presenta una alta sensibilidad en la predicción de IRA y también como herramienta de pronóstico para predecir la necesidad de terapias de reemplazo renal (TRR) y la mortalidad hospitalaria. Los pacientes con IRA en relación con la sepsis generalmente tienen niveles más altos de NGAL en plasma y orina que pacientes con IRA de otras etiologías (11).
La Cistatina C se considera un buen marcador de función renal principalmente por 4 causas: su producción a nivel celular es constante y su concentración plasmática se mantiene estable, no se une a proteínas plasmáticas, se filtra libremente por el glomérulo, y a diferencia de la creatinina su concentración plasmática es independiente de la masa muscular, la dieta y la edad, salvo en pacientes de edad avanzada en los que su concentración es más elevada, como corresponde al descenso de la filtración glomerular que sobreviene con la edad. Numerosos estudios han evaluado la Cistatina-C como marcador diagnóstico de la alteración renal ya establecida demostrando un comportamiento mejorado o similar al de la creatinina (12). Sin embargo, hasta la fecha los estudios enfocados a evaluar su papel en el diagnóstico precoz de la IRA son escasos.
La IL-18 es una citoquina proinflamatoria procedente de las células epiteliales tubulares proximales, es un potente mediador inducido en el proceso isquémico renal agudo lo que la convierte en un biomarcador candidato para la detección precoz de la IRA (13). Al ser una citoquina proinflamatoria con un importante rol en la sepsis y en procesos inflamatorios y autoinmunes, su aplicación se puede ver limitada en estos casos al quedar comprometida su sensibilidad y especificidad. En el trasplante renal, de forma similar al NGAL, es factor pronóstico de la recuperación funcional del órgano trasplantado.
Se ha observado que la presencia de KIM -1 en orina puede ser un buen predictor de IRA con una alta sensibilidad (74%) y especificidad (86%) en las primeras 24-48 h (14). A pesar de que se ha considerado un un biomarcador prometedor en la detección precoz de daño renal, todavía son pocos los estudios que se han llevado a cabo en pacientes.
Conclusiones
El estudio de los mecanismos que participan en el desarrollo de IRA en la sepsis está limitado por la escasez de estudios histológicos en humanos, dado lo arriesgado del procedimiento y la frecuente reversibilidad de éste, y por la imposibilidad de medir los flujos microcirculatorios renales.
La fisiopatología propuesta para la disfunción renal incluye una combinación de factores como hipotensión sistémica, vasoconstricción renal, infiltración de células inflamatorias en el riñón, trombosis intraglomerular y obstrucción intratubular.
A pesar de estos mecanismos propuestos, la secuencia exacta de eventos que dan como resultado final la IRA son pobremente entendidos, en parte debido a que la mayor parte de los conocimientos generados se han derivado de experimentos en animales.
El reconocimiento temprano de la lesión renal aguda en el contexto de la sepsis es imprescindible para proporcionar un tratamiento óptimo y evitar la progresión de la lesión renal. La determinación de biomarcadores sensibles de lesión renal actualmente se encuentra en desarrollo y solo disponible en el entorno de la investigación.
Bibliografía
- Singer M, Deutschman CS, Seymour C, Shankar-Hari M, Annane D, Bauer M et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016;315(8):801-810. doi:10.1001/jama.2016.0287. (PubMed)
- Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R et al. Surviving Sepsis Campaign: International guidelines for management of sepsis and septic shock: 2016. Intensive Care Med. 2017;43(3):304-377. doi:10.1007/s00134-017-4683-6. (PubMed)
- Greenberg JH, Coca S, Parikh CR. Long-term risk of chronic kidney disease and mortality in children after acute kidney injury: a systematic review. BMC Nephrol. 2014;15:184. doi:10.1186/1471-2369-15-184. (PubMed)
- Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group. KDIGO clinical practice guideline for acute kidney injury. Kidney Int 2012;2(Suppl.):1-138. (HTML)
- Bellomo R, Ronco C, Kellum JA, Metha RL, Palevsky P. Acute renal failure-definition, outcome, measures, animal models, fluid therapy and information technology needs: The Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Critical Care 2004;8(4):R204-12. doi:10.1186/cc2872. (PubMed)
- Stevens LA, Coresh J, Greene T, Levey AS. Assessing kidney function—measured and estimated glomerular filtration rate. N Engl J Med. 2006;354(23):2473-83. doi:10.1056/NEJMra054415. (NEJM)
- Ma S, Evans RG, Iguchi N, Tare M, Parkington HC, Bellomo R et al. Sepsis-induced acute kidney injury: A disease of the microcirculation. Microcirculation. 2019;26(2):e12483. doi: 10.1111/micc.12483. (PubMed)
- Peerapornratana S, Manrique-Caballero CL, Gómez H, Kellum JA. Acute kidney injury from sepsis: current concepts, epidemiology, pathophysiology, prevention and treatment. Kidney Int. 2019;96(5):1083-1099. doi: 10.1016/j.kint.2019.05.026. (PubMed)
- Skube SJ, Katz SA, Chipman JG, Tignanelli CJ. Acute Kidney Injury and Sepsis. Surg Infect (Larchmt). 2018;19(2):216-224. doi: 10.1089/sur.2017.261. (PubMed)
- Poston JT, Koyner JL. Sepsis associated acute kidney injury. BMJ. 2019;364:k4891. doi: 10.1136/bmj.k4891. (BMJ)
- Haase M, Bellomo R, Devarajan P, Schlattmann P, Haase-Fielitz A;NGAL Meta-analysis Investigator Group. Accuracy of neutrophil gelatinase-associated lipocalin (NGAL) in diagnosis and prognosis in acute kidney injury: a systematic review and meta-analysis. Am J Kidney Dis. 2009;54(6):1012-24. doi:10.1053/j.ajkd.2009.07.020. (PDF)
- Zang Z, Lu B, Sheng X, Jin N. Cystatin C in prediction of acute kidney injury: a systemic review and meta-analysis. Am J Kidney Dis.2011;58(3):356-65.doi:10.1053/j.ajkd.2011.02.389. (PubMed)
- Siew ED, Ware LB, Ikizler TA. Biological markers of acute kidney injury. J Am Soc Nephrol 2011;22(5):810-20.doi:10.1681/ASN.2010080796. (PDF)
- Yang L, Brooks CR, Xiao S, Sabbisetti V, Yeung MY, Hsiao LL et al. KIM-1-mediated phagocytosis reduces acute injury to the kidney. J Clin Invest. 2015;125(4):1620-36.doi:10.1172/JCI75417. (PubMed)



1 Comment