Hernández Pinto P (1), Álvarez de Eulate I (1), Escudero Gómez G (2), Fernández Crespo AB (1)
(1) Adjunto Anestesia y Reanimación. Hospital Universitario Marqués de Valdecilla. Santander. España.
(2) Residente de Anestesia y Reanimación. Hospital Universitario Marqués de Valdecilla. Santander. España.
Cómo citar este artículo: Hernández Pinto, P., Álvarez de Eulate, I., Escudero Gómez, G., & Fernández Crespo, A. B. (2022). Manejo anestésico de gestante con síndrome de Brugada en área de partos. A propósito de un caso. Revista Electrónica AnestesiaR, 14(4). https://doi.org/10.30445/rear.v14i4.1026
Introducción
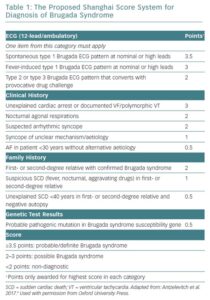
El síndrome de Brugada (SB) es un trastorno del ritmo cardiaco con herencia autosómica dominante, de predominio masculino, y que origina el 4% de todos los casos de muerte súbita cardiaca. Tiene una prevalencia de 5-20 casos por 10000 habitantes. El diagnóstico del síndrome se establece en base a los criterios del Shanghái score basado fundamentalmente en hallazgos clínicos, electrocardiográficos, historia familiar de muerte súbita o SB y resultados genéticos (tabla 1). El estudio genético detallado solo identifica el origen de la enfermedad en el 35% de los casos con mutaciones en los genes que codifican para los canales de sodio, potasio o calcio, siendo la mutación del gen SCN5A de los canales de sodio el más frecuente en el 25% de los casos con origen genético (1). Para estratificar el riesgo de los pacientes asintomáticos, es necesario realizar test de provocación con bloqueantes de los canales de sodio (antiarrítmicas clase I como ajmalina, flecainida o procainamida). Si el test es positivo, induciendo taquicardia ventricular (TV) o fibrilación ventricular (FV), el riesgo de parada cardiaca es elevado y la única medida efectiva de prevención es la implantación de un desfibrilador automático (DAI). Existen factores desencadenantes de arritmias como el uso de algunos fármacos, el daño quirúrgico, anomalías electrolíticas, variaciones en el tono del sistema nervioso autónomo, fiebre, actividad física o embarazo.
En el paritorio, es poco frecuente encontrar una parturienta con SB. La variedad de escenarios posibles hace esencial conocer qué drogas deben evitarse y qué tipo de anestesia puede ser utilizada. Dada su impredecibilidad constituye un verdadero reto anestésico.
Caso clínico
Paciente de 29 años y primigesta de 35 semanas + 6 días que ingresó en la unidad de partos por bolsa rota >24 horas de evolución para inducción con dinoprostona. Estudiada por cardiología desde 2017 por episodios de palpitaciones frecuentes de minutos de duración, en esfuerzo y en reposo, con electrocardiograma (ECG) normal. Tenía historia familiar de muerte súbita (primo materno a los 24 años), prima materna portadora de DAI tricameral por miocardiopatía dilatada y otros dos primos con estudio genético positivo de SB. En el Holter de 48 horas se detectaron taquicardia sinusal y un episodio de taquicardia paroxística supraventricular (TPSV) a 175 latidos por minuto (lpm). El estudio genético resultó positivo para SB (portadora de la variante p.ARG 376 His en el gen SCN5A). El test de provocación con flecainida resultó negativo y la resonancia magnética (RMN) detectó corazón estructuralmente normal y fracción de eyección del ventrículo izquierdo (FEVI) conservada. Se decidió controles anuales de ECG por cardiología.
El embarazo transcurrió sin incidencias con ECG sin cambios. Los anestesiólogos, obstetras y cardiólogo de guardia, valoraron el caso contemplando los distintos escenarios posibles de vía de finalización de parto. Se realizó un plan anestésico. Se informó a la paciente y se obtuvo consentimiento informado.
Evolución del caso
Durante el trabajo de parto, dilatación de 3 cm, la paciente solicita analgesia epidural para control del dolor. Para la técnica epidural se monitorizan presión arterial no invasiva (PANI), ECG y saturación de oxígeno (SO2), siendo los parámetros 134/75 mmHg, 90 lpm y SO2 98%, respectivamente. Se localiza espacio epidural en L3-L4 a 6 cm con aguja Tuohy ® 18 gauge (G) y técnica de pérdida de resistencia con suero. El catéter epidural se fija a 11 cm de piel. Se administran dosis test (2 ml lidocaína 2%) y a continuación bolo inicial (10 ml de levobupivacaína al 0.125% + 100 µg fentanilo) fraccionado en tres tiempos. Se conecta perfusión de levobupivacaína al 0.125% + fentanilo 1,5 µg/ml a 6 ml/hora con sistema PCEA (analgesia epidural controlada por el paciente) con bolos programados de 10 ml cada 20 minutos. El bloqueo sensitivo inicial objetivado por pérdida de sensación al frío con alcohol alcanza un nivel metamérico de T10. La paciente permanece monitorizada 30 minutos después de realizar el bloqueo. A medida que progresa el parto, requiere la administración de bolos clínicos de 5ml de levobupivacaína 0,25% cada hora, con un total de tres bolos, siendo los dos primeros parcialmente efectivos, con escala visual analógica (EVA) 6. El nivel sensitivo es de T10 en todo momento. La paciente presenta náuseas y algún vómito durante el trabajo de parto y se administra ondansetrón 4mg ev. A las cuatro horas, ante la falta de respuesta después del tercer bolo clínico y en dilatación completa, se decide retirar catéter epidural y realizar técnica combinada espinal- epidural (CSE) en L3-L4 con dosis espinal de levobupivacaína 3 mg + 25 µg fentanilo que es efectiva (EVA 0). Se monitoriza de nuevo a la paciente y se colocan pegatinas del desfibrilador para vigilancia durante el período expulsivo. Tres horas después, con la presencia de dos anestesiólogos, se produce parto eutócico de niña con Apgar 9/10. Se administran un total de 500 ml de Ringer lactato. Se mantiene monitorización durante las dos horas del postparto inmediato. La paciente permanece estable durante el período de expulsivo y postparto inmediato siendo trasladada a planta de maternidad sin incidencias. No se advirtieron complicaciones durante los días restantes de ingreso.
Discusión
Las mujeres con SB pueden tener embarazos y partos (vaginales o por cesárea) sin desarrollar durante el proceso ninguna arritmia (2, 3). Sin embargo, se ha descrito un caso de tormenta eléctrica como primera manifestación del SB en una embarazada (4) y la necesidad de membrana de oxigenación extracorpórea (ECMO) para estabilizar episodio de FV en otra mujer embarazada con SB (5).
En el caso que presentamos, la paciente no había pasado por consulta con el servicio de anestesiología. Era portadora de la mutación del gen SCN5A, pero no cumplía criterios diagnósticos del SB del Shanghái score. Al ser una patología poco frecuente, y consensuado con cardiólogo, decidimos seguir las recomendaciones de seguridad como si de un paciente con SB se tratara. El plan anestésico que se contempló para cualquier vía de finalización del parto fue la anestesia neuroaxial y sólo en caso necesario, recurrir a anestesia general. En nuestro conocimiento, se trata del primer caso publicado de analgesia epidural para trabajo de parto con rescate de CSE con levobupivacaína en gestante con mutación del gen SCN5A realizado con éxito. Se han descrito casos de cesárea realizada con bupivacaína hiperbara intratecal en SB y ropivacaína (3,6,7).
La anestesia neuroaxial tiene un papel establecido dentro de la obstetricia. Sin embargo, existe controversia en su utilización en pacientes con SB. Los anestésicos locales (AL), al ser bloqueantes de los canales de sodio, en pacientes con mutación en gen SCN5A y con SB son potencialmente arritmogénicos. Utilizados con precaución producen menos cambios súbitos del tono autonómico que los anestésicos generales. El riesgo de los AL está directamente relacionado con el grado de absorción sistémica y con la concentración plasmática alcanzada y dependerá de la dosis, del lugar de administración y el tipo de anestésico utilizado. En el espacio epidural o subaracnoideo no existe prácticamente metabolismo. La absorción de AL en el espacio epidural sigue una distribución bifásica, con una rápida absorción inicial por la amplia vascularización, pero después más lenta por la presencia de grasa epidural. Esto condiciona un riesgo con perfusiones prolongadas o repetición de bolos. Así, la concentración plasmática está directamente relacionada con la dosis neuroaxial total administrada, siendo el abordaje subaracnoideo más atractivo por la mínima absorción sistémica y menor dosis para lograr efecto (6). La lidocaína por su corta duración es el AL de primera opción para procedimientos cortos. Ropivacaína y el enantiómero S (-) de la bupivacaína (levobupivacaína), son menos cardiotóxicos en comparación con bupivacaína, que permanece unida a los canales de sodio durante más tiempo generando un potencial aumento del riesgo de arritmias (1). Por ello, ante la realización de un bloqueo central o locorregional con AL en estos pacientes, debe estar directamente disponible la emulsión lipídica (intralipid 20%) para tratar la posible aparición de parada cardiaca u otros síntomas de intoxicación por AL (8). Recientemente se ha descrito su uso profiláctico en un paciente con SB previo a la realización de un bloqueo axilar del plexo braquial. La infusión se administró a 0,25 ml/kg/min durante 40 minutos, velocidad recomendada para el tratamiento de la intoxicación por AL (9).
Nosotros consideramos el bloqueo epidural como primera elección porque la paciente solicitó la analgesia en una fase muy temprana del parto y la intención inicial obstétrica era intentar parto vaginal. El óxido nitroso y remifentanilo se han utilizado como alternativa a la epidural en gestante con SB durante el trabajo de parto (6). Para disminuir la dosis total administrada, diluimos a la mitad la concentración habitual de levobupivacaína 0,25%, disponible en nuestro centro, siendo los bolos utilizados también de 0,125% no presentando la paciente ningún evento reseñable. También utilizamos levobupivacaína como rescate subaracnoideo. No fue necesario utilizar vasopresores para control de la presión arterial. El fármaco recomendado es la efedrina, aunque la fenilefrina se ha utilizado con precaución sin complicaciones (3).
En caso de proceso quirúrgico es recomendable colocar pegatinas del desfibrilador o que esté inmediatamente disponible para su uso. En nuestro caso colocamos las pegatinas del desfibrilador durante todo el expulsivo para mayor control (figura 1). En portadores de DAI, éste debería ser inactivado antes de la cesárea y reactivado después (10). En caso de cesárea urgente planificamos administrar lidocaína 2% por catéter epidural para conseguir nivel T4.
La anestesia general en la embarazada con SB tiene sus limitaciones: el manejo de vía aérea predeciblemente difícil, el uso de anestésicos endovenosos e inhalados que podrían repercutir en el recién nacido y en el caso de la madre con SB, podrían desencadenar arritmias malignas.
En relación con los hipnóticos endovenosos, existe controversia con el uso del propofol (11). Actualmente, el consejo asesor de BrugadaDrugs.org sugiere en su página web evitar la administración de propofol en pacientes con SB o con sospecha del mismo. La fuerza actual de recomendación es de un nivel de evidencia de II A (12). Sin embargo, se han comparado casos de inducción con bolo de propofol y mantenimiento con anestesia inhalatoria frente al uso de TIVA durante el procedimiento quirúrgico en pacientes con SB, sin evidencia de arritmias malignas o desfibrilaciones en ambos casos (13). Su uso en inducción e incluso para el mantenimiento de la anestesia con dosis que no excedan de 4 mg/kg/h son seguros en estos pacientes (1). Hay que tener en cuenta que la combinación de sedación con propofol en pacientes con anestesia neuroaxial puede potenciar el fenómeno de Brugada y aumentar el riesgo de arritmias (10). Recientemente ha sido utilizado el propofol para control de la ansiedad y de periodos más vagotónicos (parto del bebé, placenta y eversión uterina) durante un caso de cesárea con anestesia neuroaxial en una paciente con SB y portadora de DAI con buenos resultados (7). Otros hipnóticos como el tiopental y midazolam se han usado sin incidencias (10). La Ketamina, que bloquea los canales de sodio dosis-dependiente y los ⲁ2-agonistas como clonidina y dexmedetomidina que producen supresión simpática e incremento de la estimulación vagal del corazón, deberían ser evitados (1)
Los agentes volátiles pueden resultar más seguros. A pesar de ello, hay que tener en cuenta que pueden prolongar el QT con mayor riesgo de arritmias ventriculares asociadas. Tanto el isoflurano como el sevoflurano se han utilizado sin complicaciones en pacientes con SB, con estrecha vigilancia del ECG (1). Es importante asegurar adecuada profundidad anestésica, con monitorización del BIS (Biespectral Index Scale), evitando el incremento del tono parasimpático asociado a la anestesia profunda. La monitorización del ANI (Analgesia Nociception Index), puede ser útil también en estos pacientes (1).
El mantenimiento de la normotermia es prioritario puesto que la fiebre es un factor desencadenante de arritmia, así como un balance electrolítico normal (1). Además, hay que minimizar los cambios posturales.
Los relajantes musculares despolarizantes, como succinilcolina, deben evitarse en el SB por el aumento del tono vagal, aunque el riesgo es mayor en caso de una segunda dosis. Los relajantes musculares no despolarizantes pueden utilizarse sin problema. Dado los riesgos potenciales asociados a los cambios en el tono colinérgico inducidos por la neostigmina, el sugammadex es una opción segura como reversor del bloqueo neuromuscular (1).
Los opioides, como el fentanilo, no han sido asociados con complicaciones. Son preferidos opioides de acción corta o ultracorta, como el remifentanilo. Debe tenerse en cuenta que el efecto inductor de bradicardia de estos fármacos puede facilitar el desarrollo de complicaciones. En el periodo postoperatorio, la morfina es la droga de elección. El tramadol a dosis analgésicas puede utilizarse sin problemas, aunque se ha informado que sobredosis de tramadol induce patrón Brugada. No se han detectado complicaciones con otros analgésicos como los AINES (1).
Para la profilaxis de las náuseas y vómitos no están contraindicados ni los antagonistas 5HT3, como el ondansetrón, ni el droperidol, pero deben administrarse con precaución ya que alargan el QT (1). En este caso se administró ondansetrón como tratamiento sin complicaciones. La metoclopramida y los antihistamínicos son fármacos a evitar en el SB para la profilaxis de broncoaspiración (7,12,14). En un paciente con SB se ha descrito la utilización de Ranitidina sin incidencias (15).
El fármaco uterotónico de elección es la oxitocina. En atonía uterina, deben evitarse los derivados ergotaminérgicos, utilizados para producir vasoespasmo coronario en pacientes con SB conduciendo a FV (3,12,16). La mejor opción sería utilizar carboprost como fármaco de segunda línea. En caso de preeclampsia hay que prestar atención especial a la concentración de calcio, utilizar clevidipino o hidralazina para controlar la presión arterial, evitando clonidina, urapidilo o verapamilo y monitorizar ECG de precordiales derechas V1-V3 e intervalo QT (10).
Si a pesar de las medidas preventivas, aparecen alteraciones en el ECG, la primera acción a realizar es buscar y corregir inmediatamente los factores posibles causales como la fiebre, el aumento del incremento en el tono vagal, hipopotasemia, administración de drogas antiarrítmicas de clase I o cualquier otra droga relacionada con el SB. Los cambios en el ECG generalmente se resuelven una vez que las drogas desencadenantes se han dejado de administrar. Además de la cardioversión y reanimación cardiopulmonar, se recomienda el tratamiento con isoproterenol, 1-2 µg en bolo endovenoso seguido de una perfusión continua de 0,15-2,0 µg/min (1, 16). La monitorización del paciente se recomienda hasta 36 horas de la cirugía porque las arritmias son más comunes en el periodo perioperatorio.
Conclusión
El manejo anestésico de una gestante con SB en paritorio es un reto para el anestesiólogo, dada la posibilidad de diferentes escenarios posibles en un corto periodo de tiempo. Es fundamental la planificación multidisciplinar cuidadosa (obstetra, cardiólogo y anestesista) de las distintas situaciones que pueden aparecer.
La anestesia neuroaxial es de elección, siempre y cuando se tenga precaución en la dosis administrada del AL y teniendo acceso inmediato a un desfibrilador.
Las medidas preventivas deben adoptarse en cada caso individual, ya que no es posible establecer generalizaciones en el uso de determinados anestésicos. Ante portadores de la variante patogénica en SCN5A sin SB como el caso presentado, las recomendaciones serían realizar ECG en caso de fiebre o exposición a medicación que pudiese provocar SB sin necesidad de contraindicar fármacos, pero siempre eligiendo la opción con menos posibilidades de bloquear canales de sodio.
Bibliografía
- Espinosa A, Ripollés-Melchor J, Brugada R, Campuzano O, Sarquella-Brugada G, Abad-Motos A et al. Brugada Syndrome: anesthetic considerations and managemenet algorithm. Minerva Anestesiol. 2019; 85 (2): 173-188. Disponible en: doi 10.23736/S0375-9393.18.13170-1. (HTML)
- Giambanco L, Incandela D, Maiorana A, Alio W, Alio L. Brugada syndrome and pregnancy: highlights on antenatal and prenatal management. Case Rep Obstet Gynecol. 2014; 2014: 531648. Publicado online 2014 May 22 Disponible en: doi: doi: 10.1155/2014/531648
- Bramall J, Combeer A, Springett J, Wendler R. Caesarean section for twin pregnancy in a parturient with Brugada syndrome. Int J Obstet Anesth. 2011; 20 (2): 181-4. Disponible en doi: 10.1016/j.ijoa.2010.10.006. (PubMed)
- Sharif-Kazemi MB, Emkanjoo Z, Tavoosi A, Kafi M, Kheirkhah J, Alizadeh A, et al. Electrical storm in Brugada syndrome during pregnancy. Pacing Clin Electrophysiol. 2011; 34 (2): 18-21. doi: 10.1111/j.1540-8159.2010.02740. x. (HTML)
- Pagel PS, Lilly RE, Nicolosi AC. Use of ECMO to temporize circulatory instability during severe Brugada electrical storm. Ann Thorac Surg. 2009; 88 (3): 982-3. doi: 10.1016/j.athoracsur.2009.01.066. (HTML)
- Dawe H, Wendler R, Evans E, Hammond S. Peripartum anaesthetic management of a patient with Brugada syndrome and myoadenylate deaminase deficiency. Int J Obstet Anesth. 2018; 35 :96-98. Disponible en: doi: 10.1016/j.ijoa.2018.02.008. (PubMed)
- Marques da Costa F, Luís M, Lança F. Anaesthetic management of C-section in Brugada syndrome: When less is more. Rev Esp Anestesiol Reanim. 2019; 66 (6): 338-341. English, Spanish. Disponible en: doi: 10.1016/j.redar.2019.01.005. (PubMed)
- Corey SA, Varkey S, Phillips DR, Gay GL. Brugada Sybdrome induced by an Interscalene Block: A Case Report. JBJS Case Connect 2017;7:e96 (PubMed)
- Vasques F, Di Gregorio G, Behr AU. Is prevention better than cure? Local anesthetics in Brugada syndrome. Reg Anesth Pain Med. 2015 Jul-Aug;40(4):395-6. (HTML)
- Espinosa A, Ripollés Melchor J, Rodríguez Bustamante V, Izarduy L, Prieto Gundin A, Atienza A et al. Sd. De Brugada y anestesia: Manejo anestésico (parte III/III). Rev Elect AnestesiaR [Internet]. 2016 Feb. 1 [consultado 2020 Nov 23]; 8 (3):3. Disponible en: http://revistaanestesiar.org/index.php/rear/article/view/98. DOI: https://doi.org/10.30445/rear.v8i3.
- Kloesel B, Ackerman MJ, Sprung J, Narr BJ, Weingarten TN. Anesthetic management of patients with Brugada syndrome: a case series and literature review. Can J Anaesth. 2011; 58 (9): 824-36. doi: 10.1007/s12630-011-9546-y. (HTML)
- Drugs to be avoided by Brugada syndrome patients. BrugadaDrugs.org. [internet] [Consultado el 21 de Julio 2021] Disponible en: https://www.brugadadrugs.org/avoid/
- Flamée P, Viaene K, Tosi M, Nogueira Carvalho H, de Asmundis C, Forget P, et al. Propofol for Induction and Maintenance of Anesthesia in Patients With Brugada Syndrome: A Single-Center, 25-Year, Retrospective Cohort Analysis. Anesth Analg. 2021 Jun 1;132(6):1645-1653. doi: 10.1213/ANE.0000000000005540. (HTML)
- Bonilla-Palomas JL, López-López JM, Moreno-Conde M, Gallego de la Sacristana A, Gámez-López AL, Villar-Ráez A. Type I Brugada electrocardiogram pattern induced by metoclopramide. Europace 2011; 13:1353–4. (HTML)
- Rajesth MC, Kondi Sushma, Ramdas EK. The baffling issues of Brugada electrocardiogram pattern for anaesthesiologist. Indian J Anaesth. 2017 Oct; 61(10): 857–859 (PubMed)
- Postema PG, Wolpert C, Amin AS, Probst V, Borggrefe M, Roden DM et al. Drugs and Brugada syndrome patients: review of the literature, recommendations, and an up-to-date website (www.brugadadrugs.org). Heart Rhythm. 2009; 6 (9): 1335-41. doi: 10.1016/j.hrthm.2009.07.002. (HTML)