Bruña Vara J (1), Pretus Rubio S (1), Baños Maestro A (1), Mariscal Flores M (2).
(1) MIR Servicio Anestesiología y Reanimación del Hospital Universitario de Getafe. Madrid. España.
(2) Jefa de Sección Servicio Anestesiología y Reanimación del Hospital Universitario de Getafe. Madrid. España.
Introducción
La enfermedad tromboembólica venosa (ETEV), que aglutina a las entidades clínicas correspondientes a tromboembolismo pulmonar (TEP) y trombosis venosa profunda (TVP) supone el tercer síndrome cardiovascular más frecuente detrás del ictus y la isquemia miocárdica (1). En contraposición con esta gran prevalencia, al tromboembolismo pulmonar se le asocia cada vez una letalidad menor debido a intervenciones más efectivas (1), aunque aún es considerada la primera causa de muerte prevenible en pacientes hospitalizados, especialmente asociada a cirugía mayor (2).
Entre los factores de riesgo para dicha patología se encuentran:
-Factores relacionados con el paciente: edad avanzada, obesidad, diabetes mellitus o hipertensión arterial.
-Factores relacionados con el entorno: estratificados en distintos niveles de riesgo (Tabla 1).
Debido a la gran cantidad de factores favorecedores, la anticoagulación profiláctica se suele iniciar el mismo día de ingreso en Unidades de Cuidados Críticos asociado a otras medidas preventivas (2).
La situación pandémica actual con poblaciones sujetas a restricciones de movilidad puede motivar el aumento de casos de dicha patología en personas sanas además de los producidos en pacientes infectados por SARS-CoV-2.
La enfermedad grave producida por la infección por SARS-CoV-2 y su estado proinflamatorio asociado conducen a un estado de hipercoagulabilidad que motiva la aparición de este y otros fenómenos tromboembólicos (3).
Dado el acelerado recambio de la información disponible acerca de dicha infección, aún no está establecido su papel como factor permanente o temporal para el desarrollo de TEP.
Desarrollo
- Fisiopatología
El tromboembolismo pulmonar se produce por la migración de un trombo formado en los miembros inferiores que viaja a través del sistema venoso, atraviesa las cavidades cardíacas derechas y se enclava en algún punto de la arteria pulmonar o sus ramas.
- Efectos cardíacos: Se produce entonces una sobrecarga del ventrículo derecho (VD) con un aumento de la resistencia de la salida de la sangre hacia el pulmón (aumenta la presión en la arteria pulmonar), lo cual ocasiona dilatación del VD por aumento del volumen telediastólico y genera finalmente un descenso del gasto cardíaco (GC) y de la presión arterial (PA) por dos mecanismos:
-Disminución del volumen sistólico del VD y, por ende, descenso de aflujo a cavidades cardíacas izquierdas.
-Desplazamiento paradójico del tabique interventricular durante la sístole que origina un descenso de llenado del ventrículo izquierdo (VI).
Ambos factores contribuyen a la reducción del flujo coronario, pudiendo aparecer fallo ventricular derecho e isquemia miocárdica (4).
- Efectos respiratorios: la reducción del flujo pulmonar produce alteraciones en el intercambio de gases con tendencia a hipoxemia y desequilibrio en la relación ventilación/perfusión con aumento del efecto shunt, el cual contribuye más aún a la hipoxemia (1, 4).
Además, la vasoconstricción inducida por el TEP hace que se sinteticen mediadores inflamatorios (como la serotonina y el tromboxano A2) capaces de generar miocarditis e infiltración secundaria de células inflamatorias en el miocardio del ventrículo derecho, que pueden contribuir al remodelado posterior de la vasculatura pulmonar y al posible desarrollo de una hipertensión pulmonar crónica (1).
2. Clínica y abordaje inicial
+ Síntomas: Entre la clínica clásica se describe la disnea súbita, el dolor torácico o la hemoptisis, sin embargo, dichos síntomas son muy inespecíficos (5).
La aparición de síncope se asocia a inestabilidad hemodinámica (1) aunque en ciertos casos podría ocurrir en pacientes estables.
El shock podría ser la manifestación inicial en el 5% de los pacientes (5).
+ Signos: La taquipnea es el signo más común seguido de la taquicardia (5). Se pueden encontrar signos indirectos de cierta hipertensión pulmonar como la dilatación de venas cervicales o ruido de galope en el VD.
+ Pruebas de primer orden (ECG, radiografía de tórax y gasometría arterial): deben realizarse para descartar otras causas pudiendo encontrar una amplia gama de resultados que van desde la normalidad hasta alteraciones sugestivas de TEP (5).
De forma general, hallaremos en el ECG taquicardia sinusal y/o signos de sobrecarga de VD (patrón S1Q3T3) y en la gasometría arterial hipoxemia acompañada o no de hipocapnia (en función del grado de taquipnea).
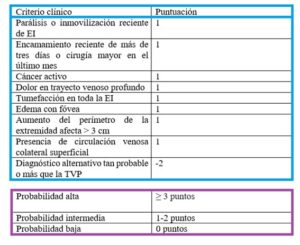
Debido a la ambigüedad de las manifestaciones clínicas y de las pruebas de primer orden, se han establecido varias escalas, aunque la más usada es la de Wells (Tabla 2) para estratificar a los pacientes con sospecha de TEP y ser más eficientes a la hora de indicar la siguiente prueba diagnóstica (5).
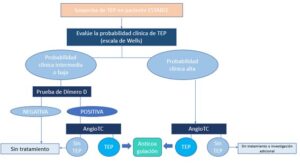
3. Manejo del paciente ESTABLE
Ante un paciente que se encuentre estable (Figura 1), lo primero será realizar una estratificación de la probabilidad de que tenga o no TEP mediante una escala de predicción que dividirá a los pacientes en:
–Probabilidad intermedia o baja: a dichos pacientes se les debe realizar una cuantificación de Dímero D (que aumenta su valor en caso de activación de la coagulación y fibrinolisis posterior, aunque también puede estar elevado en trastornos inflamatorios) (5).
El punto de corte depende varios factores, incluida la edad (1).
Dado su elevado valor predictivo negativo, un valor negativo descarta TEP con alta probabilidad (1).
En el caso de un valor patológico, se debe realizar un angioTC de arterias pulmonares con multidetectores para valorar la vasculatura pulmonar hasta el nivel subsegmentario (1).
Si con esta prueba no se detecta embolia pulmonar, se debe pensar en diagnósticos alternativos.
Si el angioTC es diagnóstico de TEP, se debe iniciar tratamiento con anticoagulantes (ver Apartado 7. Tratamiento inicial). Además de identificar embolia pulmonar, puede valorar la funcionalidad del VD prediciendo aquellos casos con comportamiento benigno, aunque este hecho aun ha de validarse en pacientes estables (6).
–Probabilidad alta: si la valoración clínica deriva en una alta probabilidad de presentar un TEP, se debe hacer directamente un angioTC, empezando anticoagulación si el resultado del mismo es positivo y valorando la realización de otras pruebas de imagen antes de descartarlo si es negativo, porque en este grupo de pacientes presenta un VPN de hasta el 60% (1).
Otras pruebas diagnósticas:
- Gammagrafía de ventilación-perfusión
No está incluida en el algoritmo de la guía de práctica clínica de la Sociedad Europea de Cardiología (ESC) por sus limitaciones (difícil acceso), pero es útil en pacientes con indicación de angioTC pero que presentan alguna contraindicación para la misma (embarazo) o en mujeres jóvenes a las que se les quiere evitar radiar la región mamaria, puesto que se ha visto que aumenta el riesgo de cáncer de mama (1).
En caso de mostrar un resultado negativo, se descarta TEP, pero si es positivo, es decir, muestra uno o dos defectos de perfusión subsegmentarios sin defectos de ventilación, se debe confirmar la embolia pulmonar con otras pruebas como la ecografía venosa de miembros inferiores o el SPECT.
- Arteriografía de arterias pulmonares
Considerada el Gold standard para el diagnóstico o la exclusión de TEP (1, 5). No está disponible en la mayoría de los centros y emite mucha radiación ionizante pero se utiliza cuando las pruebas no invasivas no son concluyentes o se tiene que evaluar la posibilidad de una hipertensión pulmonar asociada (5).
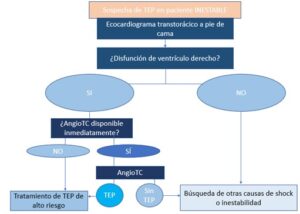
4. Manejo del paciente INESTABLE.
Definiremos a un paciente inestable como aquel que presenta una de las siguientes (1):
-PAS <90mmHg persistente que no se debe a sepsis, hipovolemia o a arritmia de nueva aparición.
-Shock obstructivo con signos clínicos de bajo gasto (mala perfusión, oligoanuria) con necesidad de drogas vasoactivas.
-Parada cardiorrespiratoria (PCR).
A estos pacientes, además de iniciar abordaje ABCDE para su estabilización inicial, se les debe hacer un ecocardiograma transtorácico (ecoTT) a pie de cama para evaluar la función del VD (Figura 2):
- Disfunción VD: manifestada como dilatación de la cavidad, desplazamiento del tabique interventricular o incluso distensión de la vena cava inferior en estadíos más avanzados (1).
Otros signos como el signo de McConell (contractilidad disminuida de la pared libre del VD, comparada con su vértice ecocardiográfico) o el signo 60/60 (la combinación de un tiempo de aceleración de eyección pulmonar < 60 ms con un gradiente pico sistólico de la válvula tricúspide < 60 mmHg) presentan un elevado valor predictivo positivo (VPP) y por tanto son indicativos de TEP (5).
Ante una disfunción ventricular se debe comenzar el tratamiento si no podemos realizar un angioTC en ese momento.
Si el angioTC está disponible y muestra TEP, se inicia tratamiento, aunque si el resultado es negativo buscaremos otras causas de inestabilidad.
- No disfunción de VD: ante un paciente inestable, buscaremos otras causas de shock (1)
5. Evaluación de la gravedad
En el caso de pacientes estables, es necesario una valoración del riesgo mediante la combinación de tres ítems (1):
- Disfunción del VD: tamaño de VD/VI> o igual a 1 (por ecocardiograma o angioTC).
- Troponina T aumentada (>14 en menores de 70 años y >45 a partir de los 70 años).
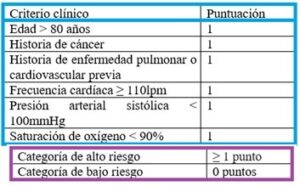
- Índice de severidad de embolismo pulmonar o escala de PESI elevado: integra la gravedad del TEP con la comorbilidad del paciente.
Permite estratificar el riesgo de muerte de los pacientes a los 30 días de presentar el embolismo pulmonar (1, 5).
Existe una escala de PESI simplificada (PESIs) de mayor adaptabilidad clínica que se muestra a continuación (Tabla 3).
La combinación de los tres resultados estratificará de nuevo a los pacientes siguiendo el esquema mostrado en la Figura 3.
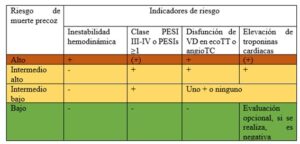
De esta forma un paciente estable, con un PESIs de 0, sin disfunción de VD ni troponinas elevadas tiene un riesgo bajo de muerte precoz.
Si el paciente tiene un solo punto de PESIs y alteración de VD o aumento de troponinas es de riesgo-intermedio bajo, mientras que si se combinan ambos marcadores cardíacos será intermedio-alto.
Si el paciente está inestable (hipotensión mantenida, shock obstructivo o PCR) el riesgo es alto independientemente del resto de resultados.
6. Estabilización inicial
Un paciente inestable será tratado inicialmente mediante el abordaje ABCDE.
En cuanto a la respiración, estos pacientes pueden requerir desde oxigenoterapia generalmente de alto flujo (el efecto shunt hace que responsan peor a flujos bajos de oxígeno) hasta intubación orotraqueal con ventilación mecánica invasiva.
En este tipo de pacientes, la insuficiencia aguda del VD que genera bajo gasto será la primera causa de muerte (1) por lo que se comenzará un tratamiento escalonado:
- Aumento de volumen: si se mide la presión venosa central y ésta es baja, debemos hacer cargas de volumen con monitorización ecográfica de la vena cava inferior y de la distensión del VD.
- Uso de drogas vasoactivas: cuando se ha producido un fracaso de la función del ventrículo, puede ser necesario utilizar noradrenalina (inotrópica positiva y favorece la vascularización coronaria) o dobutamina (inotrópica positiva pero desencadenante de arritmias e hipotensión si se utiliza de forma aislada). Otras opciones son el óxido nitroso o el levosimendán por ser vasodilatadores pulmonares.
- Circulación por membrana extracorpórea (ECMO): se utilizará en pacientes que hayan sufrido una PCR o tengan un riesgo alto y sean refractarios a otras medidas.
Es una medida útil a muy corto plazo que consiste en extraer la sangre a través de una vena de grueso calibre, llevarla hasta una máquina que presenta un motor integrado y realiza el intercambio de CO2 y oxígeno y devolverla al paciente a través de otra vena si solo requerimos soporte respiratorio o a una arteria si también lo queremos cardíaco.
Su principal contrapartida son las complicaciones derivadas de la propia técnica (1) que van desde infecciones hasta hemorragias graves en pacientes que van a estar sometidos a anticoagulación y puede que a fibrinolíticos.
7. Tratamiento inicial
Una vez realizado el diagnóstico de TEP, confirmado en un angioTC en un paciente estable o bien ante un paciente inestable y con alta sospecha, todos los pacientes deben recibir tratamiento anticoagulante independientemente del grado de severidad:
- Anticoagulación parenteral
- Heparina no fraccionada (HNF): Indicada en pacientes con TEP de riesgo alto asociado a inestabilidad hemodinámica, obesidad o disfunción renal (aclaramiento de creatinina [CrCl] ≤30 ml/min).
Como efectos secundarios graves destaca la trombopenia y la tendencia a hemorragias graves.
- Heparina de bajo peso molecular (HBPM) ajustada al peso o fondaparinux: de elección por presentar menos efectos secundarios en el caso de TEP de riesgo intermedio-bajo.
- Anticoagulación oral no inhibidores de vitamina K.
Suponen la primera elección de cara a la prevención de recurrencias a largo plazo (1). Son los nuevos anticoagulantes orales: apixaban, edoxaban y rivaroxabán (inhiben el factor X) y dabigatran (inhibe al factor II).
Tienen menos interacciones y menos probabilidad de hemorragia mayor que los inhibidores de la vitamina K.
- Anticoagulación oral inhibidores de vitamina K
Dado su efecto protrombótico inicial (acenocumarol), durante los primeros 5 días de uso se debe mantener la anticoagulación parenteral hasta obtener un INR de 2-3 durante 48 horas y después ir ajustando las dosis. Empleados como prevención de recurrencias a largo plazo.
8. Evolución clínica
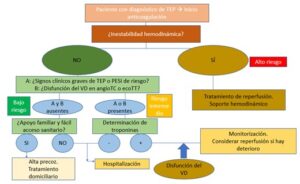
Una vez que el paciente ha sido diagnosticado de TEP y ha iniciado el tratamiento anticoagulante debemos reevaluarle (Figura 4):
- Paciente estable sin signos clínicos de riesgo y sin disfunción del VD y con soporte domiciliario adecuado, podrá darse de alta con anticoagulación. Si no cuenta con soporte, deberá quedarse hospitalizado.
- Paciente estable con signos clínicos de riesgo o disfunción del VD deberá hacerse una determinación de troponinas que, aunque sea negativa le llevará a permanecer hospitalizado, pero si es positiva y presenta disfunción ventricular será preciso que permanezca monitorizado por si se inestabilizara.
- Paciente inestable en el que hemos iniciado terapia de soporte y anticoagulación, se debe realizar tratamiento de reperfusión.
9. Terapia de reperfusión
- Trombolisis sistémica
La administración de un fármaco que disuelva el trombo (alteplasa, uroquinasa o estreptoquinasa) se asocia a mejoría de la clínica y de la disfunción del VD y aunque su efecto es mayor en las primeras 48h del cuadro, pueden administrarse hasta 2 semanas del inicio del mismo (1).
Su mayor riesgo es la hemorragia mayor y cerebral, la cual se disminuye si la administración se realiza en infusión corta (1, 7).
Existe controversia acerca de su administración al mismo tiempo que la HNF (7).
Antes de su prescripción, deben revisarse sus contraindicaciones puesto que varias de éstas pueden ser a su vez factores favorecedores para TEP como el trauma grave o cirugía en las últimas 3 semanas, ictus isquémico en los últimos 6 meses o tumores en el SNC (1, 7)
En el caso de no mejoría con fibrinolíticos o de contraindicaciones para los mismos, y puede que en pacientes de alto riesgo (8) se debe emplear alguna de las dos siguientes estrategias (5)
- Tratamiento percutáneo
En este caso, se canaliza la arteria femoral y se llega desde ahí a la arteria pulmonar utilizando en esta región una doble técnica de fragmentación trombótica mecánica o por ultrasonidos junto con administración local de fibrinolíticos (1) con la que se consigue una mejora en la presión en la arteria pulmonar (PAP), la función del VD y la perfusión pulmonar (5, 7).
Está indicada en pacientes con alto riesgo de sangrado y moderado-alto riesgo de muerte por embolia (7, 8).
- Embolectomía quirúrgica
Se realiza, con bypass cardiopulmonar sin pinzamiento aórtico ni solución cardiopléjica, una apertura de ambas arterias pulmonares con extracción del trombo (1).
Los estudios no son concluyentes en cuanto a preferir esta técnica (más mortalidad) sobre la fibrinolisis (más ictus y más recurrencia de TEP) ya que con ambas se observa una mejoría de la PAP y de la función del VD (1, 8). Podría ser útil la combinación de ECMO con la embolectomía quirúrgica, hecho que aún debe estudiarse más en profundidad (1).
10. Alternativa a la anticoagulación
El eje de la terapéutica en la embolia pulmonar es la anticoagulación, pero si existe alguna contraindicación absoluta para la misma, la opción es colocar un filtro de vena cava inferior para prevenir que los coágulos que se formen en las EEII pasen al pulmón (1, 9).
Otra indicación de dichos filtros son aquellos TEP recurrentes a pesar de tratamiento anticoagulante o bien como profilaxis primaria de pacientes con alto riesgo de presentar ETEV (1).
No obstante, las complicaciones son frecuentes y graves como la fractura del dispositivo, migración o lesión de la vena cava inferior, por lo que es preferible utilizar filtros extraíbles (9).
11. Complicaciones a largo plazo
La complicación fundamental y más temible es el desarrollo de hipertensión pulmonar tromboembólica crónica o HPTEC (1, 2, 4, 5 y 10) aunque el síntoma que más frecuentemente persiste es la disnea de esfuerzo (1).
La HTPEC se produce por una obstrucción persistente de las arterias pulmonares con trombos organizados que produce distribución del flujo y remodelado secundario del lecho microvascular.
Se diagnostica como una PAP media > 25mmHg con presión de enclavamiento de la arteria pulmonar < o igual a 15 y precisa de un tratamiento complejo desde fármacos, como anticoagulantes, diuréticos y oxigenoterapia, hasta procedimientos quirúrgicos o percutáneos en centros muy especializados, para agrandar aquellos vasos cuyo diámetro se ha reducido (1).
Es necesario el seguimiento de estos pacientes por el desarrollo de complicaciones pulmonares, así como el complejo manejo posterior de la anticoagulación en función del paciente (factores de riesgo modificables o no como el cáncer) (1, 5, 10 ). Esto ha motivado la aparición en algunos países de los llamados Equipos de Respuesta a Embolia Pulmonar (10), integrado por diferentes especialistas que actuarán en el momento agudo buscando el diagnóstico eficiente, la estratificación del riesgo así como el inicio precoz del tratamiento y también a largo plazo como ya se ha indicado. No obstante, aún tiene que demostrarse en estudios aleatorizados la mejoría en términos clínicos de la creación de dichos grupos (10).
Conclusión
El tromboembolismo pulmonar es una entidad frecuente con una amplia variedad en cuanto a su sintomatología, que además puede ser inespecífica por lo que se debe contemplar ante cualquier paciente que presente factores de riesgo asociados.
Inicialmente se debe valorar el grado de probabilidad de estar ante un TEP, y posteriormente clasificar al paciente en función de su clínica para decidir el mejor abordaje. Tras el tratamiento inicial, se deberá estratificar de nuevo para evaluar la probabilidad de mortalidad que presenta dicho paciente y decidir si requiere alguna medida invasiva.
Una vez que ha concluido la fase aguda, debemos educar al paciente en la importancia de mantener el tratamiento anticoagulante para evitar recidivas, y a su vez son necesarias evaluaciones clínicas periódicas para detectar complicaciones que pueden conducir a un aumento de la morbilidad y, por tanto, a un descenso en la calidad de vida.
Bibliografía
1) Konstantinides SV, Meyer G, Becattini C, Bueno H, Geersing GJ, Harjola VP, et al. Guía ESC 2019 para el diagnóstico y tratamiento de la embolia pulmonar aguda. Rev Esp Cardiol. 2020; 73 (6): 497.e1 – 497.e58. (HTML)
2) Marino PL, Galvagno Jr SM, et al. Tromboembolismo venoso. El manual de la UCI. 2ª ed. Barcelona: Wolters Kluwer; 2018: 57-63. (HTML)
3) López-Reyes R, Oscullo G, Jiménez D, Cano I, García-Ortega A. Riesgo trombótico y COVID-19: revisión de la evidencia actual para una mejor aproximación diagnóstica y terapéutica. Arch Bronconeumol. 2021; 57 (S1): 55-64. (HTML)
4) Committee for European Education in Anaesthesiology (CEEA). Respuestas de la circulación pulmonar y ventilación unipulmonar. Fisiología aplicada a la Anestesia. 3ª ed. Madrid: ERGON; 2014: 403-406.
5) Wang KL, Kao YT, Chang WT, Chang HY, Huang WC, Hsu PC, et al. Management of Venous Thromboembolisms: Part II. The Consensus for Pulmonary Embolism and Updates. Acta Cardiol Sin. 2020;36: 562-582. (PubMed)
6) Plasencia-Martínez JM, Carmona-Bayonas A, Calvo-Temprano D, Jiménez-Fonseca P. Valor pronóstico de la tomografía computarizada en la tromboembolia pulmonar aguda. Radiología. 2016; 58 (5): 391-403. (HTML)
7) Ceresetto J. Fibrinolíticos en tromboembolismo de pulmón. Nuevas alternativas para una indicación controvertida. MEDICINA (Buenos Aires) 2018; 78: 265-271. (PDF)
8) Theroux CD, Aliotta JM, Mullin CJ. High-Risk Pulmonary Embolism: Current Evidence-Based Practices. R I Med J (2013). 2019 Dec 2;102(10):43-47. (PubMed)
9) Barash PG, Cullen BF, Stoelting RK, Cahalan MK, Stock MC, Ortega R et al. Traumatismo y quemaduras. Anestesia Clínica. 8ª ed. Barcelona: Wolters Kluwer; 2018: 1531. (HTML)
10) Kolte D, Parikh SA, Piazza G, Shishehbor MH, Beckman JA, White CJ et al. American College of Cardiology Peripheral Vascular Disease Council. Vascular Teams in Peripheral Vascular Disease. J Am Coll Cardiol. 2019 May 21;73(19):2477-2486. (PubMed)





Interesado en Anestesiología Clínica y Medicina del Dolor