Rodríguez Contreras R; Vega Salvador A; Reche Navarro E; Estévez Santiago J.
Facultativo Especialista de Área. Servicio de Anestesiología y Reanimación. Hospital Universitario Torrecárdenas, Almería.
Cómo citar este artículo: Rodríguez Contreras, R., Vega Salvador, A., Reche Navarro, E., & Estévez Santiago, J. (2023). Anestesia en tumores supratentoriales. Revista Electrónica AnestesiaR, 15(5). https://doi.org/10.30445/rear.v15i5.1145
Primera parte aquí (link)
Manejo transanestésico (sigue)
5. Mantenimiento anestésico
Puede utilizarse una técnica inhalatoria, total intravenosa (TIVA) o balanceada, en combinación con un opioide de acción corta y relajante neuromuscular.
El uso adecuado del anestésico es más importante que la elección del agente en sí. Los agentes volátiles son vasodilatadores pero a concentración inferior a 1CAM mantienen la respuesta al CO2. De todos ellos, el sevoflurano es el inhalatorio con menor capacidad de vasodilatación cerebral y el que mejor preserva la autorregulación. Permite un rápido control a través de la ventilación, un despertar precoz y es predecible, aunque la incidencia de NVPO es mayor que con TIVA. Diversos estudios señalan menor supervivencia en cirugía oncológica con el uso de agentes volátiles por alteración de la respuesta inmunológica[13]. La anestesia con propofol requiere monitorización de la profundidad anestésica y disminuye más la PAM, aunque también disminuye más la PIC y aumenta la PPC, tiene potencial anticonvulsivo, no interfiere con los PEM y disminuye las NVPO. La elección óptima del anestésico dependerá, por tanto, de la existencia de HTIC, el uso de neuromonitorización y la comorbilidad del paciente:
- Pacientes con PIC normal y sin necesidad de monitorización neurofisiológica no parece haber una técnica superior a otra. Se puede emplear una técnica balanceada que incluya dosis bajas de anestésicos volátiles (sevoflurano 0.6-0.8CAM o según BIS 50-60), opioides (fentanilo 1-2mcg/kg cada 1-2h o remifentanilo 0.05-0.2mcg/kg/min) y BNM[14].
- Pacientes con PIC elevada, se recomienda una técnica predominantemente IV (propofol 70-140mcg/kg/min, titulado según BIS 50-60) + remifentanilo 0.05-0.3mcg/kg/min + BNM.
- En craneotomías con neuromonitorización, se recomienda TIVA y evitar BNM.
Los opioides, cuando se administran con una ventilación controlada, tienen efectos mínimos sobre la fisiología cerebral, a excepción de la morfina que puede aumentar el FSC por liberación de histamina. Por su vida media corta, el remifentanilo es de elección, combinado con pequeñas dosis de opioides de acción más larga o residual para control del dolor postoperatorio.
Normalmente los pacientes sometidos a craneotomía supratentorial mantienen la relajación neuromuscular durante la anestesia general, ya que disminuye la posibilidad de movimiento y tos que pueden aumentar la PIC y producir deslizamiento de los clavos, sangrado o, incluso lesión de columna cervical, si se produce antes de la retirada del cabezal de Mayfield.
El mantenimiento anestésico debe adecuarse al estímulo quirúrgico. La mayoría de las craneotomías alternan periodos de intenso estímulo doloroso separados por periodos relativamente largos de bajo nivel de estimulación que requieren el ajuste de la profundidad anestésica (Fig. 4). El anestesiólogo debe anticiparse a los momentos de mayor y menos estímulo con el fin de lograr la mayor estabilidad hemodinámica.
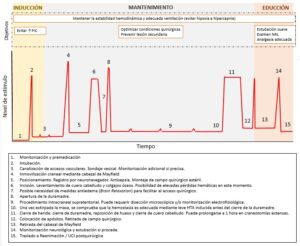
6. Posición
Variará dependiendo la localización del tumor y el abordaje quirúrgico. La posición supina con leve elevación de la cabeza (15-30º) para favorecer el drenaje venoso y ligera rotación para mejorar la exposición quirúrgica es la más usada (Fig. 5).
La cabeza del paciente puede colocarse sobre un reposacabezas o, más frecuentemente, inmovilizarse con la fijación de unos clavos mediante el cabezal de Mayfield, lo que supone un estímulo altamente doloroso, breve y repentino, que conducirá a una intensa respuesta simpática con aumento de la PIC. Esta respuesta puede atenuarse de diversas formas:
- Premedicación IV con opioides (fentanilo 50-100mcg; remifentanilo 25-50mcg), propofol (20-50mg), esmolol (0.25-0.5mg/kg) y/o lidocaína (1mg/kg), administrados 1 minuto antes de la colocación de los clavos. La administración de mayores dosis puede conducir a hipotensión tras finalizar el estímulo.
- Infiltración con anestésico local de vida media larga en los lugares de anclaje del Mayfield o bloqueo del cuero cabelludo (Scalp Block)[15].
Se han descrito embolismos venosos durante la colocación de los clavos, por lo que requiere monitorización estrecha.
Se debe prestar especial atención a la colocación del paciente para evitar complicaciones intraoperatorias como obstrucción al drenaje yugular y postoperatorias como lesiones de plexo braquial, daño de nervios periféricos, lesión de columna cervical, lesiones oculares o lesiones cutáneas por presión. La hiperflexión de la columna cervical puede impedir el drenaje venoso, aumentando la PIC, y causar edema de la vía aérea. Simples medidas preventivas como asegurar una distancia de 2 dedos entre el mentón y el pecho pueden prevenir esta complicación. Normalmente se coloca un apoyo debajo de los hombros para evitar una excesiva flexión y rotación de cuello. Las rodillas deben estar levemente flexionadas para evitar problemas de espalda.
El acceso al paciente durante la cirugía es dificultoso, por lo que, antes de cubrirlo con el campo quirúrgico, se debe verificar la correcta posición del tubo endotraqueal y las conexiones tubo-respirador, el almohadillado de los puntos de presión, la protección ocular con oclusión adhesiva que mantenga los párpados cerrados y evite que las soluciones antisépticas puedan entrar en los ojos y el acceso a las vías.
7. Manejo hemodinámico
La PA debe ser estrictamente controlada durante la craneotomía, evitando grandes fluctuaciones de la misma para mantener una adecuada PPC. El objetivo de PAM óptima intraoperatoria continúa siendo motivo de debate. Asumiendo una PIC (o PVC) normal de 5-10mmHg, una PAM de 75-90mmHg podría ser un objetivo razonable en un paciente sin complicaciones.
La PAM debe mantenerse por encima del límite inferior de autorregulación para tener un margen de error, por lo que, en situaciones donde ésta se vea alterada, como ocurre en el paciente hipertenso, se debe mantener la PAM cercana al valor basal del paciente despierto (+/- 20%).
Para conseguir estos objetivos y lograr la estabilidad hemodinámica, será necesario optimizar el volumen intravascular, titular los agentes anestésicos a la intensidad del estímulo quirúrgico y tratar enérgicamente los episodios de hipotensión e HTA.
La hipotensión suele ser debida a la vasoplejia inducida por los anestésicos (especialmente durante los momentos de baja estimulación quirúrgica), siendo la fenilefrina el vasoconstrictor de elección, administrada a la menor dosis necesaria para alcanzar una adecuada PPC. No obstante, otros vasopresores con efecto beta pueden estar indicados en función de la situación cardiovascular del enfermo. Hay que tener en cuenta que el uso de vasopresores conlleva riesgo de reducción en la oxigenación cerebral. Otras causas de hipotensión e inestabilidad hemodinámica durante la cirugía son la administración de diuréticos osmóticos, la hemorragia intraoperatoria y la embolia gaseosa.
La HTA es típicamente observada durante la IOT, la colocación de los clavos para fijación al Mayfield y la extubación. Para su tratamiento, los betabloqueantes son de elección (labetalol 5-10mg IV con inicio de acción de 5min y duración de 3-6h; esmolol 20-50mg IV de acción ultracorta), sin efecto en el FSC. El empleo de vasodilatadores como nitroglicerina (10-400mcg/min IV) o nicardipino (5-15mg/h IV con inicio en <2min y duración de 60min), debe ser cauto en pacientes con aumento de PIC ya que aumentan el FSC (si se mantiene una PAM adecuada), debiendo evitarse su uso antes de la apertura de la duramadre.
8. Fluidoterapia
El objetivo debe ser la euvolemia, idealmente guiada por objetivos dinámicos, para mantener una adecuada PPC y prevenir el edema cerebral. La reposición de las pérdidas de fluidos debe hacerse con cristaloides. El suero salino 0.9% es el cristaloide de elección dado que es ligeramente hiperosmolar en relación al plasma, pero grandes volúmenes pueden causar acidosis hiperclorémica, por lo que puede alternarse con soluciones isotónicas (ej. Plasmalyte®) como fluidoterapia de mantenimiento[16]. Las soluciones con glucosa deben evitarse, ya que podrían empeorar el edema cerebral y aumentar el daño isquémico. Los coloides (albúmina 5-20%) pueden estar indicados en pacientes hipovolémicos e hipotensos para expandir rápidamente el volumen intravascular, limitando la sobrecarga hídrica. Los coloides con almidón deben evitarse dado que interfieren con la función plaquetaria y pueden inducir coagulopatía, aumentando el sangrado.
El sangrado puede ser significativo durante la craneotomía. La mayor y más rápida pérdida de sangre suele ocurrir durante la apertura de hueso, especialmente en tumores grandes. Requiere control estrecho, ya que muchas veces quedará oculta bajo los paños, en la bolsa de recolección del campo quirúrgico o por los clips del cuero cabelludo. Las pérdidas sanguíneas se repondrán con coloides y sangre para mantener el nivel de Hb≥7-8g/dl.
9. Ventilación
Hay una correlación casi lineal entre el FSC y los cambios agudos en la PaCO2 (variación del 1-6% del FSC por cada mmHg de PaCO2 dentro del rango de 20-80mmHg). El objetivo de la ventilación debe ser la normocapnia (PaCO2 35-40mmHg) o una hipocapnia muy leve (PaCO2 30-35mmHg). La hiperventilación transitoria puede emplearse para reducir la PIC o mejorar la exposición quirúrgica y debe ser guiada por gasometría (PaCO2), mejor que por EtCO2. Aunque la hiperventilación moderada (PaCO2 25-30mmHg) mejora las condiciones operatorias durante la craneotomía supratentorial[17], no está claro que sus potenciales beneficios en el acceso quirúrgico superen el riesgo de isquemia cerebral en el tejido lesionado. Por lo tanto, la hiperventilación debería usarse sólo cuando esté indicada, como parte de un enfoque multimodal para la relajación cerebral durante la cirugía, haciendo esta maniobra lo más breve posible, sin sobrepasar PaCO2 de 30mmHg y con un retorno progresivo a la normocapnia para evitar vasodilatación cerebral de rebote. Debe monitorizarse también la PaO2 para evitar la hipoxemia.
La presión intratorácica debe ser la menor posible, evitando las presiones altas en la vía aérea y la presión positiva al final de la espiración (PEEP) para favorecer el drenaje venoso y de LCR y, con ello, disminuir el sangrado y la HTIC.
10. Optimización del campo quirúrgico
Las condiciones operatorias óptimas se definen por un cerebro sin tensión que facilite el acceso quirúrgico y disminuya la necesidad de retracción cerebral, disminuyendo así la potencial isquemia cerebral local y el edema postoperatorio. En este sentido, la colaboración entre anestesiólogo y neurocirujano es crucial.
En caso de ser necesario, como parte del procedimiento, tras consultar el caso con el neurocirujano, se aplican, previo a la apertura de la duramadre, una serie de medidas para que el cerebro se encuentre en las mejores condiciones en cuanto a distensibilidad. Dichas medidas se aplican tras la inducción con el objetivo de facilitar el acceso quirúrgico y consisten en la reducción del volumen cerebral a través de:
- Elevación de la cabeza para facilitar drenaje venoso.
- Glucocorticoides para reducir el edema vasogénico. Deben ser administrados pre-operatoriamente (24-48h previos a la resección quirúrgica) ya que tienen un inicio de acción lento. El régimen estándar suele comenzar con una dosis de 10mg de dexametasona (0.1-0.3mg/kg IV) seguida de 4mg/6h.
- Diuréticos de asa (furosemida 0.3-0.6mg/kg IV) para disminuir el volumen sanguíneo y descender la producción de LCR. Estos efectos ocurren en ausencia de cambios en la osmolaridad plasmática, pero no son tan efectivos como el manitol en reducir la PIC. La furosemida, en combinación con el manitol, es más efectiva que el manitol solo pero conlleva un aumento del riesgo de deshidratación y alteraciones electrolíticas.
- Osmoterapia: requieren una BHE intacta para ejercer su efecto osmótico, ya que la interrupción de la misma puede resultar en la entrada de estos agentes en el cerebro y empeorar el edema. Requieren estrecha monitorización por riesgo de deshidratación y alteraciones hidroelectrolíticas. Los agentes más usados son:
- Manitol 20% (0.25-1g/kg IV): causa un incremento inicial del volumen intravascular seguido de una intensa diuresis osmótica. Su efecto beneficioso sobre la PIC se observa en 10-15min y provee un adecuado campo durante 2-3h. Además, debido a su efecto reológico, disminuye la resistencia cerebrovascular y la viscosidad sanguínea, facilitando la perfusión tisular. Por otro lado, la diuresis masiva resultante puede conducir a daño renal agudo e hipoperfusión tisular, haciéndose necesaria una adecuada reanimación que optimice el reemplazo de volumen intravascular. Debería evitarse en pacientes que no toleran la expansión intravascular inicial (insuficiencia cardiaca) o que no pueden eliminarlo (insuficiencia renal).
- Suero salino hipertónico 3% (SSH; 3-5ml/kg IV): produce una elevación aguda y transitoria del sodio, aunque no hay casos publicados de desmielinización central en el contexto de la osmoterapia durante la craneotomía en pacientes normonatrémicos. Los niveles de sodio retornan a la normalidad en las siguientes 48h.
Ambos pueden administrarse a través de una vía periférica y, salvo extrema emergencia, deben infundirse a lo largo de 15-20min para evitar hipotensión y minimizar el riesgo de hipoperfusión. Los dos son igualmente efectivos para controlar la PIC aunque el SSH mantiene mejor la estabilidad hemodinámica[18] y se prefiere en pacientes con insuficiencia renal.
En ocasiones, a pesar de haber aplicado una meticulosa técnica anestésica, las condiciones operatorias pueden ser adversas. Durante la cirugía, el aumento de la PIC >15mmHg se reflejará en un cerebro edematizado y tenso que protruye de la craneotomía, siendo necesario su tratamiento para optimizar la exposición quirúrgica y prevenir la lesión cerebral isquémica resultante. El manejo del edema cerebral intraoperatorio implica revisar los principios fisiológicos de la dinámica cerebral y optimizar la PIC, siendo recomendable el empleo de Checklists (Fig. 6).

11. Control glucémico
Tanto la hipoglucemia como la hiperglucemia empeoran el daño neurológico y deben evitarse durante la craneotomía. Los episodios de hiperglucemia son frecuentes debido al estrés quirúrgico y al uso de corticoides. Incluso una dosis única de dexametasona puede aumentar significativamente la glucemia en pacientes no diabéticos. No se ha establecido el nivel de glucosa por encima del cual el daño neuronal ocurre ni se ha fijado un objetivo ideal de glucemia. Se recomienda mantener un nivel de glucemia de 110-180mg/dl, ya que controles más estrictos se asocian a mayor riesgo de hipoglucemia. Los valores >180mg/dl deben ser tratados con insulina y monitorización estrecha.
12. Profilaxis tromboembólica
Los gliomas de alto grado conllevan un significativo riesgo de trombosis venosa. Además, los procedimientos suelen ser prolongados y el cerebro es una fuente rica en tromboplastina, por lo que se aconseja el uso de dispositivos mecánicos para prevenir el estasis venoso durante la cirugía.
13. Profilaxis de NVPO
Debe realizarse de rutina debido al efecto deletéreo en la PIC del esfuerzo y la arcada. Estrategias para disminuir el riesgo basal de NVPO son el uso de TIVA, evitar óxido nitroso y mantener adecuada hidratación. El ondansetron (4mg IV durante el cierre de la duramadre) se ha mostrado efectivo en reducir esta incidencia. También se puede emplear droperidol en casos de alto riesgo, aunque se debe evitar en niños como primera elección por su riesgo aumentado de síntomas extrapiramidales. La metoclopramida no tiene un efecto clínico relevante en las NVPO.
14. Analgesia
A pesar de que los opioides tienen el mayor potencial analgésico, su uso en este tipo de procedimientos está restringido dado que interfieren con la monitorización neurológica y se asocian a efectos adversos (depresión respiratoria, delirium, NVPO). El dolor post-craneotomía puede llegar a ser severo y suele estar infra-tratado debido a esta preocupación. Además, el dolor agudo mal controlado en el postoperatorio aumenta el riesgo de dolor crónico. La hiperalgesia inducida por opioides contribuye a este problema y se atribuye, en gran medida, a las infusiones prolongadas de remifentanilo en las craneotomías, debido a su vida media ultracorta tras su suspensión. Los antiinflamatorios no esteroideos (AINEs), aunque pueden mitigar la hiperalgesia, deben emplearse con precaución debido a su efecto sobre la inhibición plaquetaria, con el potencial riesgo aumentado de hematoma postoperatorio.
Para mejorar esta situación, se han propuesto estrategias multimodales[19,20] que incluyen el uso de scalp block, paracetamol, lidocaína (bolo de 1.5mg/kg IV post-inducción seguido de 2mg/kg/h IV hasta el final de la cirugía), dexmedetomidina (ha ganado auge en la analgesia transicional desde el intraoperatorio hasta el postoperatorio, disminuye el delirium, disminuye riesgo de sangrado por su efecto hipotensivo, propiedades antieméticas, permite “sedación cooperativa”, prolonga el efecto de los anestésicos locales en el scalp block), gabapentinoides (pregabalina 150mg VO la tarde anterior a la cirugía, 150mg VO 1.5h antes de la cirugía y 150mg/12h VO durante las siguientes 72h postoperatorias), entre otras. El esmolol, administrado en bolo de 0.5mg/kg IV 10min antes de la inducción y seguido de una perfusión de 0.2mg/kg/min IV ha demostrado una disminución de los requerimientos anestésicos, permitiendo una extubación más precoz[13].
Una estrategia consistiría en usar coadyuvantes (al menos 30min antes de finalizar el procedimiento), suspender remifenanilo al finalizar la cirugía y hacer una evaluación neurológica inmediata, previa a la administración de fentanilo 0.5-1mcg/kg IV en quirófano si dolor y examen neurológico favorable (la alternativa sería administrar una pequeña dosis de fentanilo 0.5mcg/kg IV al cierre de la duramadre). La analgesia adicional con opioides de acción larga será administrada en reanimación, titulada a efecto y después del examen neurológico, o bien considerarla en quirófano en aquellos pacientes en tratamiento crónico preoperatorio con opioides y sin alteración previa del estado mental.
15. Educción anestésica
En mayoría de las craneotomías que transcurren sin incidencias, el paciente puede ser despertado y extubado en quirófano para hacer una evaluación precoz del estado neurológico (Tabla 3).
En caso de importantes pérdidas sanguineas, grandes tumores que requieren una extensa disección, edema cerebral, proximidad del tumor de centros vitales o alteración preoperatoria del nivel de conciencia, se debe considera retrasar la extubación, trasladando al paciente sedoanalgesiado e intubado a una unidad de cuidados intensivos de anestesia (UCIA) dado el mayor riesgo de complicaciones postoperatorias en estas situaciones. En algunos casos, puede ser necesaria la colocación de un sensor de PIC.
El despertar se asocia a aumentos bruscos de la PA, que deben ser anticipados y/o tratados ya que pueden originar aumento de la PIC, sangrado intracraneal o empeoramiento del edema cerebral en áreas donde la BHE esté dañada. Por este motivo, la técnica debe ser suave y controlada. Se debe esperar hasta que el paciente esté completamente descubierto de los paños quirúrgicos y todos los apósitos colocados correctamente, procurar mantener la estabilidad hemodinámica, evitar el aumento de la PVC y la PIC y asegurar la adecuada oxigenación y ventilación. El paciente debe estar lo suficientemente despierto para realizar una valoración neurológica simple (respuesta a órdenes sencillas, movilidad de miembros). Para conseguir estos objetivos, es necesario:
- Titular los anestésicos hacia la mínima anestesia residual que permita el examen neurológico pero evite una depresión respiratoria durante el despertar[10]:
- Los hipnóticos deben disminuirse de forma titulada durante el cierre cutáneo hasta una concentración compatible con el retorno de conciencia (agentes inhalatorios <0.2CAM, propofol Ce<1.2-1.9mcg/ml y/o según BIS).
- Suspender los morfínicos de acción prolongada al menos 60min antes de finalizar la operación.
- Control de la ventilación:
- Retorno progresivo de la PaCO2 hacia 40mmHg en caso de hiperventilación
- Reversión completa de BNM, idealmente guiada por TOF, para evitar la relajación residual como causa de hipoventilación y sus efectos deletéreos sobre la PIC, así como el riesgo aumentado de atelectasia y consolidaciones pulmonares que pueden conducir a hipoxia y/o hipercapnia, empeorando el edema cerebral.
- La ventilación debe ser asistida hasta que el paciente mantenga un adecuado volumen-minuto.
- Evitar la tos, el esfuerzo y las arcadas que aumentan la PIC:
- Evitar la asincronía con el respirador.
- Limitar los estímulos nociceptivos: la retirada del cabezal de Mayfield o la aplicación de vendajes puede resultar en movimientos de la cabeza y esfuerzos en el paciente intubado, por lo que el mantenimiento anestésico debe permanecer en un plano adecuado hasta que todos los apósitos estén colocados.
- Evitar que la aspiración de secreciones estimule negativamente al paciente. Debe realizarse con el paciente aún en plano profundo para evitar el aumento de presión en la vía aérea.
- La lidocaína (1-1.5mg/kg IV) favorece una educción más suave. Disminuye la tos a la extubación.
- Profilaxis de NVPO.
- Evitar y/o tratar las crisis hipertensivas:
- El objetivo tras la resección de un TS en un paciente sin HTA crónica o con HTA crónica controlada debe ser mantener una PAS<160mmHg para evitar la hemorragia intracraneal post-craneotomía. En el paciente hipertenso habría que evitar que la PAM excediera en un 20% su valor basal.
- La incidencia de HTA en el despertar de la craneotomía supratentorial oscila entre el 30 y el 35% y puede durar unos 10-25min. Se debe a un aumento de las catecolaminas y del estímulo nociceptivo, por lo que su tratamiento comprende una estrategia combinada con simpaticolíticos y analgésicos.
- La lidocaína (IV o tópica) funciona como antinociceptivo y atenúa la respuesta hemodinámica a la extubación.
- Los picos hipertensivos deben ser tratados rápidamente pero con cuidadosa titulación para evitar la hipotensión que puede conducir a hipoperfusión e isquemia cerebral. Los antihipertensivos más utilizados son betabloqueantes y calcioantagonistas[22].
- El labetalol es el tratamiento de primera línea salvo contraindicación (ej. hiperreactividad bronquial), con una titulación escalonada de 0.2mg/kg IV inicial, seguido de dosis posteriores de 0.4, 0.8 y 1.6mg/kg IV cada 10min con monitorización estrecha. Estas dosis pueden repetirse, sin exceder la dosis máxima acumulada de 300mg. El esmolol es de acción ultracorta y puede administrarse en bolo (0.25-1mg/kg IV) o infusión (0.1-0.25mcg/kg/min IV), y es útil cuando es probable que la HTA se resuelva rápidamente (ej. una vez que el dolor postoperatorio está controlado), pero puede producir HTA de rebote si no se suplementa con un antihipertensivo de acción más larga.
- El nicardipino se puede administrar en bolo (0.5-2mg/ IV) o en infusión (2.5-15mg/h IV), debido a su relativa corta duración.
- Limitar el consumo de oxígeno: a través del adecuado control del dolor y la prevención del temblor postoperatorio, procurando mantener la normotermia.
Tras la evaluación neurológica favorable y la extubación consecuente, se procederá a su traslado a la sala de recuperación o UCIA, procurando aporte de oxígeno suplementario durante el trayecto y bajo monitorización.
Si se produjera un retraso en el despertar no justificado por la farmacología o por la propia cirugía, y, una vez descartadas causas corregibles, debería realizarse una prueba de imagen (TC) para descartar una posible complicación (Fig. 7).
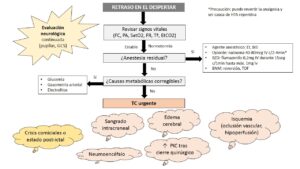
Postoperatorio
Aunque la práctica perioperatoria actual avanza hacia protocolos de recuperación acelerada[23,24], hoy día, la craneotomía sigue siendo motivo de ingreso en una UCIA, al menos las primeras 24h, debido a que estas unidades permiten una monitorización estrecha con exámenes neurológicos seriados (habitualmente horarios) y respuesta rápida a posibles cambios que requieran una intervención inmediata.
Cuidados postoperatorios
- Monitorización de constantes vitales.
- Monitorización neurológica y neuroimagen.
Cuando el paciente esté intubado, el examen neurológico se centrará en la respuesta pupilar y el GCS, así como monitorización de la PIC cuando se requiera.
Si el paciente presenta un déficit neurológico nuevo o no esperado tras el procedimiento neuroquirúrgico, es necesario un TC urgente que descarte complicaciones (hemorragia, edema, hidrocefalia).
En el curso postoperatorio es habitual realizar un TC de control que facilite la transferencia temprana desde la UCIPQ. Sin embargo, la evidencia actual no apoya su realización rutinaria tras la craneotomía electiva en pacientes despiertos, clínicamente asintomáticos, con bajo riesgo de hemorragia postoperatoria y sin necesidad de evaluar masas residuales o el normoposicionamiento de una derivación (Fig. 8)[25].
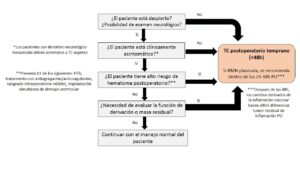
3. Tratamiento del dolor postoperatorio
El dolor post-craneotomía insuficientemente tratado puede conducir a efectos fisiológicos adversos como HTA y aumento del consumo de oxígeno, además de riesgo de cefalea crónica en un número no despreciable de pacientes (17.5-29.3% tras craneotomía supratentorial).
El uso postoperatorio de opioides debe ser titulado a las necesidades del paciente y tras completar su evaluación neurológica, prefiriéndose la analgesia controlada por el paciente (PCA) y las terapias muldimodales.
4. Profilaxis y tratamiento de las NVPO
A pesar del uso de generalizado dexametasona, la incidencia de NVPO tras la craneotomía es elevada y mayor a la esperada según la escala de Apfel, habiéndose estimado en 40-50% en las primeras 24h postoperatorias, especialmente en mujeres, niños >2 años y pacientes que no reciben corticoides, lo que lleva a considerar la craneotomía como procedimiento de alto riesgo de NVPO[26].
5. Profilaxis de enfermedad tromboembólica (ETEV)
Los pacientes sometidos a craneotomía supratentorial están en riesgo aumentado de ETEV por varias razones: presencia de malignidad en muchos casos, larga duración del procedimiento, movilidad reducida o paresia y liberación directa de sustancias procoagulantes como el factor tisular desde el tejido cerebral.
Está indicado el uso de profilaxis mecánica (compresión neumática intermitente, medias de compresión) desde el preoperatorio (o tan pronto como sea posible en cirugía urgente) hasta la deambulación del paciente. Se recomienda añadir heparina de bajo peso molecular (HBPM) en pacientes con riesgo moderado (malignidad, procedimiento prolongado, movilidad reducida) transcurridas al menos 24h tras la cirugía, cuando el riesgo de sangrado se considere bajo y exista evidencia de hemostasia adecuada (normalmente tras la realización de TC)[27].
6. Profilaxis de úlceras de estrés y control de glucemia, dado que estos pacientes están en tratamiento con corticoides.
7. Resto de cuidados similares a pacientes postquirúrgicos de otra especialidad (profilaxis antibiótica, cuidados de herida quirúrgica,…).
Complicaciones postoperatorias
El tamaño del tumor, la localización, la duración del procedimiento, la pérdida de sangre y los fluidos administrados determinan el riesgo de complicaciones postoperatorias.
Las complicaciones tempranas menores son relativamente frecuentes e incluyen NVPO, temblor y alteraciones respiratorias y cardiovasculares. La mayor preocupación deriva del deterioro neurológico debido a edema cerebral o sangrado intracraneal, complicaciones cuyo mayor riesgo es durante las siguientes 4-6h postoperatorias[28].
- Hemorragia: ocurre en el 1% de los casos y representa la complicación más grave. Es más frecuente en tumores metastásicos, y algunos gliomas en el seno de una coagulopatía o como parte de la evolución de un infarto cerebral (puede ser necesaria una RMN ante su sospecha). El tumor residual también puede sangrar. Su riesgo aumenta cuando la PA se mantiene >160mmHg las primeras 24h postoperatorias. Ante una hemorragia postoperatoria debe evaluarse el recuento plaquetario y la coagulación. La PA puede elevarse secundaria a la hemorragia intracraneal y debe ser cuidadosamente controlada empleando antihipertensivos para prevenir mayor hemorragia, sin comprometer la perfusión cerebral al tejido que la rodea. Cualquier hemorragia que cause un significativo compromiso neurológico es indicación de descompresión quirúrgica urgente, a diferencia de los pequeños hematomas paucisintomáticos, que pueden ser manejados de forma conservadora.
- Edema cerebral: el edema postoperatorio se relaciona con la retracción empleada en el intraoperatorio pero también puede ocurrir como consecuencia de la presencia de tumor residual, especialmente el glioblastoma, cuya resección parcial puede conducir al desarrollo de un edema maligno que requiera completar la resección tumoral para su control. Lo más frecuente es que se trate de una respuesta inflamatoria a la manipulación quirúrgica ocurriendo a las 48-72h postoperatorias. En la mayoría de los casos, es autolimitado. En general, el mantenimiento postoperatorio con corticoides a dosis decrecientes durante 4 días (dexametasona 4mg/6h) así como un manejo cauto de los fluidos con monitorización de la natremia puede limitarlo. El edema cerebral puede exacerbarse con el desarrollo de un Síndrome de secreción inadecuada de ADH (SIADH). Una causa menos frecuente y tardía de edema cerebral es el infarto venoso, que ocurre en el abordaje interhemisférico o cirugías que involucren tumores adyacentes a grandes senos venosos. El diagnóstico puede ser difícil y requiere RMN. Incluso si la imagen no es capaz de demostrarlo pero existe alta sospecha clínica, especialmente si hay cambios hemorrágicos en el TC en áreas distales al sitio quirúrgico, el manejo debe consistir en infusiones de manitol, ya que disminuyen la viscosidad sanguínea y mejoran la reología. La anticoagulación está contraindicada en el postoperatorio precoz, pero puede considerarse pronto si hay una trombosis venosa. La oclusión del seno sagital superior puede requerir tratamiento con una ventriculostomía que comunique la hidrocefalia y, en algunos casos, tratamiento endovascular.
- Neumoencéfalo. El neumoencéfalo simple puede causar letargia, confusión, cefalea, náuseas, vómitos y convulsiones y su tratamiento es de soporte, junto con el uso de O2 100%, ya que se piensa que, al reemplazar el oxígeno al nitrógeno del aire atrapado, se acelera la reabsorción gaseosa. Suele resolverse en 1 a 3 días. El neumoencéfalo a tensión es poco frecuente, siendo posibles causas la no suspensión de óxido nitroso antes del cierre de la duramadre o la infección por microorganismos anaerobios, entre otras. La consecuencia es el aumento de la PIC que puede estar asociado con efecto masa. El neumoencéfalo a tensión o sintomático debe ser tratado mediante evacuación quirúrgica urgente.
- Convulsiones: pueden ser de cualquier tipo y resultar del daño quirúrgico directo (irritación cortical), desequilibrios electrolíticos, bajos niveles de anticomiciales o ser la expresión de complicaciones postoperatorias (hemorragia, edema). Si no se resuelven espontáneamente deben tratarse con benzodiacepinas IV y administrar una dosis de carga de anticomicial (levetiracetam 15-20mg/kg IV, fenitoína 15-20mg/kg IV) si el paciente no estaba en tratamiento previo. Además de la protección de la vía aérea, se deberían monitorizar electrolitos y niveles de anticonvulsivantes y realizar un TC craneal para descartar patología quirúrgica tratable.
- Déficit focal transitorio/reaparición de déficits previos: este fenómeno se ha descrito en pacientes con antecedentes de déficit neurológico debido a un ictus, tumor o enfermedad carotidea o, incluso en pacientes sin déficits conocidos, que se han sometido a craneotomías supratentoriales, exacerbándose dicha focalidad tras la educción y mejorando desde los 30min hasta las horas post-extubación. Es más frecuente tras la exéresis de gliomas de alto grado y se cree debido a un efecto anestésico, habiéndose descrito su reversión con flumazenilo[29]. Requiere diagnóstico diferencial con otras causas.
- Alteración de la conducta: los abordajes subfrontales (sobretodo los bilaterales) pueden dar alteración del nivel de conciencia postoperatorio, despertar prolongado y desinhinbición.
- Complicaciones endocrinas: los craneofaringiomas y tumores hipofisarios con extensión supraselar pueden afectar al hipotálamo y producir diabetes insípida, síndrome pierde sal,…las alteraciones del balance hídrico suelen empezar a las 12-24h postoperatorias.
Conclusiones
- Los TS tienen profundas implicaciones en la fisiología cerebral, incluyendo alteraciones en la PIC y la autorregulación.
- Los objetivos del manejo anestésico deben ir encaminados a optimizar la perfusión y oxigenación cerebral, proveer un campo operatorio óptimo que facilite la resección quirúrgica, prevenir el daño cerebral secundario y facilitar una rápida recuperación que permita la evaluación neurológica precoz.
- La inducción debe ser suave, garantizar la estabilidad hemodinámica para evitar alteración de la PPC, evitar el aumento de la PIC y mantener el control ventilatorio para evitar la hipoxia y la hipercania.
- La HTA puede conducir a un aumento de la PIC y mayor riesgo de hemorragia postoperatoria. Suele observarse durante la intubación, la colocación del cabezal de Mayfield, la apertura del cuero cabelludo y duramadre, la manipulación del periostio y la extubación. El anestesiólogo debe anticiparse a los eventos dolorosos a través de la administración preventiva de una combinación de analgésicos y/o antihipertensivos, con el objetivo de lograr la mayor estabilidad hemodinámica.
- La optimización del acceso quirúrgico puede lograrse a través de una serie de medidas encaminadas a disminuir el edema cerebral y la PIC como son la osmoterapia, la hiperventilación, el drenaje venoso y el drenaje de LCR.
- La extubación debe ser suave, evitando la HTA y los esfuerzos abdominales y la tos.
- Cualquier cambio neurológico postoperatorio requerirá la valoración de un TC urgente para descartar posibles complicaciones como hemorragia, edema o hidrocefalia.
- La cirugía mínimamente invasiva y la introducción de técnicas radioquirúrgicas, en auge, están cambiando el manejo de las neoplasias cerebrales.




En las consideraciones NEURO-anestesiológicas de las neoplasias supratentoriales los autores (Rodríguez Contreras R. et al.) del manuscrito (Parte I y II) publicado en la Revista electrónica Anestesiar (ReAR) el 22 agosto del 2022 (parte I) <a href="https://anestesiar.org/2022/anestesia-en-tumores-supratentoriales-parte-i/" rel="ugc">https://anestesiar.org/2022/anestesia-en-tumores-supratentoriales-parte-i/</a> y 29 agosto del 2022 (parte II) <a href="https://anestesiar.org/2022/anestesia-en-tumores-supratentoriales-parte-ii/" rel="ugc">https://anestesiar.org/2022/anestesia-en-tumores-supratentoriales-parte-ii/</a> no describen cuestiones relevantes para un manejo neuroanestesiológico efectivo de dicha neuropatología.
En primer lugar a destacar los errores ortográficos y gramaticales del castellano en el manuscrito. Por otro lado, las cifras decimales se separan con coma (p. ej.: 0,55) y los separadores de millar con punto (55.000).
Mejor craneotomía osteoplástica o cranectomía osteoclástica, que craniotomía o craniectomía. Más adecuado encéfalo (Rombo-, Mesen- y Pros-encéfalo) que cerebro (Telencéfalo); consciencia (pienso luego existo) que conciencia (el alma). Traductor por transductor arterial. Craneotomía con paciente consciente (ser y estar) que craneotomía con paciente despierto (¿coma vigil?). Bloqueantes, no relajantes neuromusculares. Fármacos, no agentes anestésicos. Los anestésicos inhalatorios con flúor se nominan: Isofluorano, Sevofluorano o Desfluorano. Mejor fármacos que drogas vasoactivas. Respecto a la neuroimagenología diagnóstica tan importante es la neuroestructural (TC, RM) como la funcional (TC-funcional, RM-funcional, Tractografía, SPECT, técnicas de neuroimagen multimodales: TC-perfusión, RM-difusión/perfusión) y el estudio neurovascular (angio-DSA-3D, DTC, Angio-TC, Angio-RM). Respecto al vocablo “nuclear” mejor es evitarlo porque la resonancia es un campo magnético.
Hay solapamiento entre hiper- / hipcapmia (PaCO2) e hiper- / hipocapnia (CO2ET). Son semejantes pero no iguales, debido al “gap” existente entre ambos parámetros e incrementado por la temperatura (hipotermia) y la presión barométrica (altitud). Lo correcto es “..-capmia: PaCO2”.
Respecto a consideraciones neuroanatómicas el autor(s) debe considerar: 1) neoplasia supratentorial primaria: a) extra-axial (meningioma, craneofaringioma, y otros), b) intra-axial (glioblastoma, astrocitoma, oligodendroglioma, linfoma y otros), y c) intraventricular (ependimoma). 2) neoplasia supratentorial secundaria: metástasis. Así mismo si se trata de un tumor superficial (bóveda) o profundo (base de cráneo).
A lo largo de las dos partes del manuscrito, no hay mención a la utilización de coadyuvantes (esmolol, clevedipina, landiolol, lidocaína, urapidilo o dexmedetomidina) en el manejo transanestésico. Su coadministración disminuye la dosificación de anestésicos y facilita la educción.
Para monitorización del embolismo venoso aéreo (EAV), aunque la ecocardiografía transesofágica (ETE) es el método más sensitivo para detectar tanto el foramen oval permeable (FOP) como la presencia de aire en cavidades cardiacas, no debe olvidarse el Doppler transcraneal (DTC) con suero fisiológico agitado y maniobra de Valsalva en la detección de FOP. Respecto a la inserción de catéter venoso central (CVC) para aspirar en caso de EAV clínico, el clásico catéter multiluces es inapropiado. En primer lugar porque requiere una ubicación correcta (unión cava superior-aurícula derecha: con ETE o ECG-catéter-intravenoso) en la posición definitiva neuroquirúrgica del paciente, y en segundo, por ser poco eficiente; siendo el más indicado el catéter *multiorificio* de una luz, p. ej.: catéter de Bunegin-Albin o similar [Hanna PG, et al. J Clin Anesth. 1991].
La teoría de Monro-Kellie se refiere a la elastancia del saco dural craneoespinal (curva volumen-presión de Langfitt). La compliancia (curva presión-volumen) no es aplicable en neurofisiología, pero sí en neumología. Otro término a utilizar en aquellas lesiones con efecto masa de crecimiento lento (p. ej. meningioma hemisférico) es el de la capacitancia craneoespinal, que se refiere a que ritmo (tiempo) el sistema puede acomodar un aumento de volumen. [Capacitancia = dPLCR / dt].
La autorregulación del flujo sanguíneo encefálico (FSE), es un fenómeno complejo, donde los factores más considerados son: la presión arterial media (PAM) (flujo regulado por presión o curva de Lassen) y la regulación química (la más destacable la vasorreactividad al CO2 sin olvidar la del O2, la temperatura, la farmacológica y la neurogénica.).
El autor(s) describe la fórmula de la presión de perfusión encefálica (PPE) de forma simplista, olvidándose de una factor relevante como es la resistencia neurovascular (RNV) y parámetros relacionados: vasorreactividad, ley de Hagen-Poiseuille, presión crítica de cierre, compresión o estenosis neurovascular y otros; de ahí que una PPE normal, no equivale siempre a FSE adecuado a las necesidades metabólicas (CMRO2).
Con el cráneo abierto tras la craneotomía y encéfalo relajado, la PIC se aproxima a cero, por tanto se toleran niveles más bajos de PAM en el umbral inferior de la curva de Lassen; de ahí que la hipotensión controlada (leve a moderada, o profunda de corta duración) no produzca neuroisquemia durante una clipaje aneurismático sin incidencias neuroquirúrgicas.
En las lesiones intra-axiales, profundas o de la base craneal, que utilizan un abordaje transencefálico, se requiere maximizar el concepto de separador químico encefálico de Ravussin et al (Ann Fr Anesth Reanim. 1995;14:49-55) para conseguir una relajación encefálica adecuada con el objetivo de minimizar la lesión (isquémica) por las espátulas y/o el retractor automático (Leyla/Yasargill, tubular u otro). No obstante, en la actualidad, cada vez más se adopta el “estilo de microneurocirugía de Helsinky, del profesor Juha Hernesniemi” de no utilizar retractores mecánicos fijos (“retractorless neurosurgery”; “Helsinki concept of slack brain during craniotomy).
En neurofisiología de la barrera hematoencefálica (BHE) es más apropiado hablar de osmolalidad (mOsm/kg) que de osmolaridad (mOsm/L) plasmática. El suero salino 0,9% tiene una osmolaridad teórica (in vitro) de 308 mOsm/L de H2O, pero la osmolalidad medida (in vivo) es de 285 mOsm/kg de H2O, es decir hipotónico respecto al plasma. Además, presenta una diferencia de iones fuertes (SID) distinta a la del plasma (NaCl 0,9%: 0 mEq/L; frente a 40 mEq/L el plasma), lo que ocasiona acidosis hiperclorémica.
En la relajación encefálica adecuada, el autor(s) se olvida de la salida del LCR cisternal tras la duratomía, y en la osmoterapia del Lactato de sodio 0,5 molar (LSH 0,5 M), además de sus potenciales efectos beneficiosos ante el fallo energético (concepto de lanzadera del lactato intra- y extracelular, introducido por Brooks G.A. en fisiología; y posteriormente en neurofisiología por Pellerin L y Magistretti PJ). Más aún el autor(s) debe citar los nuevos osmodiuréticos, p. ej.: el piruvato sódico hipertónico al 15% (Saha B, et al. Front Neurol. 2022;13:938076).
La indicación de la osmoterapia es más apropiada en tumores intra-axiales o en los supratentoriales de la base craneal. En cambio es muy controvertida en los extra-axiales con ubicación en la bóveda craneal. Un ejemplo típico es el meningioma de gran volumen extra-axial y hemisférico, donde el concepto de capacitancia hace que la elastancia (curva de Langfitt) no esté elevada, de ahí que la tras la duratomía con salida de LCR (cisternal /cisural) debe ser suficiente para un encéfalo relajado.
Respecto a los niveles de Hb en neurocríticos: el autor(s) refiere valores demasiado bajos (…mantener el nivel de Hb≥7-8g/dL), ya que las recomendaciones más aceptadas son Hb alrededor de 10 gr/dL, para evitar la hipoxia encefálica por baja extracción o extractibilidad (clasificación de Siggaard-Andersen), más aún en “Watershed areas”.
En la actualidad el plano (neuro)anestésico debe ser guiado tanto por monitorización de la hipnosis mediante espectrograma-EEG (BIS, Entropía o similar) como por la nocicepción (qNOX-EEG, SPI: Surgical Plethysmographic Index, ANI: Analgesia Nociception Index, o similares). Hay que considerar el efecto de la efedrina, atropina o fenilefrina sobre el ANI para evitar errores. Si el sensor en el cuero cabelludo interfiere con la herida neuroquirúrgica; hay otras ubicaciones craneales (infraorbitaria, occipital, mandibular, auricular, y otras) no tan exactas pero si precisas (tendencia) [Puente Barbas JA. et al. Sanidad mil. 2018].
En cuanto a la monitorización neurofisiológica intraoperatoria multimodal (MNIM) el autor(s) debe ser más preciso. El bloqueante neuromuscular (BNM) no despolarizante puede utilizarse en la MNIM tipo: somatosensoriales (PESS), troncoencefálicos (PEAT), electrococleografía (ECoG), visuales (PEV) y electrorretinograma (ERG) multifocal; más aún, facilita su registro. Respecto a los potenciales evocados motores por estimulación transcraneal (PEMTc), puede haber interferencia en caso del registro miogénico (Onda M), p.ej.: pacientes con neuro/miopatía; pero no en el medular (onda D), ni tampoco en los PEM tras estimulación cortical directa (PEMCd). Así mimo el BNM es compatible con la electromiografía evocada (p. ej. estimulación de tornillos pediculares, estimulación directa del VII par, etc.). Por otro lado, si hay dudas en el registro de PEMTc, la reversión intraoperatoria del BNM aminoesteroideo con sugammadex es una opción útil a considerar (falso positivo). [Aldana E, et al. Rev Esp Anestesiol Reanim. 2021]. [Errando CL, et al. Rev Esp Anestesiol Reanim 2016].
En relación a la administración de fármacos vasopresores, el autor(s) relata…” Hay que tener en cuenta que el uso de vasopresores conlleva riesgo de reducción en la oxigenación cerebral””””” pero la cita referida ([Thorup L, et al. J Neurosurg Anesthesiol. 2020;32(1):18-28] solamente lo describe con la fenilefrina y en pacientes con neurotrauma grave, pero no en patología tumoral.
La utilización de la dexmedetomidina (Dex) en neuro (anestesiología y -intensivismo) es controvertida por su efecto pro-convulsivante al descender el umbral epiléptico (Benatar-Haserfaty J et al. Rev Esp Anestesiol Reanim. 2013), y por incrementar la neuroisquemia al descender el flujo sanguíneo encefálico; aunque de momento no se han descrito complicaciones asociadas en pacientes (neuro)críticos. Los efectos sobre el FSE y CMRO2 encefálicos son dispares entre los diferentes estudios (animal, dosis, etc.). Estudios recientes reportaron que la dexmedetomidina presenta efecto neuroprotector /neurorrestaurador y es segura en neuroanestesiología para craneotomía supratentorial (tumores, HSAa coiling, MAV excisión/breakthrought), craneotomía consciente (epilepsia, lesión para-elocuente, electrodos), endarterectomía /stenting carotídeo, bypass arteria temporal superficial-media cerebral y procedimientos de neurorradiología intervencionista. [Farag E et al. Ochsner J. 2011]
En situaciones de vasoespasmo cerebral post HSAa, la Dex no incrementó su incidencia ni gradación; tanto en estudios ad hoc objetivos (cuantitativos) de vasoespamo (DSA, CTA/CTP, CTA-MMBE), u otros (DTC, PtiO2). [Ren C, et al. Front Pharmacol. 2019].
En cuanto a la cirugía de la epilepsia, la Dex ha sido utilizada con éxito, predominando los efectos anti- sobre los pro-convulsivantes. Por otro lado los anticomiciales (fenitoína y carbamazepina) al provocar inducción enzimática de la P450, incrementan el aclaramiento de la Dex, por lo que dosis más altas son requeridas para mantener los niveles deseados [Lin N, et al. J Neurosurg Anesthesiol. 2019].
En situación con PIC elevada, el efecto de la Dex sobre el subtipo α2C responsable sobre todo de la vasoconstricción venosa, conlleva a una adicional disminución de la PIC a la ya realizada por subtipos α2A/D y α2B y por el acoplamiento del flujo al metabolismo encefálico. [Lee S. Korean J Anesthesiol. 2019].
En el manuscrito el autor(s) además de la neuronavegación, el ecógrafo (ultrasound navigation) y la RM (estructural / funcional) en el intraoperatorio; se olvida de técnicas muy relevantes con implicaciones neuroanestésicas (p. ej. ácido 5-aminolevulínico o ácido 5-ALA). (Benito Naverac, H. Revista Electrónica AnestesiaR, 2020;10(7):3]. La resección tumoral guiada por fármacos fluorescentes como el radionúclido Tecnecio (99mTc) [Sestamibi™], la fluoresceína sódica (FS) y el ácido 5-ALA, son técnicas neuroquirúrgicas muy eficientes, para para maximizar el grado de resección tumoral y minimizar la cantidad de tejido sano a remover, con un aumento del tiempo de sobrevivencia. [Gil-Salú JL, et al. Neurocirugia (Astur). 2013;24(4):163-169]. Se trata del concepto de “quirófano híbrido”, donde los avances técnicos deben emplearse de forma selectiva y no de rutina, ya que no debe confundirse la dificultad quirúrgica con el riesgo neuroquirúrgico.
Respecto a la educción anestésica, igualmente que la inducción/mantenimiento, debe ser guiada por el plano hipnótico (espectrograma-EEG) y el nociceptivo (qNOX, SPI, ANI, similar). Por otro lado, en el paciente intubado, la escala del coma de Glasgow (GCS) no es adecuada; ya que la respuesta verbal no se valora. Más adecuada es la escala FOUR (Full Outline of UnResponsiveness) [Wijdicks EF, et al. Ann Neurol. 2005;58(4):585-93]. Respecto a la estrategia de extubación requiere un abordaje escalonado con aplicación de la guía clínica de extubación de la DAS (Difficult Airway Society Guidelines) [Popat M, et al. Anaesthesia. 2012].
En cuanto al postoperatorio precoz, lo que se vigilan y monitorizan son la signos vitales (no las constantes, pues no son una constante, sino variable) del paciente. Respecto a las crisis comiciales, tanto clínicas como subclínicas (tsunamis eléctricos), deben vigilarse (p. ej.: EEG cuantitativo: disociación electro-clínica) y realizar profilaxis versus terapia específica. Entre los anticomiciales nombrar: Brivaracetam, Lacosamida y Fosfenitoína.
El dolor postoperatorio precoz también debe monitorizarse de forma objetiva (ANI, SPI o similar) para evaluar y ajustar la necesidad de analgesia; y por tanto, el grado de confort del paciente. En la emesis del postoperatorio, no debe olvidarse el rol de la dexametasona (además de su efecto en el edema vasogénico).
Estimado revisor, los autores queríamos agradecerle el tiempo invertido y su exhaustividad en la revisión de nuestro artículo. Creemos que sus aportaciones contribuyen a mejorarlo. Queríamos aclarar que nuestro artículo está orientado a anestesiólogos no especializados y que tienen a su disposición solo los medios técnicos ampliamente accesibles. Esto, junto a las limitaciones de extensión, ha evitado que incorporemos algunas de sus pertinentes sugerencias.