Rodríguez Contreras R; Vega Salvador A; Reche Navarro E; Estévez Santiago J.
Facultativo Especialista de Área. Servicio de Anestesiología y Reanimación. Hospital Universitario Torrecárdenas, Almería.
Cómo citar este artículo: Rodríguez Contreras, R., Vega Salvador, A., Reche Navarro, E., & Estévez Santiago, J. (2023). Anestesia en tumores supratentoriales. Revista Electrónica AnestesiaR, 15(5). https://doi.org/10.30445/rear.v15i5.1145
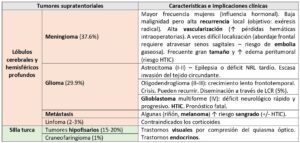
Aunque los tumores primarios del sistema nervioso central (SNC) suponen solo el 2% de las neoplasias en adultos, son una importante causa de discapacidad y mortalidad, en comparación con otros cánceres[1]. Los TS representan la mayor parte de estos tumores (≥80%) en adultos, siendo los meningiomas (37.6%) y los gliomas (30%) los más frecuentes[2].
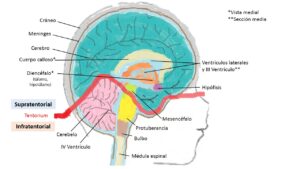
Los TS son aquellos que se localizan por encima de la tienda del cerebelo, pudiendo afectar a hemisferios cerebrales, ganglios basales, tálamo, hipotálamo, ventrículos laterales y cuerpo calloso (Fig. 1). Los lóbulos frontal, temporal y parietal las localizaciones más frecuentes.
Sólo un tercio de los tumores primarios son malignos. No obstante, la frecuencia del tipo de tumor y el grado varía según la edad. En adultos jóvenes son frecuentes los gliomas de bajo grado y, a partir de los 30-40 años, aumenta la incidencia de metástasis. Entre los cánceres que metastatizan al SNC con mayor frecuencia, se encuentran pulmón, mama, riñón, colon, tiroides y melanoma.
La Organización Mundial de la Salud (OMS) clasifica los tumores cerebrales en cuatro grados (I-IV), en orden ascendente de agresividad, representando los de grado IV (glioblastoma multiforme) mayor destrucción tisular, necrosis y edema asociado, a diferencia de los tumores de bajo grado (I-II) que se asocian a efectos secundarios neurológicos mínimos[3]. Cabe señalar que, incluso los tumores histológicamente benignos, pueden tener un comportamiento maligno debido a su localización o invasión local.
El conocimiento del tipo tumoral y el grado es importante, ya que determinarán el manejo quirúrgico y complicaciones potenciales (Tabla 1).
Los tumores cerebrales pueden producir síntomas por invasión cerebral local, compresión de estructuras adyacentes y aumento de la presión intracraneal (PIC).
Las masas supratentoriales se suelen manifestar con cefalea, convulsiones o déficits neurológicos (alteración sensitivo-motora, afasia, alteración visual,…), acompañados o no de signos propios de aumento de la PIC.
La mayoría de estos tumores se diagnostican a través de una prueba de neuroimagen –normalmente una resonancia magnética nuclear (RMN) con contraste, tras la aparición de síntomas. La RMN revelará una masa, frecuentemente rodeada de un halo de edema vasogénico. La tomografía computarizada (TC) quedará habitualmente relegada a entornos de emergencias, a la necesidad de una vista detallada de las estructuras óseas y en los casos en los que la RMN esté contraindicada.
Las opciones de tratamiento incluyen la resección quirúrgica, la radioterapia, la quimioterapia o la combinación de ambas.
La cirugía suele indicarse para el diagnóstico, la exéresis o la reducción de la masa tumoral para el manejo sintomático y de la PIC. El objetivo debe ser eliminar la máxima cantidad tumoral sin producir déficit neurológico. Los avances recientes en neurocirugía, con el auge de cirugías cada vez menos invasivas (craneotomías menores, intervenciones estereotácticas, procedimientos endoscópicos) y el empleo de técnicas como la RMN intraoperatoria, han aumentado la precisión de la cirugía y minimizado el trauma tisular, permitiendo una duración más corta de los procedimientos y una recuperación más rápida con un alta hospitalaria más precoz. La biopsia y la cirugía en escenarios seleccionados se ha comenzado a realizar de forma ambulatoria en algunos centros[4].
Consideraciones fisiopatológicas durante la resección de tumores supratentoriales
El manejo de los TS requiere comprender los mecanismos fisiopatológicos que subyacen a la regulación y el control de la presión de perfusión cerebral (PPC) y a la PIC y el impacto que sobre ellas tienen las diversas intervenciones anestésicas (fármacos, ventilación…).
La región supratentorial está delimitada inferiormente por el tentorium y superiormente por la duramadre y el hueso, creando un sistema rígido no compliante que alberga un volumen fijo en su interior (cerebro 85%, LCR 10%, sangre 5%), cuyo equilibrio dinámico determina la PIC. Según la teoría de Monro-Kellie, un aumento en el volumen de un componente o la presencia de componentes patológicos (tumor, edema) generará una disminución recíproca de volumen en los otros componentes para mantener el volumen total intracraneal constante. Cuando una masa supratentorial se expande de forma progresiva dentro de este espacio, inicialmente se activarán mecanismos compensatorios para disminuir el efecto en la PIC, como son la reducción en el volumen de sangre intracraneal, la redistribución del LCR hacia el conducto raquídeo y el aumento en la reabsorción de éste. Sin embargo, conforme la masa crece estos mecanismos se agotan, de forma que pequeños aumentos volumen se traducirán en aumentos significativos de la PIC, con el potencial riesgo de herniación e isquemia cerebral focal o global por compromiso de la PPC[5]. La localización, el tamaño y el tipo de tumor van a ser determinantes de la capacidad cerebral de compensación, de forma que aquellos cambios que ocurren lentamente producirán menos efecto que aquellos otros que ocurren de forma muy aguda. Este es el motivo por el que pacientes con grandes meningiomas pueden presentar una PIC normal o mínimamente elevada, mientras que gliomas de alto grado, con crecimiento muy rápido y rodeados de intenso edema vasogénico, o aquellos tumores que presenten un pequeño sangrado de forma aguda, pueden generar elevaciones sintomáticas de la PIC. La mayoría de los TS no son descubiertos hasta que son sintomáticos y los mecanismos compensatorios suelen estar comprometidos.
La PPC es el resultado de restarle la PIC (o la presión venosa central –PVC- si su valor es superior) a la presión arterial media (PAM):
PPC = PAM – PIC (ó PVC si PVC > PIC)
El aumento significativo de la PAM en respuesta a una PIC aumentada para tratar de mantener la PPC da origen al síndrome de Cushing, propio de la HTIC, y caracterizado por hipertensión arterial (HTA), bradicardia refleja y un patrón respiratorio irregular por compresión del tronco encefálico. Representa una urgencia neuroquirúrgica. La mayoría de las estrategias desarrolladas en el manejo anestésico de los TS giran en torno a la preservación de la PPC a través del mantenimiento de la estabilidad hemodinámica y del control de la PIC. Tanto la HTA como la hipotensión repercuten de forma negativa en el flujo sanguíneo cerebral (FSC) y la PIC. La primera puede provocar aumento de la PIC, edema cerebral o hemorragia (especialmente cuando los mecanismos de autorregulación están comprometidos), mientras que la segunda puede provocar isquemia cerebral por disminución de la PPC (especialmente en el seno de una PIC elevada).
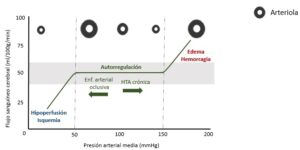
El FSC se mantiene estable en torno a 50ml/100g/min, en un amplio rango de PAM (50-150mmHg), gracias a la autorregulación cerebral, un mecanismo de protección por el cual, cambios en las resistencias a nivel arteriolar (vasoconstricción si PAM aumenta, vasodilatación si PAM disminuye), son capaces de mantener el FSC constante, independientemente de los cambios en la PA y la PPC. Aunque el FSC suponga una pequeña fracción del contenido intracraneal, puede compensar aumentos agudos de la PIC. Cuando la autorregulación está intacta, la perfusión tisular descenderá sólo si la PAM cae por debajo de 50mmHg, derivando en riesgo de isquemia cerebral cuando el FSC descienda por debajo de 20ml/100g/min, a menos que se reestablezca la PPC (aumento de PAM y/o disminución de PIC) o se reduzca el consumo metabólico cerebral (CMR). Fuera del rango de autorregulación, el cerebro es incapaz de compensar los cambios en la PPC y el FSC aumentará o disminuirá con los correspondientes cambios en la PA. Existe un acoplamiento estrecho entre el suministro de sangre y el metabolismo neuronal, por lo que, en situaciones de isquemia, el daño neural dependerá de la duración de dicha isquemia y el CMR.
Los límites de autorregulación se ven alterados en determinadas circunstancias. La HTA crónica produce un remodelado arteriolar, reduciendo la reactividad miogénica y la respuesta endotelial a moléculas vasoactivas, lo que desplaza la curva hacia la derecha, presentando mayor riesgo de isquemia durante la hipotensión intraoperatoria (Fig. 2). Por el contrario, en aquellos pacientes con enfermedad arterial oclusiva, la curva se desplazará hacia la izquierda debido a la reducción crónica de la presión de perfusión. Además de estos factores del paciente, el propio tumor (especialmente en el caso de grandes TS) altera la barrera hematoencefálica (BHE) por inflamación, estrés oxidativo y moléculas vasoactivas circulantes, perdiéndose la respuesta de autorregulación y a la PaCO2, existiendo riesgo de isquemia si la PAM se reduce y limitando el efecto terapéutico de las maniobras para reducir la PIC como la hiperventilación[6].
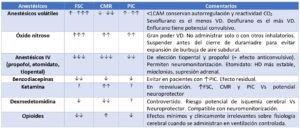
Existen múltiples factores que afectan a la autorregulación a través de la modificación resistencia cerebrovascular: la presión arterial de oxígeno (PaO2), la presión arterial de dióxido de carbono (PaCO2), la presión arterial sistémica (PA), la viscosidad sanguínea, el CMR, la PIC y determinados anestésicos. El anestesiólogo que se enfrenta a una craneotomía supratentorial debe conocer en qué medida afectan estos factores al FSC, así como las posibles armas terapéuticas para disminuir la PIC. De todos ellos, el CO2 es el vasodilatador cerebral más potente, con un tiempo de respuesta que varía entre 0.5 y 3 minutos, por lo que cambios muy abruptos de PaCO2 aumentarán de forma transitoria el FSC. La hipercapnia produce vasodilatación, mientras que la hipocapnia produce vasoconstricción. En cuanto a los anestésicos, con pocas excepciones (ketamina, N2O), disminuyen el CMR, con efecto variable en el FSC. Los anestésicos intravenosos (IV) causan una disminución dosis-dependiente del FSC, que es proporcional a su CMR, manteniendo intacta la autorregulación y la reactividad cerebrovascular a la PaCO2. Los anestésicos inhalatorios son vasodilatadores cerebrales, disminuyendo la CMR pero, a dosis inferior a 1 concentración alveolar mínima (CAM), el acoplamiento entre el FSC y el CMR, así como la reactividad a la PaCO2, se mantienen y, por tanto, sus efectos vasodilatadores pueden mitigarse en cierta medida con la hiperventilación. El uso de dexmedetomidina en neurocirugía es controvertido, dado que produce vasoconstricción cerebral dosis-dependiente, suponiendo un riesgo teórico potencial en pacientes con isquemia cerebral regional o compromiso del FSC [7] (Tabla 2).
Cuando la BHE está intacta, el flujo de los fluidos a través de ella está determinado por la osmolaridad, produciéndose un intercambio de agua entre la sangre y el compartimento cerebral que permite el empleo de diuréticos y terapia osmótica para tratar el edema intersticial. Pero, cuando la BHE se daña, la transferencia de agua a través de la misma se hace dependiente de un gradiente de presión hidrostático y ya, no solo no es efectiva la terapia osmótica, sino que es contraproducente.
Por otro lado, el sistema venoso cumple un papel crucial en el mantenimiento de una PIC normal. El aumento de la resistencia al drenaje venoso (fluidoterapia intensiva, presiones intratorácica-intraabdominal elevadas, obstrucción venosa posicional) aumentará la PIC. Por lo tanto, el uso de líquidos intravenosos para “mantener la PPC” puede aumentar la PVC y empeorar la PIC e, irónicamente, la PPC.
Asimismo, el estasis intracraneal de LCR causado por obstrucción en su circulación o reabsorción puede conducir a hidrocefalia y aumento de PIC. La colocación preoperatoria de un catéter ventricular externo o lumbar (teniendo éste riesgo aumentado de herniación cerebral) permite el drenaje de LCR con el rápido alivio de dicha presión.
Durante la craneotomía de TS es importante aplicar técnicas de protección cerebral que prevengan o disminuyan lesiones cerebrales isquémicas secundarias a:
- Daño cerebral directo: derivado de un aumento en la PIC (desplazamiento de línea media, desgarro de vasos cerebrales, herniación), excesiva retracción quirúrgica, inflamación y sangrado (epilepsia, vasoespasmo,…).
- Cambios hemodinámicos: resultantes de hipercapnia, hipoxemia, fluctuaciones en la PA, alteraciones en el balance hidroelectrolítico (hipoosmolaridad, hiperosmolaridad), alteraciones de la glucemia, hipertermia, fallo cardiaco.
La puesta en marcha de medidas neuroprotectoras que optimicen la PPC, la PIC y el FSC y garanticen, de esta forma, el mantenimiento de un suministro continuo de oxígeno y energía que supla las necesidades metabólicas neuronales, es esencial en estos pacientes para prevenir la lesión cerebral secundaria.
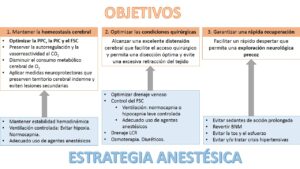
Teniendo presentes todas estas consideraciones, el manejo anestésico comprende tres objetivos fundamentales desde el punto de vista fisiopatogénico[8](Fig. 3):
Evaluación preoperatoria para la resección de tumores supratentoriales
Una vez establecida la indicación quirúrgica, el siguiente paso será la valoración preoperatoria reglada, salvo para aquellos casos que requieran intervención urgente por riesgo inminente de herniación y en los cuales será necesario aplicar medidas transitorias de control de la PIC hasta la realización de la misma.
La valoración preanestésica del paciente neuroquirúrgico es idéntica a la de cualquier cirugía mayor, pero con las siguientes consideraciones[9]:
- Historia clínica y exploración física:
- Evaluación neurológica: se debe prestar especial atención a cualquier condición preexistente (ictus, epilepsia, déficit neurológico previo,…) que pueda interferir con el curso operatorio, así como realizar una evaluación exhaustiva del estado neurológico actual con especial énfasis en la presencia de signos de HTIC. El nivel de conciencia deprimido y/o la alteración del reflejo de tos o nauseoso aumenta el riesgo de broncoaspiración.
- Evaluación de la vía aérea: el rango de movimiento de cabeza y cuello puede afectar tanto a la intubación como al posicionamiento y colocación del arco de Mayfield. Es fundamental la anticipación a una vía aérea difícil (VAD) por las implicaciones negativas que tienen la hipoxia e hipercapnia en estos pacientes.
- Evaluación cardiopulmonar y renal: es esencial debido a los grandes cambios de fluidos que se producen por la diuresis osmótica y la hemorragia, el riesgo de embolia gaseosa y la disautonomía por manipulación quirúrgica. Las arritmias o la HTA mal controlada serán objeto de optimización, ya que la inestabilidad hemodinámica durante el curso de una craneotomía ensombrece el pronóstico neurológico. La comorbilidad respiratoria (EPOC, asma) interfiere con la ventilación y puede conducir a un aumento del edema cerebral.
- Medicación preoperatoria: normalmente se mantendrá, a excepción de los fármacos que alteren la hemostasia.
- Glucocorticoides: habitualmente estos pacientes están en tratamiento con dexametasona para disminuir el edema peritumoral. Como excepción, se evitan cuando exista alta sospecha de linfoma, ya que causan lisis de los linfocitos y disminuye el rendimiento diagnóstico de la biopsia.
- Anticomiciales: los pacientes que toman esta medicación deben continuarla en el periodo perioperatorio para prevenir crisis. Estos medicamentos pueden afectar el metabolismo de una gran variedad de fármacos empleados durante la anestesia, especialmente relajantes musculares.
- Pruebas complementarias:
- Pruebas de neuroimagen (RMN, TAC): muestran la ubicación y el tamaño del tumor, la existencia de edema o hidrocefalia, la proximidad de los senos venosos y signos de aumento de PIC. Puede dar una idea del riesgo de hemorragia y embolia gaseosa (más frecuente en tumores que invaden el seno sagital superior, habitualmente meningiomas).
- Estudio de extensión: cuando se sospeche enfermedad metastásica.
- Ecocardiograma: que descarte comunicaciones intracardiacas en situaciones con alto riesgo de embolia gaseosa (posición sentada, proximidad del tumor a grandes senos venosos). En aquellos pacientes con hipertensión pulmonar o disfunción ventricular derecha incluso pequeñas cantidades de aire intravenoso pueden descompensarlos. En cirugía emergente, estaría indicada la realización de un ecocardiograma transesofágico (ETE) tras la inducción anestésica en aquellos casos de alto riesgo.
- Glucemia y estado hidroelectrolítico: es frecuente la hiperglucemia secundaria a la terapia corticoidea y los trastornos hidroelectrolíticos secundarios al uso de diuréticos y a trastornos neuroendocrinos, más frecuentes en lesiones alrededor del hipotálamo.
- Hemograma, estudio de coagulación y reserva de hemoderivados: se debe detectar y tratar la anemia perioperatoria debido al potencial riesgo de sangrado intraoperatorio, que puede preverse con la localización, el tipo y el tamaño de la masa. Los meningiomas suelen ser de gran tamaño, muy vascularizados y, a veces, en difícil localización con necesidad de atravesar senos venosos. En general, con dos unidades de sangre cruzada suele ser suficiente para la mayoría de las craneotomías, pero la exéresis de grandes meningiomas puede estar asociada a una pérdida hemática significativamente mayor (4-6 unidades) que puede reducirse, en algunos casos, con la embolización tumoral preoperatoria.
Manejo transanestésico
Antes de comenzar, se debe realizar una exploración neurológica básica para identificar cualquier empeoramiento de los signos y síntomas informados en el preoperatorio.
El procedimiento operatorio planeado, incluyendo el abordaje quirúrgico, la posición del paciente, el uso de monitorización neurofisiológica intraoperatoria y cualquier dificultad anticipada debe ser discutida con el neurocirujano previo a la cirugía.
1. Premedicación
- Ansiólisis: se deben evitar los sedantes (benzodiacepinas, narcóticos), especialmente en pacientes con HTIC, ya que la hipercapnia secundaria a la depresión respiratoria puede elevar la PIC. En caso de pacientes con alto grado de ansiedad y TS pequeños sin elevación de PIC podría considerarse su uso, titulando la dosis, bajo monitorización estrecha, y en un entorno que permita el manejo inmediato de la vía aérea. Además, las benzodiacepinas pueden desenmascarar déficits neurológicos y exacerbar el delirio postoperatorio, especialmente en ancianos.
- Corticoterapia: en caso de tratamiento crónico, se debe considerar una dosis de estrés prequirúrgica antes de la inducción.
- Tratamiento anticomicial: los pacientes bajo esta medicación deben tomar su dosis habitual el día de la cirugía. Sin embargo, en pacientes sin historia de convulsiones, la evidencia del uso profiláctico de estos fármacos es controvertida. La incidencia de crisis epilépticas después de una craneotomía supratentorial es del 15-20%, siendo más frecuentes durante el primer mes postoperatorio, y pudiendo precipitar el desarrollo de epilepsia[10]. Las lesiones con mayor riesgo convulsivo son los gliomas en región fronto-temporal o insular. El levetiracetam (500-1000mg IV) es el fármaco más usado en este contexto, administrado habitualmente antes de la incisión.
- Profilaxis antibiótica: está recomendada en la craneotomía la administración de una dosis de cefazolina en la inducción, siendo la clindamicina y la vancomicina las alternativas en pacientes alérgicos.
2. Monitorización
Además de la monitorización estándar según la ASA, la monitorización habitual para la resección de un TS incluye:
- Cateterización arterial: permite un estricto control de la PA y facilita las muestras gasométricas, necesarias para evaluar la correcta ventilación y el estado hidroelectrolítico. Su canalización se prefiere antes de la inducción en pacientes con gran efecto masa o importante comorbilidad para monitorizar mejor los cambios hemodinámicos. El traductor debe colocarse idealmente a nivel del conducto auditivo externo para facilitar el cálculo de la PPC.
- Sondaje vesical: para medición del débito urinario, indicado por la duración de la cirugía y el uso intraoperatorio de diuréticos.
- Temperatura: la hipotermia reduce el CMR y el daño cerebral isquémico, considerándose una medida neuroprotectora pero, incluso mínimos grados de hipotermia, disminuyen la función plaquetaria y alteran la coagulación. Por otro lado, no se ha encontrado evidencia de que la hipotermia reduzca la mortalidad o la discapacidad neurológica[11], por lo que se aboga por el mantenimiento de la normotermia, siendo frecuente el uso de mantas de calentamiento por aire forzado para lograr este objetivo durante la cirugía. Se debe evitar la hipertermia
- Monitorización de la función neuromuscular: en caso de emplearla, debería realizarse en la extremidad no parética si existiera déficit motor, dado que la extremidad paralizada suele ser resistente a los estímulos eléctricos.
- Monitorización del embolismo venoso gaseoso: en caso de alto riesgo, es necesaria la monitorización con EtCO2, Doppler precordial, ETE y la colocación de un catéter venoso central (CVC) para aspirar en caso necesario.
- Monitoreo neurofisiológico: la resección quirúrgica próxima a áreas elocuentes o en la cercanía a vasos importantes que se deban respetar, puede requerir mapeo electrofisiológico para una localización y disección más precisas que logre la resección completa o casi completa sin dañar tejidos circundantes sanos. Las respuestas evocadas se ven más afectadas, de forma dosis-dependiente, por los anestésicos volátiles y el óxido nitroso que por los anestésicos iv, siendo los potenciales evocados motores (PEM) los más sensibles a este efecto. El nivel de anestesia debe mantenerse constante durante los periodos de monitorización crítica para evitar la confusión a la hora de interpretar los cambios. Los bloqueantes neuromusculares (BNM) afectan al electromiograma (EMG) y al registro de los PEM, por lo que deben ser evitados durante su monitorización. En caso de ser necesarios, el grado de bloqueo neuromuscular debe ser monitorizado con el objetivo de lograr un nivel constante de bloqueo de 2/4 en el Tren de cuarto (TOF).
- Monitorización de la PIC: no se suele monitorizar para la inducción. Una vez hecha la craniectomía, la visualización del campo quirúrgico ofrece una idea de cuál es su situación. En caso de que el paciente porte un drenaje ventricular externo (DVE) se podría utilizar para drenar LCR y monitorizar la PIC. Los drenajes lumbares que pueden colocarse antes de una gran resección tumoral para mejorar las condiciones quirúrgicas, son menos precisos en la medición de la PIC.
- Monitorización de la profundidad anestésica: mediante el uso de electroencefalograma (EEG) procesado. Permite guiar la dosis anestésica y facilitar una rápida educción. No obstante, a veces la obtención de este registro (colocación del sensor a nivel frontal) puede interferir con el área quirúrgica.
- En función de las características del paciente y la cirugía, puede ser necesaria la monitorización de la saturación de oxígeno del bulbo de la yugular, el doppler transcraneal (puede determinar la idoneidad del FSC, la respuesta al CO2 y la autorregulación en algunos pacientes de alto riesgo, aunque rara vez se hace uso intraoperatorio por su dificultad de colocación), la oximetría cerebral, la saturación venosa mixta o el gasto cardiaco.
3. Accesos vasculares
La mayoría de craneotomías supratentoriales son llevadas a cabo con dos catéteres iv de grueso calibre. Si el tumor está muy vascularizado, se debe comprobar la disponibilidad de varias unidades de sangre cruzada, un sistema de infusión rápida y calentador de fluidos.
El CVC se emplea en los casos con alto riesgo de sangrado, embolismo aéreo y/o previsión de uso de drogas vasoactivas. Son de elección los CVC de inserción periférica o vía subclavia o femoral, ya que el acceso yugular podría interferir con el drenaje venoso encefálico (posición en Trendelenburg y rotación cervical), aunque este efecto podría limitarse con el uso de la ecografía.
4. Inducción
La inducción debe ser suave y perseguir los siguientes objetivos:
- Estabilidad hemodinámica, mediante una selección adecuada de fármaco y dosis para mantener la PPC y evitar la respuesta hipertensora de la laringoscopia.
- Evitar el aumento de la PIC, mediante el control de la medicación, la oxigenación, la ventilación y la posición de la cabeza.
La inducción será IV de elección. La selección del agente inductor dependerá de la estabilidad hemodinámica, siendo de elección el propofol (1.25-2.5mg/kg IV) o el tiopental (3-6mg/kg IV), administrados lentamente para no hipotensar en exceso al paciente. Aunque el etomidato mantiene una hemodinámica más estable, puede causar mioclonías, suprime la síntesis adrenal y presenta una alta tasa de náuseas y vómitos postoperatorios (NVPO). La ketamina aumenta el CMR aunque sus efectos sobre la fisiología cerebral son contradictorios en la literatura[12] por lo que, ante la incertidumbre, se recomienda usar con precaución en la craneotomía, especialmente en pacientes con HTIC. Las benzodiacepinas se evitan por su mayor vida media (retraso en el despertar).
Los opioides causan mínimo efecto sobre la dinámica cerebral. Se suele administrar fentanilo 2-3mcg/kg antes de la inducción, para reducir la dosis de inductor, suprimir los reflejos de la vía aérea y atenuar la respuesta hipertensiva a la laringoscopia.
Los BNM se emplean tras la inducción para facilitar la intubación (IOT) y evitar esfuerzos abdominales y tos que puedan aumentar la PIC. La succinilcolina produce un aumento transitorio del FSC, el CMR y la PIC debido a las fasciculaciones y la HTA. Aunque este efecto es de muy corta duración y podría ser atenuado con hiperventilación o precurarización (rocuronio 2mg IV, cisatracurio 1.5mg IV), se prefiere el uso de BNM no despolarizantes (habitualmente cisatracurio 0.15mg/kg IV o rocuronio 0.6mg/kg IV) ya que éstos no tienen efectos sobre la hemodinámica cerebral, con excepción de aquellos liberadores de histamina (atracurio, mivacurio), que podrían causar hipotensión arterial y vasodilatación cerebral con efectos deletéreos sobre la PPC y la PIC. No obstante, la succinilcolina deberá usarse cuando esté clínicamente indicada (VAD, inducción de secuencia rápida), al ser prioritario asegurar la vía aérea para evitar la hipoxia y la hipercapnia. La alternativa puede ser el uso de rocuronio a dosis de 1-1.2mg/kg IV. Algunos antiepilépticos (fenitoína, carbamacepina) interaccionan con el rocuronio y el vecuronio, generando cierta resistencia a la relajación su administración crónica y la potenciación de su efecto la administración aguda. Idealmente se debería comprobar la relajación muscular completa con estimulador de nervio periférico antes de proceder a la laringoscopia.
El control ventilatorio con mascarilla facial previo a la IOT es crucial para evitar la hipoxia y la hipercapnia, así como colocar la cabeza de forma que no exista obstrucción del retorno venoso.
La autorregulación cerebral requiere aproximadamente 20 segundos para activarse, por lo que se debe asegurar un plano anestésico profundo previo a la laringoscopia, que evite cualquier aumento brusco en la PA. La duración de la laringoscopia es un factor importante en la magnitud de la respuesta hemodinámica. El uso de videolaringoscopio ofrece mejor visión de las estructuras laríngeas y disminuye el tiempo hasta la IOT. Se puede emplear (remi)fentanilo, lidocaína (1-1,5mg/kg IV) o esmolol (0,5-1mg/kg IV) para atenuar la respuesta hemodinámica a la laringoscopia. El tubo debe ser reforzado, contar con neumotaponamiento y estar cuidadosamente fijado, evitando los lazos a ambos lados del cuello que pueden causar obstrucción venosa. Los pacientes con VAD conocida pueden requerir una IOT despierto con una meticulosa topicalización de la vía aérea que mantenga estable la hemodinámica, evite o minimice la necesidad de sedación (hipoxia, hipercapnia) y suprima los esfuerzos y la tos.