Marquina Pérez A (1), García Molina C (2), Duro Mota E (3), Díaz Campanero P (1).
(1) Residente de Anestesiología y Reanimación en el Hospital Universitario de Getafe, Madrid.
(2) Jefa del Servicio de Anestesiología y Reanimación en el Hospital Universitario de Getafe, Madrid.
(3) Facultativo especialista de Anestesiología y Reanimación en el Hospital Universitario de Getafe, Madrid.
Cómo citar este artículo: Marquina, A., García Molina, C., Duro Mota, E., & Díaz Campanero, P. (2023). Revisión del manejo perioperatorio de anticoagulantes y antiagregantes. Revista Electrónica AnestesiaR, 14(12). https://doi.org/10.30445/rear.v14i12.1063
Introducción
La hemostasia es un mecanismo fisiológico dinámico de defensa del organismo ante la pérdida de volemia. Dicho proceso permite la activación y neutralización de una serie de factores que permiten el mantenimiento de un equilibrio adecuado en el sistema de coagulación, pudiendo tener lugar con fines profilácticos en el vaso sanguíneo intacto o de forma correctora en casos de solución de continuidad en algún punto del árbol vascular. En este último escenario van a participar la vasoconstricción inicial, la hemostasia primaria con el tapón plaquetario, la hemostasia secundaria relacionada con la cascada de coagulación y la fibrinólisis como paso final.
Breve revisión fisiológica de la hemostasia
Ante una pérdida de continuidad en el árbol vascular se produce un espasmo vascular como consecuencia de la contracción de la capa muscular media (1). Esta vasoconstricción se relaciona tanto con mediadores de naturaleza simpática como con factores locales y plaquetarios (como el tromboxano A2). Por otro lado, la hemostasia primaria es protagonizada por las plaquetas. Estos elementos sanguíneos son fragmentos de megacariocitos con un diámetro de 2-4 micrómetros y una semivida de 8 a 12 días. En la superficie de su membrana, junto con los fosfolípidos presentes en las membranas biológicas, se encuentra una capa de glucoproteínas con carga negativa que jugará un papel fundamental en la formación del tapón plaquetario. Otro de los elementos de interés en este proceso son los gránulos plaquetarios, en los que se encuentran múltiples sustancias con funciones variadas que van más allá del proceso hemostático.
El proceso de formación del tapón plaquetario en esta primera fase de la hemostasia es iniciado con la unión entre el colágeno del subendotelio expuesto por el traumatismo vascular y la unión con las glucoproteínas de la membrana plaquetaria, estableciéndose así un vínculo débil que da paso a la activación del factor de Von Willebrand (FvW), favoreciendo la estabilización del coágulo. Este mecanismo permite la liberación del tromboxano A2 y adenosín difosfato (ADP) contenidos en los gránulos plaquetarios para la reacción entre plaquetas cercanas a través de la expresión de la glucoproteína Ib. Como resultado, se produce la formación de hebras de fibrina en el proceso conocido como agregación plaquetaria. A continuación, por acción de la actina, miosina y trombostenina tiene lugar la contracción del tapón, que equivale a la retracción del coágulo. Como último paso antes del inicio de la hemostasia secundaria se produce la activación plaquetaria, con la consecuente expresión del factor III, factor tisular o tromboplastina tisular.
Posteriormente entra en juego la cascada de coagulación, clásicamente dividida en dos vías principales: la vía de activación por contacto o intrínseca y la vía del factor tisular o extrínseca. Cada una de las cascadas produce la activación consecutiva de varios factores de coagulación (XII, XI y IX en el caso de la intrínseca y VII en la extrínseca) concluyendo ambas en la activación del factor X o vía común, que con la intervención del factor V permite el paso de protrombina a trombina (factor II activado). La trombina es la encargada de transformar el fibrinógeno en fibrina (factor I activado), que en colaboración con el factor XIII permite la formación del coágulo de fibrina entrecruzada.
En la hemostasia también participan una serie de inhibidores fisiológicos de la coagulación como son la antitrombina III, la alfa 2 macroglobulina, la antiplasmina 2, las proteínas C y S y el cofactor II de la heparina.
Por último, en este proceso en constante equilibrio, la eliminación del coágulo también es fundamental y es llevada a cabo a través de la fibrinolisis. En este caso el plasminógeno es transformado en plasmina gracias a la intervención de varios cofactores, permitiendo así la degradación de la fibrina y, consecuentemente, del coágulo.
Manejo perioperatorio de anticoagulantes y antiagregantes
Es imprescindible, en el manejo perioperatorio/periprocedimiento tanto de anticoagulantes como de antiagregantes, valorar conjuntamente riesgo hemorrágico y riesgo trombótico.
Estratificación del riesgo trombótico
A nivel trombótico el riesgo es estratificado en función del motivo de la anticoagulación o antiagregación y la comorbilidad del paciente.
En el caso de pacientes anticoagulados el riesgo de trombosis se estratifica como se indica a continuación (2, 3, 4):
- Alto riesgo de trombosis:
- Pacientes anticoagulados portadores de válvulas cardiacas metálicas en posición mitral, tricuspídea y aórtica si es monodisco, así como prótesis tricuspídeas biológicas o aquellos pacientes con cualquiera de las válvulas descritas y antecedentes de ictus o accidente isquémico transitorio (AIT) en los últimos 6 meses.
- Anticoagulación por fibrilación auricular (FA) con una puntuación CHA2DS2-VASc 7-9, antecedente de ictus o AIT en los 3 meses previos o valvulopatía reumática mitral.
- Pacientes anticoagulados por episodio de tromboembolismo venoso (TEV) en los 3 meses previos o en relación con trombofilia grave, definiéndose ésta como homocigosis de factor V de Leiden, 20210 protrombina, déficit de proteína C, S o antitrombina, defectos múltiples o síndrome antifosfolipídico.
- Se habla de riesgo moderado en los casos de pacientes anticoagulados:
- Portadores de válvula aórtica metálica con, además, uno de los siguientes factores de riesgo: FA, ictus/AIT previo hace más de 6 meses, diabetes mellitus, insuficiencia cardiaca o mayores de 75 años.
- En relación con FA con CHA2DS2-VASc entre 5 y 6 o ictus o AIT hace más de 3 meses.
- Debido a TEV en los 3-12 meses previos, por trombofilia no grave (heterocigosis para factor V Leiden o mutación 20210 A de la protrombina), TEV recurrente o TEV en contexto de cáncer activo.
- El riesgo trombótico bajo se atribuye a:
- Válvulas protésicas metálicas aórticas sin los factores de riesgo descritos previamente.
- FA con CHA2DS2-VASc menores de 4 o sin antecedentes de ictus o AIT y TEV hace más de un año.
De igual modo en los casos de fármacos antiagregantes se habla de alto, moderado o bajo riesgo trombótico en función de las comorbilidades recogidas en la siguiente tabla:
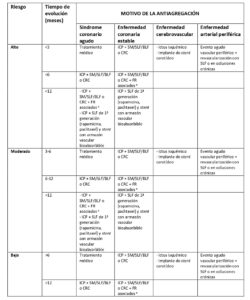
AIT: accidente isquémico transitorio; BLF: balón liberador de fármaco; CRC: cirugía de revascularización coronaria; DM: diabetes mellitus; FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervención coronaria percutánea; IRC: insuficiencia renal crónica; SFA: stent farmacoactivo; SM: stent metálico; TCI: tronco coronario izquierdo.
a Factores de riesgo asociados: ictus/AIT previo, DM, IRC, ICP complejo (stents largos, múltiples, bifurcaciones, TCK, vasos únicos, solapamiento, vasos <2,5 mm o injertos de vena safena).
Estratificación del riesgo hemorrágico
El riesgo hemorrágico se divide en tres grupos en función del tipo de intervención o procedimiento (5, 6):
- Bajo riesgo hemorrágico: aquel en el que la hemostasia se puede conseguir de forma adecuada o aquellos casos en los que una posible hemorragia no suponga un riesgo vital para el paciente ni comprometa el resultado de la cirugía. Los posibles sangrados asociados a este tipo de procedimientos no deben requerir transfusión de hemoderivados. Incluye los siguientes tipos de cirugías: cirugía menor periférica, ortopédica menor, otorrinolaringología endoscópica, cirugía de cámara anterior del ojo, procedimientos dentales simples, inyecciones intramusculares, endoscopia sin biopsia y con biopsias (polipectomías únicas y pequeñas).
- Moderado riesgo hemorrágico: se trata de aquellos procedimientos o técnicas anestésicas en los que la hemostasia puede ser difícil de llevar a cabo o aumenta la necesidad de transfusión o reintervención en el caso de las intervenciones quirúrgicas. Se incluyen las siguientes cirugías y técnicas anestésicas: cirugía mayor visceral, cardiovascular, ortopédica mayor, otorrinolaringología (amigdalectomía), cirugía reconstructiva plástica, urología endoscópica (resección transuretral de próstata) y punción raquídea (intradural o epidural).
- Alto riesgo hemorrágico: en este grupo se incluyen intervenciones que pueden comprometer la vida del paciente o el resultado de la cirugía. Hace referencia a neurocirugía, cirugía de canal medular, de cámara posterior del ojo o de vaciamiento cervical.
Además, deben tenerse en cuenta otra serie de factores que determinan el riesgo hemorrágico y son inherentes al paciente y al medio como son la edad por encima de 65 años, insuficiencia renal o hepática, tratamientos concomitantes que afecten a la hemostasia, antecedentes de hemorragia espontánea en los 3 meses previos a la intervención o procedimiento invasivo, trombocitopenia y/o trombocitopatía e INR lábil en pacientes tratados con fármacos anti vitamina K.
Anticoagulantes: manejo perioperatorio
A día de hoy encontramos dos grandes grupos de anticoagulantes usados en la práctica clínica: los fármacos anti vitamina K y los anticoagulantes de acción directa. Cada uno de estos grupos presenta unos requerimientos e indicaciones en relación con el manejo perioperatorio de los mismos (7).
- Fármacos anti vitamina K: acenocumarol y Warfarina
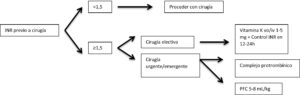
Ambos fármacos tienen un metabolismo hepático y su acción se controla mediante INR, con valores objetivo de entre 2 y 3. Idealmente su suspensión debe llevarse a cabo en los 5 días previos al procedimiento en el caso de la Warfarina (8) y 2-3 días previos para el acenocumarol (9). En ciertos casos se precisará terapia puente con heparina (ver apartado Terapia puente: heparina).
Está indicada la realización de una prueba de INR previa a la intervención. En caso de obtener un resultado menor o igual a 1,5 podrá realizarse la intervención. Si el resultado obtenido es mayor de esta cifra la actuación variará en función de si se trata de cirugía programada o urgente/emergente. En el primer caso está indicada la administración de vitamina K oral o endovenosa a dosis de 1-5 mg con posterior control tras 12-24 horas. En las cirugías que no permiten espera se administrará complejo protrombínico en función del INR obtenido o, con menor evidencia de recomendación, plasma fresco congelado a dosis de 5-8 mL/kg (10).
Respecto a la reintroducción de los anticoagulantes tras la cirugía o el procedimiento, de forma general tanto los anti vitamina K como los nuevos anticoagulantes deberán reintroducirse 24 horas tras la intervención. En aquellos procedimientos con alto riesgo hemorrágico, el inicio de la anticoagulación oral deberá demorarse entre 48 y 72 horas. Se recurrirá a la terapia puente postoperatoria en pacientes con alto riesgo tromboembólico.
- Anticoagulantes de acción directa: inhibidor directo de la trombina e inhibidores directos del factor X activados (Xa)
Estos fármacos, de aparición más reciente, muestran características distintivas de las descritas con anterioridad (11).
- Inhibidor directo de la trombina: dabigatrán (Pradaxa®)
Se trata de un inhibidor directo del factor II activado (IIa) que actúa como un profármaco, sobre la trombina libre y ligada a fibrina. Su acción produce alteración a nivel del tiempo de protombina (TP) y tiempo de tromboplastina parcial activada (TTPa). La vida media (Vm) de este fármaco es de 12-15 horas y presenta eliminación renal, lo que contraindica su uso en pacientes con aclaramiento de creatinina (ClCr) por debajo de 30 mL/minuto.
Su suspensión previa a una intervención o procedimiento debe ajustarse en base a la función renal y el riesgo hemorrágico del procedimiento (ver tabla 2). Actualmente tampoco se recomienda la terapia puente.
En situaciones de cirugía urgente o emergente, se debe diferir la intervención si es posible y la situación clínica del paciente lo permite, 24 horas. De no ser así habría que valorar el uso del antídoto específico, el Idarucizumab®, un fragmento de anticuerpo monoclonal humanizado que antagoniza de forma directa la acción del dabigatrán y que fue aprobado por la Food and Drug Administration (FDA) en 2015. Este fármaco debe administrarse en infusión intravenosa de 2,5 g seguida de 2,5 g con un intervalo de separación de 15 minutos.
- Inhibidores directos del factor Xa
Esta familia farmacológica incluye el rivaroxabán (Xarelto®), apixabán (Eliquis®) y edoxabán (Lixiana®). El mecanismo de todos ellos es común, produciendo una inhibición reversible del factor Xa. Tienen una Vm similar (9-12 horas para el Rivaroxabán, 8-15 horas en el caso de Apixabán y 9-10 horas el Edoxabán) y un mecanismo de eliminación fundamentalmente hepático, con tan solo un 25-35% de eliminación renal, que contraindica su uso en pacientes con ClCr menor de 15 mL/min.
La suspensión de estos fármacos previo a una cirugía o técnica anestésica depende nuevamente del riesgo hemorrágico de la misma. En aquellos procedimientos de bajo riesgo deben retirarse en las 24-36 horas previas, mientras que si se trata de procedimientos de riesgo moderado o alto, deberán ser 48 horas. En caso de tratarse de cirugías urgentes o emergentes debe esperarse 24 horas al menos si la situación clínica del paciente lo permite. En caso de no ser diferible el procedimiento se dispone de un antídoto específico para todos los fármacos inhibidores del factor Xa (derivado recombinante modificado del factor Xa), aprobado de forma más tardía por la FDA que el Idarucizumab®. Se trata del Anderxanet alfa® y su pauta de administración consiste en un bolo intravenoso de 400-800 mg en 15-30 minutos seguido de una perfusión de 480-960 mg en 24 horas.

- Terapia puente: heparina
Dentro del grupo farmacológico de los anticoagulantes indirectos se encuentra la heparina, un fármaco que actúa activando la antitrombina III (inhibidor fisiológico de la coagulación). Existen dos tipos de heparina:
- Heparina de sódica no fraccionada (HNF): presenta un peso molecular de 15.000 Da y una vida media de 1,55 horas. Su eliminación incluye dos vías, una rápida endotelial-macrofágica, y una lenta renal. Para su monitorización debe valorarse el TTPa (valores de anticoagulación entre 1,5 y 2,5). Presenta posibilidad de administración tanto por vía subcutánea como por vía intravenosa. Este tipo de heparina tiene un mayor riesgo de efectos adversos (sangrado y trombopenia inducida por heparina) en comparación con la heparina de bajo peso molecular.
- Heparina de bajo peso molecular (HBPM): esta heparina, de 3.500-6.000 Da de peso molecular, tiene una mayor vida media (3-5 horas) y eliminación únicamente por vía renal, por lo que se contraindica en situaciones de ClCr menor de 30 mL/min. No requiere monitorización salvo en casos específicos.
El antídoto de ambos tipos de heparina es el sulfato de protamina, más efectivo en el caso de la HNF.
En función del riesgo hemorrágico y protrombótico del paciente y la cirugía se decidirá de forma individual la necesidad o no de terapia puente tras la retirada de los anticoagulantes. Su reintroducción tras el procedimiento a dosis profilácticas o terapéuticas también debe valorarse individualmente (12).
La terapia puente debe suspenderse 4-6 horas antes del procedimiento en el caso de la HNF. En el caso de la HBPM la suspensión será 12 horas antes si la dosis es profiláctica (administrada cada 24 horas) o 24 horas antes si se trata de dosis terapéutica (administrada cada 12 horas).
- Antiagregantes: manejo perioperatorio
Incluimos en este grupo farmacológico la familia de inhibidores P2Y12 (ticagrelor, clopidogrel y prasugrel), el ácido acetilsalicílico o aspirina, el triflusal, el cilostazol y el dipiridamol.
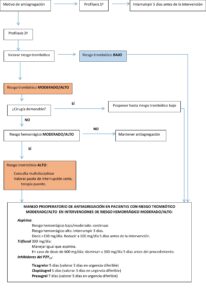
De nuevo el manejo perioperatorio de la antiagregación depende en primera instancia de la premura de la intervención a llevar a cabo (13, 14). De forma que, en cirugías o procedimientos urgentes o emergentes (no demorables), debe mantenerse la antiagregación. En el caso de tratarse de cirugías programadas la decisión dependerá inicialmente del motivo de indicación de los antiagregantes. Por tanto, si se trata de antiagregación por motivos de prevención primaria, esta debe suspenderse 5 días antes de la intervención. De no ser así, pasaremos a valorar el riesgo hemorrágico del procedimiento.
En casos de riesgo hemorrágico bajo mantendremos la antiagregación durante la intervención. Por otro lado, si nos enfrentamos a una situación de moderado o alto riesgo hemorrágico el manejo indicado es el siguiente:
- Aspirina: Administrada a dosis de 100 mg/día puede mantenerse (excepto en neurocirugía u otras situaciones de alto riesgo hemorrágico, en las que se recomienda su interrupción 3 días antes de la intervención). Si la dosis administrada es mayor de 150 mg/día se recomienda su reducción a 100 mg/día en los 5 días previos al procedimiento.
- Triflusal 300 mg/día: El manejo es igual al de la aspirina. En caso de tratarse de una dosis de 600 mg/día se recomienda disminuirla a 300 mg/día 5 días antes de la intervención.
- Inhibidores del P2Y12: El clopidogrel y el ticagrelor deben suspenderse 5 días antes, mientras que será 7 días antes para el prasugrel. En situaciones de urgencias diferibles debemos valorar la realización de la cirugía o procedimiento tras un tiempo de interrupción reducido (3 días para clopidogrel y ticagrelor y 5 días para prasugrel). En caso de monoterapia con estos fármacos se debe valorar su sustitución por aspirina 100 mg/día.
- Cilostazol/Dipiridamol: Interrumpir 48 horas antes de la intervención.
La duración del tratamiento en los pacientes doblemente antiagregados debe ser como mínimo de 3 meses.
La antiagregación debe reiniciarse si no existe contraindicación en las primeras 24-72 horas tras la cirugía y debe considerarse la administración de dosis de carga con doble antiagregación si existe alto riesgo trombótico (esperando a las 48-72 horas postquirúrgicas si hay alto riesgo hemorrágico).
Conclusión
El adecuado conocimiento y manejo de los fármacos relacionados con la coagulación y agregación plaquetaria es fundamental en el campo de la anestesiología y aporta seguridad en el contexto perioperatorio más inmediato. No se trata únicamente de una cuestión a valorar en relación con la intervención quirúrgica, sino que también es importante en vistas a la técnica anestésica a realizar tanto en el contexto del área quirúrgica como en cualquier otro de los campos abarcados por nuestra especialidad.
Los algoritmos de decisión y los estándares basados en las últimas actualizaciones de los documentos consenso de las sociedades médicas españolas, europeas y americanas facilitan nuestra actuación y permiten una homogeneización de estas medidas tan importantes y necesarias. Así pues, la constante revisión de estas cuestiones es fundamental en nuestra actividad clínica diaria.
Bibliografía
- HEMOSTASIA; J. Alonso, A. Fernández, A. Arízaga, L. Aguilera; Fisiología Aplicada a la Anestesiología, 3ª edición. (HTML)
- Vivas D, Roldán I, Ferrandis R, Marín F, Roldán V, Tello-Montoliu A, et al. Manejo perioperatorio y periprocedimiento del tratamiento antitrombótico: documento de consenso de SEC, SEDAR, SEACV, SECTCV, AEC, SECPRE, SEPD, SEGO, SEHH, SETH, SEMERGEN, SEMFYC, SEMG, SEMICYUC, SEMI, SEMES, SEPAR, SENEC, SEO, SEPA, SERVEI, SECOT y AEU. Rev Esp Cardiol 2018;71(7):553-64. (PDF)
- Collet J-P, Thiele H, Barbato E, Barthélémy O, Bauersachs J, Bhatt DL, et al. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J 2021;42(14):1289-367. (PubMed)
- Serrador Frutos AM, Jiménez-Quevedo P, Pérez de Prado A, Pan Álvarez-Ossorio M. Registro Español de Hemodinámica y Cardiología Intervencionista. XXVI Informe Oficial de la Sección de Hemodinámica y Cardiología Intervencionista de la Sociedad Española de Cardiología (1990-2016). Rev Esp Cardiol 2017;70(12):1110-20. (PubMed)
- Hidalgo F, Gómez-Luque A, Ferrandis R, Llau JV, de Andrés J, Gomar C, et al. Manejo perioperatorio de los anticoagulantes orales directos en cirugía urgente y sangrado. Monitorización y tratamiento hemostático. Rev Esp Anestesiol Reanim 2015;62(8):450-60. (medes)
- Horlocker TT, Vandermeuelen E, Kopp SL, Gogarten W, Leffert LR, Benzon HT. Regional Anesthesia in the Patient Receiving Antithrombotic or Thrombolytic Therapy: American Society of Regional Anesthesia and Pain Medicine Evidence-Based Guidelines (Fourth Edition). Reg Anesth Pain Med. 2018 Apr;43(3):263-309. doi: 10.1097/AAP.0000000000000763. (PubMed)
- Spyropoulos AC, Al-Badri A, Sherwood MW, Douketis JD. Periprocedural management of patients receiving a vitamin K antagonist or a direct oral anticoagulant requiring an elective procedure or surgery. J Thromb Haemost. 2016 May;14(5):875-85. doi: 10.1111/jth.13305. (PDF)
- Hirsh J, Fuster V, Ansell J, Halperin JL. American Heart Association/American College of Cardiology Foundation Guide to Warfarin Therapy. Circulation 2003;107(12):1692-711. (PubMed)
- Faraoni D, Levy JH, Albaladejo P, Samama C-M, and the Groupe d’Intérêt en Hémostase Périopératoire. Updates in the perioperative and emergency management of non-vitamin K antagonist oral anticoagulants. Crit Care 2015;19(1):203. (HTML)
- Protocolo de tromboprofilaxis del Hospital Universitario de Getafe (2021).
- Levy JH. Discontinuation and management of direct-acting anticoagulants for emergency procedures. The American J Emerg Med 2016;34(11):14-8. (HTML)
- Douketis JD, Spyropoulos AC, Kaatz S, Becker RC, Caprini JA, Dunn AS, et al. Perioperative Bridging Anticoagulation in Patients with Atrial Fibrillation. N Engl J Med.2015;373(9):823-33. (PubMed)
- Llau JV, López-Forte C, Sapena L, Ferrandis R. Perioperative management of antiplatelet agents in noncardiac surgery: Eur J Anaesthesiol 2009;26(3):181-7.
- Patrono C, Baigent C, Hirsh J, Roth G. Antiplatelet Drugs. Chest 2008;133(6):199S-233S. (HTML)





Buen artículo que permite incrementar y actualizar los conocimientos en la práctica de la Anestesiología
Me sirvió mucho la información para presentar un caso clínico que voy a presentar
Excelente sintesis de informacion.