Feito Sancho J (1), Feito Sancho L (2)
(1) FEA Anestesiología y Reanimación, Hospital Universitario Príncipe de Asturias, Alcalá de Henares, Madrid.
(2) Opositor MIR. Médico por la Universidad de Navarra, Madrid.
Cómo citar este artículo: Feito Sancho, J., & Feito Sancho, L. (2021). Hidatidosis: Manejo perioperatorio y revisión de la bibliografía. A propósito de un caso. Revista Electrónica AnestesiaR, 13(6). https://doi.org/10.30445/rear.v13i6.934
Introducción
En los últimos años, mucha patología tanto médica como quirúrgica que se creía erradicada de nuestro medio, vuelve a aparecer tímidamente en nuestros centros hospitalarios. Los movimientos de pasajeros y los flujos migratorios impuestos por un mundo globalizado, unido a los escasos y muchas veces nulos controles sanitarios en los aeropuertos, hacen que las fronteras no supongan ninguna barrera para los agentes patógenos.
En este sentido, se presenta un caso de hidatidosis con quistes hepáticos rotos, recibido y tratado en el Hospital Universitario Príncipe de Asturias. El caso presentó las complicaciones típicas derivadas del tratamiento quirúrgico de la enfermedad, por lo que resulta en un buen repaso de las fases esperables en el tratamiento de estos pacientes y que los anestesiólogos, tanto de quirófano como de Reanimación, deben esperar.
Presentación del caso clínico
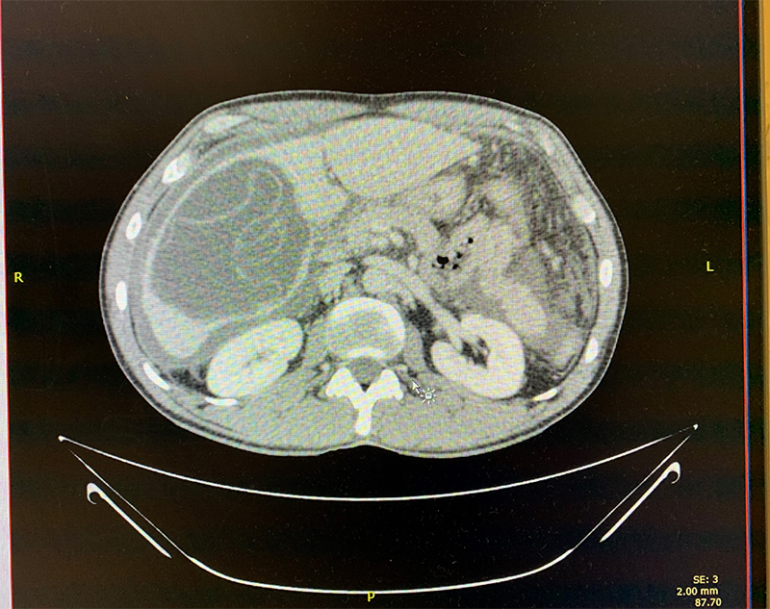
El grupo de Anestesiología de guardia recibe una llamada de Cirugía: se trata de un varón de 35 años, extranjero, sin antecedentes personales ni familiares conocidos. El paciente había acudido varias veces al servicio de urgencias durante la última semana por dolor abdominal, habiéndose descartado patología aguda quirúrgica. Tras una nueva visita se decide realización de estudio radiológico realizándose un TAC abdomino-pélvico con administración de contraste yodado, objetivándose un gran quiste hidatídico en los segmentos V y VI hepáticos del LHD con defecto de continuidad de su pared inferolateral, sugestivo de rotura a peritoneo, con abundante liquido libre intraabdominal y leve realce peritoneal. (figura 1). Se decide tratamiento quirúrgico.
Tanto el hemograma como la bioquímica mantenían todos los parámetros en rango de normalidad, salvo por un INR de 1,5.
El paciente pasa a quirófano, donde se procede a realizar una inducción de secuencia rápida e intubación sin incidencias con un tubo endotraqueal del número 7.5. Mantenimiento anestésico con Desfluorano a dosis de 1 CAM y perfusión de remifentanilo entre 0.1 a 0.2 mcgrs/Kg/min. El paciente se encuentra hemodinámicamente estable en todo momento con tensiones arteriales medias de >75-80 mmHg, por lo que se decide no canalizar un catéter arterial ni acceso venoso central. Se canaliza un acceso venoso periférico de 16G en miembro superior izquierdo y otro de 20G en miembro superior derecho y se inicia terapia de reanimación y expansión con cristaloides balanceados (se infunden 2500 mL de volumen).
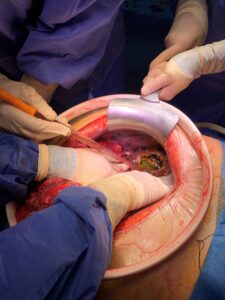
Desde el punto de vista quirúrgico se realiza una laparotomía media, hallándose una peritonitis purulenta generalizada secundaria a quiste hidatídico hepático roto que abarca principalmente los segmentos VI, VII y VIII hepáticos. Se aprecian además múltiples vesículas hidatídicas, tanto periquiste como diseminadas por toda la cavidad peritoneal (Figura 2). No se aprecia patología biliar.
Se realiza una quisto-periquistectomía hepática con salida completa de la membrana quística y lavado abundante de la cavidad quística con suero hipertónico al 20%. Posteriormente se procede al lavado de la cavidad abdominal también con hasta 9 litros de suero salino hipertónico al 20% durante 10 minutos, tras lo que se llena con compresas empapadas en povidona yodada durante otros 10 minutos y se realiza una epiploplastia con colgajo de epiplón rellenando la cavidad. El tiempo quirúrgico total fue de 2 horas.
El paciente recupera la respiración espontánea tras la reversión de la relajación neuromuscular y realiza adecuados volúmenes con buena mecánica respiratoria, por lo que se extuba y se traslada a URPA, donde ingresa hemodinámicamente estable, aunque con nivel de consciencia fluctuante.
Se solicita bioquímica urgente que arroja los siguientes datos: Natremia de 165 mmol/L; Cloremia de 137 mmol/L, resto de valores en rango de normalidad. En ese momento se inicia terapia con suero glucosado al 5% (perfusión continua a 82 mL/h) e insulina según protocolo del hospital (retirándose los cristaloides balanceados) y se procede a canalización de arteria radial izquierda, así como de vena yugular interna derecha.
El paciente mantiene su nivel de consciencia fluctuante, alternando periodos de aparente lucidez con periodos de desconexión. Se solicita nuevo control analítico en 6 horas, que apenas varía los datos de la natremia que se mantiene en 165 mmol/l y cloremia de 137 mmol/L mostrando una glucemia de 297 mg/dL. Se intensifica la perfusión de insulina a la que se añade un aporte de potasio así como la velocidad del suero glucosado hasta los 140 mL/h. El paciente muestra una poliuria franca en probable relación con glucosuria. En este momento se inicia la terapia con albendazol.
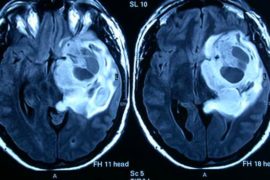
Dada la evolución del cuadro, se decide realizar un TAC de cráneo, que descarta razonablemente patología aguda que justifique el estado de consciencia, tras lo que se realiza intubación orotraqueal sin incidencias y traslado a UCI. En esta unidad se mantiene el tratamiento instaurado en URPA, modificando únicamente la infusión de suero glucosado al 5% hasta 300 mL/h y añadiendo un suero balanceado en “Y” para mantenimiento del resto de iones. A las 24 horas de ingreso en UCI, la natremia disminuye hasta 154 mmol/L y la cloremia a 113 mmol/L. Se decide realizar una ventana de sedación, tras la que se extuba al paciente sin incidencias.
El día +2 de ingreso en UCI, con una natremia de 145 mmol/L y resto de iones en rango, se decide alta de UCI a la planta de hospitalización manteniendo el tratamiento con albendazol.
Discusión del caso
La equinococosis es una enfermedad endémica en España. Es una zoonosis de declaración obligatoria en España1 causada por Equinococcus spp de la familia de las tenias (Taeniidae). Concretamente existen cuatro especies de equinococo capaces de producir enfermedad en humanos: E. Multilocularis, E. Granulosus (las más prevalentes), E. Vogeli y E. Oligarthus (ambos causan equinococosis poliquística). Recientemente se han identificado dos nuevas especies de equinococo, cuya capacidad de infectar humanos está todavía bajo investigación: E. Felidis (aislado en leones africanos) y E. Shiquicus (identificado en pequeños mamíferos de la meseta tibetana)2. El reservorio del equinococo lo constituyen en nuestro medio principalmente los perros (hospedador definitivo), aunque también puede encontrarse en otros animales. El vehículo de trasmisión de la enfermedad es el contacto con las heces, la saliva o incluso el pelo de animales infectados. La infección en humanos es accidental, y las larvas no podrán desarrollarse a individuos maduros. No existe trasmisión entre humanos.
Una vez infectado, el periodo de incubación varía entre 1 y 20 años. Muchos pacientes permanecen asintomáticos durante toda su vida. El conocido como quiste hidatídico (lesión más frecuente) es la larva hidátide con la correspondiente envuelta quística desarrollada por el hospedador.
Para poder hablar del tratamiento de la hidatidosis, hay que establecer los distintos estadios de la enfermedad. En este sentido la Organización Mundial de la Salud distingue los siguientes estadios2:
- Estadio I: Paciente con quistes uniloculares y <5cms.
- Estadio II: Quistes multiloculares y/o >5 cms.
- Estadio III: Quistes complicados (rotos, fistulas biliares, sobreinfectados, comprimen estructuras vitales, etc), quistes de >10 cms, enfermedad extrahepática.
- Estadio IV: Quistes inactivos, calcificados o asintomáticos.
Dependiendo el estadio en el que nos encontremos, el tratamiento aplicado variará de la siguiente manera:
- Estadio I: Tratamiento farmacológico con antiparasitarios como albendazol (primera elección) a dosis de 15 mg/Kg/día, repartidas en dos tomas.
- Estadio II: El tratamiento farmacológico no parece ser suficiente en pacientes con quistes de >5cms o múltiples quistes, por lo que se le debe de asociar una terapia invasiva. La primera opción será siempre la terapia PAIR (las siglas en inglés de Puncture, Aspiration, Injection and Reaspiration) o la evacuación del quiste mediante catéteres, es decir, el tratamiento percutáneo de estas lesiones. En caso de no ser posible, se recurrirá a la cirugía. Repasaremos este tratamiento más adelante.
- Estadio III: La cirugía combinada con antiparasitarios es de elección en este grupo.
- Estadio IV: Actitud conservadora.
A modo de resumen, repasamos lo principales grupos de tratamiento:
- Farmacológico: El albendazol es el tratamiento de elección. No existe a día de hoy una formulación intravenosa para albendazol, por lo que debe de administrarse por vía oral o por sonda nasogástrica, y si es posible acompañado de las comidas grasas para aumentar su absorción. La dosis será de 15 mg/kg/día repartida en dos dosis3. En adultos de 70 kilogramos esto supondrá 400mg cada 12 horas. La duración del tratamiento ha sido motivo de discusión en la literatura y dependerá de factores clínicos, y puede variar desde 28 días a 3 meses. El albendazol inhibe la formación de microtúbulos y la absorción de glucosa por parte del equinococo, lo que le lleva a la degeneración del retículo endoplásmico y a la muerte. Los efectos adversos más frecuentes del albendazol son dolor abdominal, nauseas y vómitos, pero pueden presentarse también hepatotoxicidad (entre el 1 y 5%), citopenias (<1%) y alopecia (<1%). En algunos casos podemos observar un aumento de enzimas hepáticas que puede deberse tanto a la hepatotoxicidad como al efecto antiparasitario. Los niveles de estas enzimas deben de monitorizarse durante el tratamiento, habitualmente cada dos semanas, y debiendo interrumpirse el tratamiento si estos niveles multiplicasen por cinco el rango de normalidad aportado por el laboratorio.
Existen contraindicaciones para el uso de albendazol, entre las que cabe destacar la enfermedad hepática grave de otra etiología (etilismo, esteatosis grave, hepatitis, etc) y enfermedades hematológicas con supresión de líneas celulares. Existe también una contraindicación para su uso durante el embarazo dado su potencial teratógeno. Asimismo, no existen muchos datos de sobre su seguridad en niños menores de 6 años. En caso de no disponer de albendazol en nuestro centro, el tratamiento de segunda línea es el mebendazol, con una peor absorción en el tracto digestivo, y el praziquantel. Ambos son más baratos y resultan más asequibles en muchos países, aunque menos eficaces según los estudios publicados hasta la fecha3.
- Terapia percutánea: Existen dos modalidades fundamentales: la terapia PAIR y el drenaje del quiste mediante catéteres de gran calibre.
La terapia PAIR puede resultar tanto diagnóstica como terapéutica. Se realiza guiada por ultrasonidos o bajo control de TAC, en los que una vez localizados los quistes, se procede a su punción mediante una aguja y un catéter de pequeño diámetro. Se aspira el contenido del quiste, que será mandado al correspondiente departamento de Anatomía Patológica para su examen, y se procede a inyectar agentes antihelmínticos o suero hipertónico al 20% (que destruyen la capa germinal) en la lesión. Estos se mantendrán en el interior de la misma durante 10-15 minutos antes de realizar una nueva aspiración. Si fuese necesario, puede realizarse una nueva inyección del agente y reaspiración pasados otros 15 minutos. Esta terapia debe de acompañarse siempre de coadyuvancia con albendazol oral u otro agente antiparasitario. La terapia PAIR está contraindicada en quistes calcificados, muy cercanos a la superficie hepática, quistes rotos o con comunicación biliar. La realización de este procedimiento implica varios riesgos: rotura con vertido del contenido del quiste en la cavidad abdominal y diseminación de la enfermedad, esclerosis química de la lesión y de los tejidos en contacto con el agente antihelmíntico, colangitis, fístula biliar, sangrado e infección. La tasa de éxito (curación) con la terapia PAIR realizada por médicos experimentados es de hasta el 95% en algunas series4–6.
La alternativa percutánea a la terapia PAIR es la escisión del quiste con catéteres de mayor diámetro punta cortante conectados a aspiración. Implica, como es obvio, mayor riesgo, y se reserva para quistes difícilmente drenables vía PAIR y para quistes multiloculados y complejos.
- Cirugía: El abordaje quirúrgico debe de ser personalizado dependiendo de la gravedad y las características de las lesiones, pero se basa en una exéresis del quiste (si es posible intacto) y periquistectomía del tejido sano. Debe de cubrirse bien el campo quirúrgico con compresas empapadas en solución antihelmíntica o suero salino al 20%. Tras la exéresis de la lesión, se procederá al lavado de la cavidad del quiste con la misma solución. En caso de que no sea posible sacar el quiste intacto y éste se rompiese antes de finalizar la intervención quirúrgica, se procederá al lavado de toda la cavidad abdominal con un agente antihelmíntico o suero salino al 20%, manteniendo la solución en contacto con la cavidad al menos 15 minutos. Los agentes antihelmínticos más utilizados para lavar el peritoneo tras el suero hipersalino son albendazol, praziquantel e ivermectina (menor eficacia y seguridad). La formalina está actualmente en desuso dado su escasa seguridad y estrecha ventana terapéutica. Una vez finalizada la cirugía, se realizará un ciclo de tratamiento oral con albendazol como ya se ha descrito. La profilaxis quirúrgica con albendazol también es una práctica aconsejable.
Una vez repasado el tratamiento de la equinococosis, podemos diagnosticar a nuestro paciente de tener una enfermedad en estadio III de la OMS. Se aplica por tanto el tratamiento correcto: quirúrgico. Dada la evolución de los hechos, es previsible que el quiste hepático del paciente llevase roto ya varios días, provocándole un abdomen agudo y la peritonitis purulenta que después se encontró en el acto quirúrgico. Por ello, era razonable descartar otra entidad concurrente en algunos de estos casos: la anafilaxia. Algunos de estos pacientes desarrollan una crisis anafiláctica al ponerse en contacto con los antígenos del equinococo. Al ser una reacción inmediata y al llevar nuestro paciente una semana de evolución, el cuadro fue descartado razonablemente. Este dato, junto con la estabilidad hemodinámica que mostró en todo momento, jugó un papel esencial en la decisión de no canalizar un acceso venoso central ni presión arterial invasiva al iniciar el acto quirúrgico.
La cirugía se desarrolló sin incidencias, y el paciente mantuvo la estabilidad hemodinámica en todo momento. El lavado de la cavidad peritoneal con 9 litros de suero salino al 20% anticipaba una nueva complicación, la hipernatremia, que fue de instauración rápida.
La hipernatremia aguda (instaurada en menos de 48 horas) debe de corregirse a un ritmo suficiente que nos permita volver a una natremia normal en 24 horas. La frontera de 48 horas para considerar una hipernatremia como aguda se basa en que este es el tiempo necesario para que se pongan en marcha los mecanismos cerebrales de adaptación. Una vez que estos están ya instaurados, un cambio rápido de la natremia puede derivar en un edema cerebral con gravísimas consecuencias para nuestro paciente. Este fenómeno está especialmente bien establecido en niños. Antes de las 48 horas de inicio de la hipernatremia, y con el fin de evitar la puesta en marcha de estos mecanismos, la natremia debe de ser tratada de forma agresiva y revertida, si es posible en 24 horas. Este era el caso de nuestro paciente. En cuanto fuimos conscientes de la gravedad de la hipernatremia, iniciamos la reposición de agua libre con suero glucosado al 5% (el que mayor aporte de agua libre contiene). Aunque existen fórmulas para calcular el déficit de agua libre que debemos aportar a un paciente a partir de la natremia actual y de la deseada, indexando con los valores antropométricos, éstas resultan solo en una idea general, un punto de partida, y la reposición debe de estar guiada siempre por la analítica, que inicialmente debe de realizarse cada 1-2 horas, pudiendo espaciarlas más adelante según disminuya la natremia. Por ello, iniciamos la perfusión de suero glucosado al 5% a 140 mL/h, con la intención de ajustar la misma en la siguiente analítica.
Son varios los factores que podemos tener en consideración para explicar por qué no disminuyó la natremia de nuestro paciente a pesar de iniciar el aporte de agua libre. El primero es la permanencia en el peritoneo de grandes cantidades de sal que seguían siendo absorbidas por la eficiente membrana de intercambio que el peritoneo supone. En este sentido, cabe recordar que una vez finalizado el lavado con 9 litros de suero hipersalino, se inició el cierre por planos, sin un aclarado previo de la cavidad peritoneal con suero fisiológico. En segundo lugar, como ya hemos comentado, el paciente inició, a pesar del inicio de la perfusión de insulina, una hiperglucemia de 300 mg/dL. A partir de una glucemia de 180 mg/dL, la reabsorción tubular en el túbulo contorneado proximal se satura, y comienza una glucosuria franca. La presencia de glucosa en la orina actúa de factor osmótico, arrastrando agua, y produciendo una pérdida de agua libre. Este fenómeno resulta contraproducente si lo que se pretende es aumentar los aportes de la misma. En tercer y último lugar, es posible que el aporte de suero glucosado esas dos primeras horas (140 mL/h) fuese insuficiente, dados los factores ya expuestos en los puntos previos.
Ante la duda de que la hipernatremia pudiera haber ocasionado un sangrado cerebral y para evitar que este hubiese quedado enmascarado por la situación (coma explicable parcialmente por la hipernatremia), se decide la realización de un TAC con administración de contraste intravenoso, donde no se observan lesiones que justifiquen ese estado de conciencia. Paralelamente se decide la intubación endotraqueal del paciente y su traslado a UCI, con la idea de intensificar la sueroterapia y tratar la hiperglucemia.
La evolución en UCI tras la intensificación del ritmo de la sueroterapia (de 140 a 400 mg/dL) y la insulinoterapia, resulta espectacular. El primer día de ingreso en UCI el paciente realiza un balance hídrico positivo de 5 litros. Además del suero glucosado, se inicia una perfusión de Plasmalyte en “Y” para mantenimiento del resto de los iones. En apenas 24 horas revierte el cuadro neurológico y se consigue extubar al paciente. En 48 horas, la natremia regresa a cifras normales y el paciente es dado de alta a la planta de hospitalización.
Durante todo este proceso se le administró vía sonda nasogástrica el tratamiento con albendazol, que continuó en la planta.
Conclusión
El conocimiento de las patologías que se creían erradicadas del denominado “primer mundo” es esencial para los especialistas de un mundo globalizado, así como el tratamiento de las complicaciones derivadas de las mismas.
Bibliografía
1. BOE.es – Documento BOE-A-2015-2837, https://www.boe.es/diario_boe/txt.php?id=BOE-A-2015-2837 (accessed 16 June 2020).
2. Brunetti E, Kern P, Vuitton DA. Expert consensus for the diagnosis and treatment of cystic and alveolar echinococcosis in humans. Acta Trop. 2010; 114: 1–16. (PubMed)
3. Eckert J. Guidelines for treatment of cystic and alveolar echinococcosis in humans. Bull World Health Organ. 1996; 74: 231–242. (PubMed)
4. Salama H, Abdel-Wahab MF, Strickland GT. Diagnosis and Treatment of Hepatic Hydatid Cysts with the Aid of Echo-Guided Percutaneous Cyst Puncture. Clin Infect Dis. 1995; 21: 1372–1376. (PubMed)
5. Men S, Cuneyt Y, Arda IS, et al. Cysts : An Alternative to Surgery health. 1999; 83–89. (AJR)
6. Akhan O, Salik AE, Ciftci T, Akinci D, et al. Comparison of long-term results of percutaneous treatment techniques for hepatic cystic echinococcosis types 2 and 3b. Am J Roentgenol. 2017; 208: 878–884. (AJR)



Se hecha de menos que los autores no hagan referencia al Síndrome hipersomolar e hiperglucemico.
Tampoco se entiende no estimar el **gap osmolar** es decir que los autores no midieran la osmolalidad plasmática (mOsm/Kg) frente a la calculada (mOsm/L). De igual modo la densidad y osmolaridad urinaria dan otra evaluación (renal) del cuadro clínico.
Mejor que la tomografia encefálica es la resonanica magnética, para estimar (micro)lesiones hidatídicas y/o por hipernatremia e incluso descartar la mielinolisis central pontina y/o extrapontina (atribuida clásicamente a una restauración rápida de la hiponatremia, pero que puede surgir en otras diselectrolitemias).
Finalmente, en el deterioro neurológico del paciente hay que considerar la epilepsia subclínica no consulsiva.