Piano A, Zurita Santisteban R, Bernal Basurto R, Muñoz Corchuelo CM
Servicio de Anestesiología y Reanimación del Hospital Universitario Torrecárdenas, Almería.
Cómo citar este artículo: Piano, A., Zurita Santisteban, R., Bernal Basurto, R., & Muñoz, C. M. (2023). Edema cerebral y manejo de la presión intracraneal. Revista Electrónica AnestesiaR, 15(7). https://doi.org/10.30445/rear.v15i7.1153
Introducción
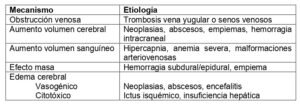
El edema cerebral es una complicación patológica potencialmente fatal en el contexto de muchas lesiones neurológicas. Esta entidad, entre otras causas (tabla 1), está íntimamente relacionada con el aumento de la presión intracraneal, un fenómeno frecuente en pacientes neurocríticos que precisa tratamiento urgente.
El objetivo de este artículo es revisar la fisiopatología del edema cerebral y su papel en el aumento de la presión intracraneal, así como abordar las posibles medidas que se pueden tomar en las unidades de cuidados críticos.
Para su realización se ha realizado una revisión literaria de los trabajos publicados en la base de datos Pubmed entre 2012 y abril 2022 usando como palabras claves “cerebral edema”, “intracranial hypertension”, “brain compression”, “neurocritical care”.
Tipologías de edema cerebral
El término edema cerebral hace referencia esencialmente a un aumento en el contenido de agua del cerebro que conduce a la expansión del volumen cerebral.
Las dos formas más frecuentes son:
- Edema vasogénico: se observa en caso de neoplasias (gliomas, meningiomas y metástasis), abscesos o encefalitis. Se caracteriza por la extravasación y acumulación extracelular de líquido en el parénquima cerebral secundaria a la ruptura de la barrera hematoencefálica que se produce por acción de moléculas como el factor de crecimiento endotelial vascular (VEGF), producido por las células tumorales, la hipoxia y la acidosis focal (típicos de los microambientes tumorales), ciertas prostaglandinas (IL-1) y el óxido nítrico (1,2).
- Edema citotóxico: se caracteriza por la acumulación intracelular de líquido y sodio que provoca la hinchazón de las células y se produce en caso de isquemia cerebral o insuficiencia hepática fulminante.
El edema cerebral puede afectar solo a algunas zonas del cerebro de forma focal, o puede difundir, desde zonas de baja resistencia (sustancia blanca) a zonas de alta resistencia (sustancia gris), afectando al parénquima de forma difusa (2).
Hipertensión craneal
El compartimento intracraneal, protegido por una estructura rígida que es el cráneo, incluye de forma fisiológica tres componentes: el parénquima cerebral, el líquido cefalorraquídeo y la sangre.
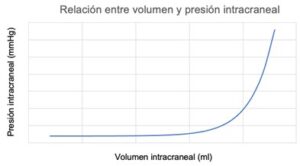
Dado que el volumen total de la bóveda craneal no puede cambiar, un aumento del volumen de uno de los componentes o la presencia de componentes patológicos (masas, hematomas, abscesos…), implica un desplazamiento de las estructuras y/o un aumento de la presión intracraneal; todo esto según el volumen y la compliancia de cada componente, como se refleja en la teoría de Monro-Kellie.
La relación entre cambio de volumen y de presión (compliancia) no es lineal, dado que inicialmente determinados mecanismos compensatorios permiten aumentos de volumen con mínimas elevaciones de la presión (Imagen 1).
La presión intracraneal normalmente es ≤15mmHg, considerándose hipertensión cuando se alcanzan valores ≥22mmHg (3).
Las últimas publicaciones insisten en considerar de forma más global la interacción dinámica entre los componentes, prefiriendo analizar la morfología de la onda de la presión intracraneal (que aporta información sobre la compliancia dinámica de todo el compartimiento intracraneal) al uso de valores numéricos como umbral para decidir la actitud terapéutica; de esta manera ya no se hablaría de hipertensión intracraneal sino de “Síndrome Compartimental Intracraneal” (4).
Con cada latido cardíaco, una pequeña cantidad de sangre arterial entra en el cráneo; este proceso da como resultado una forma de onda característica en el monitor de la presión intracraneal con tres picos: P1 (sístole cardíaca), P2 (contenido intracraneal desplazado que encuentra resistencia de las estructuras cerebrales menos distensibles) y P3 (onda dícrota del cierre de la válvula aórtica). Normalmente, P1 es mayor que P2, que es mayor que P3. En las primeras fases de afectación de la compliancia, P2 se vuelve progresivamente mayor que P1. Cuando la compliancia se ve más comprometida, P1 y P2 comienzan a fusionarse (Imagen 2). Es importante reseñar que estos cambios en la morfología de la onda pueden observarse antes que los valores de la presión intracraneal superen el límite alto del rango de normalidad, por lo que el análisis de su contorno podría permitir una identificación más precoz de aquellos pacientes que desarrollarán hipertensión intracraneal (5).
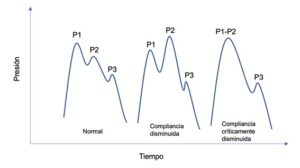
Presentación clínica de la hipertensión craneal
Las manifestaciones clínicas son a menudo inespecíficas y su severidad no está relacionada con el grado de hipertensión intracraneal.
Síntomas generales de este proceso son la cefalea, la disminución del nivel de consciencia y los vómitos.
Entre los signos se describen parálisis del VI par craneal (diplopía), papiledema, hematoma periorbital espontáneo y la triada de Cushing (bradicardia, alteración respiratoria e hipertensión).
Hay determinados síntomas específicos que se deben a los efectos locales de las lesiones o a síndromes de hernias cerebrales (tabla 2) (6,7).
Monitorización de la presión intracraneal
Dado que el aumento de la presión intracraneal está asociado a elevada mortalidad y que es cuestionable el inicio de tratamiento empírico ante la sospecha no confirmada de este cuadro, se explica la importancia de monitorizar la presión intracraneal, en determinados pacientes, con el objetivo de mantener una adecuada presión de perfusión cerebral (PPC). Esta presión es un parámetro de estimación del flujo sanguíneo cerebral y se define como la tensión arterial media (TAM) menos la presión intracraneal (PIC) (PPC=TAM-PIC).
En algunos pacientes, como en el caso de traumatismos craneoencefálicos, se ha observado que la monitorización de este parámetro está relacionada con una disminución de mortalidad (8).
Para medir la presión intracraneal existen métodos invasivos y no invasivos.
En la medición invasiva se usan catéteres especiales que se colocan directamente en cuatro posibles sitios anatómicos: intraventricular, intraparenquimatoso, subaracnoideo o epidural.
Los catéteres intraventriculares son los más usados y se consideran el gold standard, siendo su medición la más precisa y la que más representa la presión intracraneal global. Además, permiten el drenaje de líquido cefalorraquídeo. En contraposición presentan un mayor riesgo de infección y hemorragia.
Por estos motivos se suelen colocar sólo en pacientes con elevado riesgo de hipertensión craneal, en pacientes comatosos o diagnosticados de procesos que precisan medición agresiva (9).
Los métodos no invasivos (tabla 3) pueden sustituir las mediciones invasivas o también ser útiles como herramientas complementarias para valorar si colocar catéteres invasivos. Sin embargo, la calidad de la evidencia que los avala es todavía en algunos casos limitada (7).
Métodos complementarios a la medición de la presión intracraneal
Los avances en el conocimiento de la fisiopatología de las lesiones cerebrales agudas han permitido el desarrollo de nuevas herramientas diagnósticas que aportan información sobre el nivel de adecuación de la perfusión cerebral.
Estos métodos se centran en el estudio de parámetros metabólicos y son útiles en el manejo de los síndromes compartimentales intracraneales (4,7).
- Presión parcial tisular cerebral O2 (PbtO2) (normal >20mmHg): microcatéteres en la sustancia blanca permiten identificar reducción de la perfusión (<10mmHg) o hiperemia (>30mmHg) cerebral.
- Saturación de oxigeno venoso yugular (SjvO2): catéteres colocados en el bulbo yugular por vía retrógrada, estiman el balance entre entrega y consumo de oxígeno. El aumento de la presión intracraneal está relacionado con la reducción de la saturación de oxígeno venoso yugular (<50% durante 10 minutos se considera “desaturación cerebral”).
- Microdiálisis cerebral: Sonda intraparenquimatosa colocada de manera similar a una sonda de PbtO2 que permite la medición de glucosa extracelular, lactato, piruvato y glutamato. Los cambios metabólicos suelen preceder a los cambios clínicos de la hipertensión intracraneal.
- Espectroscopia cercana al infrarrojo (NIRS): herramienta no invasiva de oxigenación cerebral. Uso limitado por falta de estudios que identifiquen un nivel claro de hipoxia cerebral.
Manejo de la hipertensión intracraneal
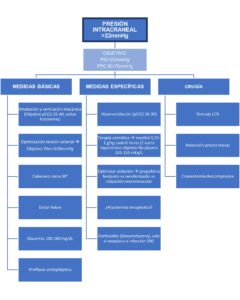
Gracias al conocimiento más profundo de los mecanismos fisiopatológicos y a las monitorizaciones más precisas, se busca cada vez más una intervención individualizada para cada paciente, enfocando los esfuerzos para evitar daños secundarios durante lesiones cerebrales agudas, siendo el principal tratamiento de la hipertensión intracraneal la resolución de la causa principal (evacuación de hematomas, resección de masas…) del aumento de la presión intracraneal. Pero, dado que la hipertensión intracraneal es una emergencia médica hay que instaurar cuanto antes medidas para reducirla, siendo el objetivo según las últimas guías (7) mantener la presión intracraneal <22mmHg y una presión de perfusión cerebral >60mmHg.
Las medidas terapéuticas se dividen en medidas generales básicas, que hay que aplicar en todo paciente con sospecha o riesgo de desarrollar hipertensión intracraneal, y medidas agudas específicas, que se instauran de forma escalonada (2,4–7,10–13).
Medidas generales básicas
- Intubación y ventilación mecánica: de forma precoz en pacientes comatosos, permite el control de factores como la agitación y las convulsiones que podrían empeorar la hipertensión intracraneal. Inicialmente habría que evitar la hipoxemia y la hiper e hipocapnia (objetivo PCO2 35-40 mmHg).
Un correcto manejo ventilatorio podría mejorar la recuperación neurológica con reducción de la estancia hospitalaria.
Las últimas guías (14) permiten el uso de PEEP aunque no hay claras evidencias sobre su efecto sobre la presión intracraneal.
- Optimización tensión arterial – presión de perfusión cerebral: se debe evitar la hipotensión, especialmente en aquellos pacientes con alteración de la autorregulación, por el riesgo aumentado de isquemia secundaria a la reducción de la presión de perfusión cerebral. El objetivo es evitar la hipovolemia/hipotensión evitando el uso de sueros hipotónicos (como glucosa 5%, salino al 0,45%) prefiriendo los cristaloides a los coloides. El tratamiento de la hipotensión puede requerir vasopresores, sobre todo en el contexto de sedación.
La hipertensión, hay que tratarla (sobre todo con tensión arterial media>100mmHg) con agentes de vida media corta como labetalol o nicardipino. Según las últimas guías (7) el objetivo es mantener una presión de perfusión cerebral entre 60 y 70 mmHg (aumento de supervivencia y outcomes favorables).
- Posición del cuerpo: para favorecer el flujo de sangre venosa que sale del cráneo. Se recomienda elevar la cabecera de la cama a 30°, y mantener la cabeza del paciente en posición neutra en línea media, así como evitar aquellos estímulos que puedan producir tos o respuesta de Valsalva (como la aspiración endotraqueal).
- Control temperatura: la temperatura corporal elevada influye sobre la presión intracraneal aumentando la demanda metabólica cerebral y el flujo sanguíneo cerebral. Por esta razón hay que evitar la fiebre (objetivo normotermia 36-37°C) usando antipiréticos intravenosos (paracetamol) y medidas físicas.
- Control glucémico: la hiperglucemia está asociada a aumento de mortalidad en pacientes con traumatismo craneoencefálico. Las cifras de glucemia deberían mantenerse entre 100 y 180 mg/dL.
- Profilaxis antiepiléptica: las crisis epilépticas pueden complicar o ser responsables del aumento de presión intracraneal. El tratamiento debe empezarse ante la sospecha de convulsiones, reservando la profilaxis para los pacientes de alto riesgo de sufrir crisis (masas supratentoriales corticales, lesiones cercanas a la corteza como hematomas subdurales o subaracnoideas), aunque no hay claras indicaciones en las guías clínicas.
Medidas agudas específicas
Son las medidas que se instauran en las fases agudas de la hipertensión craneal con el objetivo de reducir la presión intracraneal.
- Hiperventilación: bajar la PCO2 a 26-30mmHg es un método rápido y eficaz para reducir la presión intracraneal (vasoconstricción con reducción del volumen sanguíneo cerebral) pero su efecto suele durar <24 horas (cuando se instauran mecanismos de compensación del pH). Es importante no finalizar esta maniobra de forma muy rápida para evitar el efecto rebote con vasodilatación cerebral.
Esta medida debería evitarse en caso de traumatismo craneoencefálico o ictus isquémico sobre todo en las primeras 24-48h, cuando la vasoconstricción podría empeorar la lesión neurológica.
- Terapia osmótica: es uno de los pilares del tratamiento de la hipertensión craneal. Los principales agentes osmóticos son el manitol y el suero salino hipertónico. Permiten la disminución del volumen cerebral removiendo agua libre del edema del tejido cerebral e introduciéndola en la circulación sistémica para eliminarla a través de los riñones. Esta medida necesita una membrana hematoencefálica intacta para evitar que estos medicamentos pasen al tejido intersticial cerebral e inviertan el gradiente osmótico.
El suero hipertónico se está recomendando como medicamento de primera elección por mantener la estabilidad hemodinámica cerebral y sistémica y sobre todo por su eficacia en bajar la presión intracraneal, aunque no se haya demostrado que mejore los resultados clínicos comparado con el manitol (11).
Se han estudiado varias formas de administración de suero hipertónico en perfusión continua o bolo en diferentes concentraciones (entre 3 y 23,4%) sin haberse demostrado un claro beneficio con una estrategia o con otra. Los bolos podrían administrarse en situaciones agudas y se pueden repetir hasta conseguir un descenso de la presión intracraneal y/o una concentración plasmática de sodio entre 145-155 mEq/L.
El manitol, un diurético osmótico antiguamente considerado de primera línea en el tratamiento de la hipertensión intracraneal, está indicado a una dosis de 0,25-1 g/kg cada 6 horas. Su efecto se observa en unos 30 minutos, con pico en 1 hora y duración del efecto entre 4 y 24 horas.
El objetivo es alcanzar una osmolaridad plasmática entre 310 y 320 mOsm/L.
El manitol se elimina completamente con la orina y puede causar necrosis tubular aguda, hipotensión y alteraciones electrolíticas, por eso está contraindicado en caso de fracaso renal.
La decisión sobre usar un medicamento u otro muchas veces depende de las características del paciente, si precisa expansión de volumen (suero hipertónico) o forzar diuresis (manitol).
Durante el tratamiento con estos medicamentos es muy importante vigilar de forma periódica el sodio y el cloro plasmáticos, la osmolaridad plasmática y la función renal.
- Optimizar sedación: la asincronía respiratoria y la agitación pueden aumentar la presión intratorácica y reducir el retorno venoso torácico, aumentando así la congestión venosa cerebral. Además, la agitación puede aumentar la presión arterial sistémica, con repercusión sobre los sistemas de autorregulación cerebral, e incrementar la tasa metabólica cerebral.
El propofol es el fármaco de elección para la sedación de pacientes con hipertensión intracraneal, aunque no haya demostrado mejorar la mortalidad o los resultados clínicos a los 6 meses. Sus ventajas residen en una óptima calidad de sedación, en el rápido inicio de acción y la corta vida media que permite valoración neurológica diaria, así como un aumento del umbral convulsivo. La principal desventaja es la repercusión hemodinámica que puede precisar resucitación con líquidos o vasopresores.
Las benzodiacepinas, por su lenta metabolización, sobre todo en personas mayores, no están aconsejadas como primera opción.
Dado que el dolor puede aumentar la presión intracraneal, sobre todo en casos de traumatismos craneoencefálicos, puede ser muy útil la coadministración de fármacos como el fentanilo o remifentanilo (preferido por sus características farmacodinámicas).
La dexmedetomidina se está estudiando como alternativa para la sedación de estos pacientes, pero no hay evidencias que avalen su uso clínico (15).
En caso de dificultad para el control de agitación, temblores o dificultad ventilatoria podría valorarse el uso de bloqueantes neuromusculares (rocuronio, cisatracurio).
Los barbitúricos (tiopental, pentobarbital), por su capacidad de reducir el metabolismo cerebral con reducción de flujo sanguíneo cerebral, pueden usarse en caso de fracaso de otras medidas. Permiten reducir la presión intracraneal, pero sin un impacto significativo en los resultados clínicos de estos pacientes. Pueden producir hipotensión y dadas sus largas vidas medias no permiten valoraciones neurológicas frecuentes y necesitan control continuo con electroencefalografía.
- Hipotermia terapéutica: es un tema controvertido. Actualmente no está indicado como tratamiento standard de la hipertensión craneal, pero podría usarse como tratamiento de rescate en caso de hipertensión craneal refractaria a otras medidas. La hipotermia reduce el metabolismo cerebral y de esa forma disminuye el flujo sanguíneo cerebral y la presión intracraneal. No se han establecido el objetivo óptimo de temperatura ni su duración, y todavía no se ha demostrado que mejore los resultados clínicos. Antes de usar hipotermia sistémica, que tiene efectos secundarios severos, como coagulopatía y arritmias cardíacas, se podría optar por enfriamiento regional cerebral.
- Corticoides: no indicados en caso de traumatismo craneoencefálico (empeoran supervivencia), ictus isquémico y hemorragia cerebral. Pueden tener un papel importante en caso de edema cerebral vasogénico por neoplasia o en caso de infecciones del sistema nervioso central. El mecanismo de acción en la reducción del edema vasogénico y como consecuencia de reducción de la presión intracraneal no está del todo claro, pero parece que estos fármacos aumentan la producción de factores que estabilizan la barrera hematoencefálica y reducen la producción de factores como VEGF. El medicamento más usado, por su potencia y escasa actividad mineralcorticoide, es la dexametasona. Los efectos antiedema, así como los efectos secundarios, son dosis dependientes. En caso de edemas moderados-severos se recomienda una dosis inicial de 10 mg de dexametasona seguido de un mantenimiento de 16 mg/día dividido en 2-4 dosis.
En caso de edema peritumoral la mejora se suele observar ya en las primeras horas de tratamiento, con máximo efecto en torno a las 24-72 horas.
Si se consigue una buena respuesta clínica se puede plantear un descenso progresivo de la dosis (por ejemplo, reducción de dosis del 50% cada 4 días).
Tratamientos quirúrgicos
Las medidas quirúrgicas acompañan a menudo las medidas médicas en los pacientes críticos con hipertensión craneal, y representan uno de los métodos más eficaces en la reducción de la presión intracraneal, sobre todo en caso con compliancia intracraneal disminuida.
- Drenaje líquido cefalorraquídeo: una de las técnicas más usadas para reducir la presión intracraneal. A través de una derivación ventricular externa, se permite el drenaje de unos ml de líquido cefalorraquídeo con un rápido descenso de la presión. Es importante drenar de forma muy lenta el líquido cefalorraquídeo (por ejemplo, por gravedad o con aspiración lenta 1-2ml/min en tandas de 2-3 minutos). Habitualmente la colocación de un drenaje lumbar está contraindicada en casos de hipertensión craneal por el riesgo de herniación transtentorial.
- Resección precoz de masas: la cirugía precoz con resección de la masa (hemorragia, neoplasia o absceso) que causa el cuadro de hipertensión craneal está relacionada con mejores resultados clínicos a 6 meses (16). Esto está descrito sobre todo en caso de hemorragias cerebelosas con compresión del tronco encefálico u obstrucción ventricular, pero también se podría valorar en caso de hematomas subdurales, epidurales, abscesos o neoplasias.
- Craneotomía descompresiva: la idea es crear una gran ventana ósea en la bóveda craneal para aumentar la compliancia intracraneal. Está indicada sobre todo en caso de hipertensión craneal secundaria a ictus isquémico (17) pero puede ser útil también en traumatismos craneoencefálicos y hemorragias subaracnoideas en casos seleccionados.
Otras posibles medidas
Se están investigando nuevas medidas para controlar el aumento de la presión intracraneal, y se están desarrollando modelos matemáticos para intentar prever posibles elevaciones de la presión intracraneal (18). Se están ensayando fármacos ya conocidos como la progesterona, que podría tener un efecto protector sobre el desarrollo de edema vasogénico tumoral, o el oxígeno hiperbárico. Además, se encuentran en fase de estudio fármacos biológicos inhibidores de VEGF como bevacizumab u otras moléculas (como la glibenclamida) con posibles efectos positivos en casos de edemas citotóxicos (1). En los últimos años se ha descrito también el sistema glinfático (glial-linfático) que podría tener un papel en el desarrollo de edema cerebral (5).
En el algoritmo 1 se resumen las medidas indicadas en el manejo de la hipertensión intracraneal.
Conclusión
Conocer las bases fisiopatológicas del edema cerebral y de los mecanismos de aumento de la presión intracraneal es importante para cualquier profesional sanitario que trabaje con pacientes neurocríticos dado que son entidades que se asocian a pronósticos a menudo infaustos. Por eso es fundamental reconocer las manifestaciones clínicas de la hipertensión craneal y actuar de forma muy rápida en caso de sospecha o confirmación de aumento de la presión intracraneal, emprendiendo medidas básicas o específicas. Aunque el tratamiento definitivo en muchas ocasiones es quirúrgico, no hay que subestimar la importancia del manejo de los cuidados intensivos disponibles en la actualidad: a pesar de que sean medidas inespecíficas y a veces limitadas que se basan en los principios fisiológicos, pueden tener un papel relevante en la disminución de la presión intracraneal.
El objetivo en los próximos años será intentar individualizar cada vez más la monitorización de la presión intracraneal para personalizar el tratamiento a las características de los pacientes, quizás añadiendo nuevos fármacos más específicos para cada entidad patológica.
Referencias
1. Michinaga S, Koyama Y. Pathogenesis of brain edema and investigation into anti-edema drugs. Int. J. Mol. Sci. 2015 (16)9949–75. (MDPI)
2. Esquenazi Y, Lo VP, Lee K. Critical Care Management of Cerebral Edema in Brain Tumors. J Intensive Care Med 2017;32(1):15–24. (PMC)
3. Sorrentino E, Diedler J, Kasprowicz M, Budohoski KP, Haubrich C, Smielewski P, et al. Critical thresholds for cerebrovascular reactivity after traumatic brain injury. Neurocritical Care. 2012;16(2):258–66. (PubMed)
4. Rubiano AM, Figaji A, Hawryluk GW. Intracranial pressure management: moving beyond guidelines. Curr Opin Crit Care [Internet]. 2022;28(2):101–10. Available from: https://journals.lww.com/10.1097/MCC.0000000000000920
5. Liotta EM. Management of Cerebral Edema, Brain Compression, and Intracranial Pressure. Continuum (Minneap Minn). 2021;27(5):1172-1200. doi:10.1212/CON.0000000000000988 (HTML)
6. Kewon L. The NEURO ICU book. McGraw-Hill Medical. 2012
7. Schizodimos T, Soulountsi V, Iasonidou C, Kapravelos N. An overview of management of intracranial hypertension in the intensive care unit. Vol. 34, Journal of Anesthesia. Springer Japan; 2020. p. 741–57. (HTML)
8. Carney N, Totten AM, O’Reilly C, Ullman JS, Hawryluk GWJ, Bell MJ, et al. Guidelines for the Management of Severe Traumatic Brain Injury, Fourth Edition. Neurosurgery. 2017 Jan 1;80(1):6–15. (PubMed)
9. le Roux P, Menon DK, Citerio G, Vespa P, Bader MK, Brophy GM, et al. Consensus summary statement of the International Multidisciplinary Consensus Conference on Multimodality Monitoring in Neurocritical Care: A statement for healthcare professionals from the Neurocritical Care Society and the European Society of Intensive Care Medicine. Intensiv Care Med 2014 (4)1189–209. (HTML)
10. Chesnut RM, Temkin N, Videtta W, Petroni G, Lujan S, Pridgeon J, et al. Consensus-Based Management Protocol (CREVICE Protocol) for the Treatment of Severe Traumatic Brain Injury Based on Imaging and Clinical Examination for Use When Intracranial Pressure Monitoring Is Not Employed. J Neurotrauma. 2020;37(11):1291–9. (PubMed)
11. Chen H, Song Z, Dennis JA. Hypertonic saline versus other intracranial pressure–lowering agents for people with acute traumatic brain injury. Emergencias. 2021;33(3):218–9. (HTML)
12. Roquilly A, Moyer JD, Huet O, Lasocki S, Cohen B, Dahyot-Fizelier C, et al. Effect of Continuous Infusion of Hypertonic Saline vs Standard Care on 6-Month Neurological Outcomes in Patients with Traumatic Brain Injury: The COBI Randomized Clinical Trial. JAMA 2021;325(20):2056–66. (PubMed)
13. Cook AM, Morgan Jones G, Hawryluk GWJ, Mailloux P, McLaughlin D, Papangelou A, et al. Guidelines for the Acute Treatment of Cerebral Edema in Neurocritical Care Patients. Neurocritical Care. 2020 Jun 1;32(3):647–66. (PubMed)
14. Robba C, Poole D, McNett M, Asehnoune K, Bösel J, Bruder N, et al. Mechanical ventilation in patients with acute brain injury: recommendations of the European Society of Intensive Care Medicine consensus. Intensiv Care Med 2020;46(12):2397–410. (HTML)
15. Schomer KJ, Sebat CM, Adams JY, Duby JJ, Shahlaie K, Louie EL. Dexmedetomidine for Refractory Intracranial Hypertension. J Intensiv Care Med. 2019;34(1):62–6. (PubMed)
16. Mendelow AD, Gregson BA, Rowan EN, Murray GD, Gholkar A, Mitchell PM, et al. Early surgery versus initial conservative treatment in patients with spontaneous supratentorial lobar intracerebral haematomas (STICH II): A randomised trial. The Lancet. 2013;382(9890):397–408. (PubMed)
17. Powers WJ, Rabinstein AA, Ackerson T, Adeoye OM, Bambakidis NC, Becker K, et al. Guidelines for the early management of patients with acute ischemic stroke: 2019 update to the 2018 guidelines for the early management of acute ischemic stroke a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2019;50:E344–418. (PubMed)
18. Schweingruber N, Mader M, Wiehe A, Röder F, Göttsche J, Kluge S, et al. A recurrent machine learning model predicts intracranial hypertension in neurointensive care patients. Brain. 2022 Aug 27;145(8):2910-2919. doi: 10.1093/brain/awab453. PMID: 35139181; PMCID: PMC9486888. (PMC)





Excelente revisión sobre las causas .las alternativas de monitoreo de la presión intracraneal y los avances en el manejo de la hipertensión endocraneana y el edema cerebral
El manuscrito con título “Edema cerebral y manejo de la presión intracraneal” narrado por los autores: Piano A, Zurita Santisteban R, Bernal Basurto R, Muñoz Corchuelo CM. Servicio de Anestesiología y Reanimación del Hospital Universitario Torrecárdenas, Almería; y publicado en la Revista electrónica Anestesiar (ReaR), ISNN 1989 4090, en el apartado de “Críticos” el 17 octubre 2022; con acceso online en el portal Web [https://anestesiar.org/2022/edema-cerebral-y-manejo-de-la-presion-intracraneal/]; no describe asuntos relevantes tanto actualizados como para un manejo efectivo en neuroanestesiología y/o neurocrítico, de dicha neuropatología.
En primer lugar el autor(s) debe referirse al manejo del edema encefálico en el paciente ADULTO, ya que el pediátrico presenta otras características.
Se sugiere que el autor(s) considere algunos errores gramaticales y ortográficos del manuscrito: conciencia (Consciencia), decerebración (Descerebración), oxigeno (Oxígeno). Es aconsejable evitar anglicismo: standard (estándar) y vocablos médicos no apropiados: agentes (fármacos). Mas adecuado es utilizar el término global “encéfalo” que el regional “cerebro” que equivale al telencéfalo (hemisferios cerebrales), puesto que se define traumatismo craneoencefálico y no traumatismo craneocerebral. Al unisono ocurre con neuroprotección (aplicación pre-lesión) y neurorrescate (aplicación post-lesión). El autor(s) debe describir los acrónimos al inicio de su utilización, p. ej. PEEP.
Una vez más, hiper/ hipocapnia (CO2ET) no es equivalente a hiper/ hipocapmia (PaCO2), respectivamente. Es más correcto -capmia (PaCO2) que -capnia (CO2ET), ya que entre ambos parámetros existe un gradiente fisiológico, que se incrementa más aún en presencia de patología (pulmonar, hipotensión arterial, enfriamiento, etc.).
El autor(s) en la “Tabla 1: Causas de hipertensión intracraneal”, describe las malformaciones arteriovenosas encefálicas (MAVe). Sin embargo, esta neuropatología, es rarísimo que per se incremente la PIC; si la hace es por el sangrado (hemorragia intraparenquimatosa / subaracnoidea / ventricular) tras ruptura de la MAVe.
Respecto a los tipos de edema encefálico, hay que ir más allá de la clasificación de Igor Klatzo en 1967 en vasogénico (wet) y citotóxico (dry). [Mahajan S, et al. Cerebral oedema: Pathophysiological mechanisms and experimental therapies. J Neuroanaesthesiol Crit Care 2016;3:22-28. DOI: 10.4103/2348-0548.174731]. El autor(s) se olvida del periventricular (intersticial) o transependimario. Así mismo en la clasificación fisiopatológica se conocen otros tipos de edema: hidrostático, osmótico, y neuroexcitóxico de Marmarou, así como el de altitud y el iónico/hemorrágico de la clasificación de Fishman. [Fishman RA. Brain edema. N Engl J Med. 1975;293(14):706-11. doi: 10.1056/NEJM197510022931407]. (Figura 1).
Por otro lado, hay que diferenciar entre “brain edema” y “brain swelling” («Hirn- schwellung» de Reichardt TM en 1905), de ahí que lo más correcto es hablar de tumefacción o hinchazón encefálica, que significa un aumento del contenido encefálico; bien por acúmulo de agua/iones en el espacio extravascular (vasogénico, oncótico, transependimario, u otro) o por incremento del intravascular (cerebrovascular engorgement): arterial (hiperemia absoluta o relativa [D(a-vj)O2 baja], hipercapmia, hipoxia, fármaco neurovasodilatador, fallo de la autorregulación) y/o venoso [trombosis senos venosos, síndrome de vena cava superior, disección radical de cuello, PEEP (positive end-expiratory pressure) elevada, neumotórax, presión intrabdominal alta]. Por tanto, el vocablo de hinchazón o tumefacción encefálica engloba el término edema encefálico en sus distintas formas y el de congestión neurovascular (brain swelling) por aumento del volumen sanguíneo encefálico. [Scheinker IM. Cerebral swelling; histopathology, classification and clinical significance of brain edema. J Neurosurg. 1947;4(3):255-75. doi: 10.3171/jns.1947.4.3.0255]. Ejemplos de swelling brain son las situaciones de hiperemia (absoluta o relativa), el fenómeno circulatory breakthrough de la MAVe o el síndrome de reperfusión tras endarterectomía carotídea o trombectomía mecánica del ictus isquémico agudo de gran vaso. Se ha propuesto, que para reducir el compartimento vascular, se utilize la hiperventilación (optimizada) si la vasorreactividad-CO2 no se encuentra alterada y evitar la osmoterapia (manitol).
Para fines prácticos, el edema también puede clasificarse según su topografía en focal (tumor, hematoma, absceso, infarto, y otros) o difuso (asistolia, neurotrauma pediátrico, coma hepático, cetodiabético o urémico y otros). En las lesiones focales es frecuente la presencia de gradientes de PIC (compartimentación de la PIC), sugiriéndose insertar el sensor en el lado de la lesión.
El autor en la revisión fisiopatológica del edema encefálico debe considerar otros elementos cada vez más relevantes como el factor neurovascular y la población microglial. La injuria a la unidad neurovascular expandida (neuronas, astrocitos, células endoteliales, pericitos, células de músculo liso y matriz extracelular) y la reacción glial (gliosis reactiva y neuro-inflamación/inmunidad) postlesión son evidentes en el pronóstico del paciente. Dada la importancia de restaurar la función neurovascular y minimizar la neuroinflamación, la investigación emergente se centra en comprender la respuesta vascular/inflamatoria (p. ej: vasoespasmo) y los componentes, celulares y moleculares, claves de la reparación nerviosa. [Salehi A, et al. Response of the cerebral vasculature following traumatic brain injury. J Cereb Blood Flow Metab. 2017;37(7):2320-2339. doi: 10.1177/0271678X17701460].
En el manuscrito el autor(s) no se describe el diagnóstico diferencial por neuroimagen entre edema vasogénico y citotóxico. La tomografía axial computarizada (TAC) es poco útil en distinguir el vasogénico del citotóxico, pero es de fácil acceso técnico y permite identificar la causa subyacente del edema. La resonancia magnética (RM) presenta en la neuroimagen: T1 (baja señal), y T2 (señal brillante). En la secuencia FLAIR (fluid attenuated inverse ratio) se observa el edema intersticial (hidrocefálico) y la resonancia magnética de difusión (RMD) con base en su coeficiente de difusión aparente (CDA) (movimiento “browniano” de los protones de agua), permite diferenciar el tipo de edema, que es bajo en el citotóxico y alto en el vasogénico.
La espectroscopia por RM de protón mide las concentraciones de N-acetilaspartato (NAA) y con ello la disfunción mitocondrial, que puede resultar patológica en estadíos tempranos del edema citotóxico, aunque la neuroimagen no demuestre ninguna anormalidad. También es útil la RM ponderada por susceptibilidad paramagnética (SW-RMI: Susceptibility-weighted magnetic resonance imaging) en la detección de microhemorragias/microsangrados que con gran frecuencia acompañan al edema.
Otra técnica emergente en el estudio del edema cerebral es la bioimpedancia eléctrica y sus diferentes modalidades: la Bioimpedancia Eléctrica (EBI) básica, la Espectroscopia de Impedancia Eléctrica (EIS) y la Tomografía de Impedancia Eléctrica (EIT).
<a href="http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1815-59282021000200055" rel="nofollow ugc">http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1815-59282021000200055</a>
Entre los métodos de detección de marcadores plasmáticos están el neuropéptido B natriurético, la proteína C reactiva y la sustancia P; pues se han comprobado como marcadores de edema encefálico agudo durante isquemia cerebral.
Respecto a la fluidoterapia intravenosa, el objetivo es mantener la euvolemia (evitar deshidratación o sobrecarga hídrica) y una leve-moderada hiperosmolalidad plasmática (310 – 320 mOsm/Kg) “paciente saladito”. La cantidad será guiada por objetivos [variables dinámicas: variabilidad de presión de pulso (VPP); variabilidad de volumen sistólico VVS, y similares] para mantener la euvolemia. En la calidad se evitarán las disoluciones hipotónicas (ringer lactato, dextrosa 5%, ringer acetato, y otros). Por otro lado, la solución salina 0,9%, presenta una osmolaridad teórica (in vitro) de 308 mOsm/L, pero su osmolaridad medida (in vivo) efectiva es de 285 mOsm/L, debido a que no hay una disociación iónica total. Para evitar los efectos secundarios (acidosis, hipercloremia) de las soluciones cristaloides (ringer simple: 310 mOsm/L) se prefiere las disoluciones balanceadas (plasma-lyte®, isofundina®), ya que su pH es menos ácido y las concentraciones de sodio y cloro son más similares a las del plasma.
En el concepto de euvolemia también hay que considerar el factor anémico, aunque el umbral sea controvertido. Con base en la literatura disponible, la concentración óptima de hemoglobina para pacientes con lesiones neurológicas parece estar en el rango de 9,0 a 10,0 g/dL, aunque se deben sopesar los riesgos y beneficios individuales de la transfusión. [Kisilevsky A, et al. Anaemia and red blood cell transfusion in intracranial neurosurgery: a comprehensive review. Br J Anaesth. 2018;120(5):988-998. doi: 10.1016/j.bja.2017.11.108]. No obstante, a la hora de transfundir al paciente neurocrítico anémico, además de la Hb, se sugiere evaluar la relación aporte/consumo de oxígeno encefálico mediante neuromonitorización ad hoc [D(a-vj)O2. SjO2, PtiO2, láctico/pirúvico encefálico y otros) para minimizar la neuroisquemia anémica e incrementar la formación de edema citotóxico, pero sin olvidar los efectos secundarios de la transfusión (infección, aumento de viscosidad, futilidad, etc.). [Kramer AH, Zygun DA. Anemia and red blood cell transfusion in neurocritical care. Crit Care 2009;13:R89].
Se define la HTIC como valores mantenidos de PIC superiores a 22 mm Hg; pero en el caso de pacientes con cranectomía descompresiva superior a 5 cm o lesiones focales en el lóbulo temporal, valores de PIC superiores a 15 mm Hg. Es imprescindible definir la HTIC como una emergencia clínica, médica o quirúrgica, que pone en riesgo la vida del paciente.
El autor (s) en la imagen 1 representa la curva de Langfitt, es decir relación entre el volumen (eje X, variable independiente) y la presión intracraneal (eje Y, variable dependiente). Esta relación volumen-presión, se define como “elastancia (rigidez)” del saco duramadriano craneoespinal, y no la que refiere el autor (s) como “compliance (distensibilidad)”. Por otro lado, hay que resaltar la desviación a la izquierda de curva de Langfitt (> elastancia) cuando hay obstrucción a la libre circulación craneoespinal del LCR y el fenómeno de la compartimentación de la PIC con los gradientes intercompartimentales que provocan la “brain shift” y los errores en su monitorización.
El autor (s) describe la presión de perfusión encefálica (PPC) como la relación entre la presión arterial media (PAM) con transductor enrasado a polígono de Willis (conducto auditivo externo) y la presión intracraneal (PIC); pero se olvida del factor resistencia neurovascular (RVC), es decir de la autorregulación (p. ej.: curva de Lassen) y de la presión venosa encefálica (PVe):
PPC = [PAM – PIC] / RVC (si PVe normal)
PPC = [PAM – (PIC + PVe)] / RVC (si PVe aumentada)
Aunque el valor objetivo de PPC recomendado es de 60 a 70 mm Hg; no está claro si es el adecuado, ya que el umbral óptimo depende del estado de la autorregulación (presora, Tª, CO2, O2, Hb, fármacos, neurógena) del flujo sanguíneo encefálico (FSC). Además en adultos, deben evitarse los intentos agresivos de mantener la PPC >70 mm Hg con fluidos y/o vasopresores/inotrópicos, debido al riesgo de distrés respiratorio.
En relación al manejo de la Hipertensión Intracraneal (HTIC) y del edema asociado, las recomendaciones clínicas sugieren un terapia según su etiología causante más que una generalista [Cook AM, et al. Guidelines for the Acute Treatment of Cerebral Edema in Neurocritical Care Patients. Neurocrit Care. 2020;32(3):647-666. doi: 10.1007/s12028-020-00959-7]. Por otro lado, se ha evolucionado de la terapia orientada a bajar la PIC, a la guiada por PPC (terapia de Rosner y terapia de Lund) y, en la actualidad, a la manejada por autorregulación del FSC con índices ad hoc: a) Mx: índice de flujo medio, b) TOx: índice de reactividad de oxigenación total, c) ORx: índice de reactividad de oxígeno, d) PRx: índice de reactividad de presión, e) PAx: índice de amplitud de pulso de la PIC.
La estimación de estos índices de vasorreactividad, permite determinar el concepto de PPC óptima (PPCoptim): presión de perfusión cerebral a la cual, la autorregulación de cada paciente alcanza su mejor eficiencia posible. Cada paciente e incluso en un mismo paciente a lo largo del día, necesita una PPC diferente. La Brain Trauma Foundation (BTF) recomienda monitorizar la reactividad cerebrovascular (curva de Lassen) y estimar sus índices (PRx, PAx), con el objetivo de dirigir el tratamiento, basado en medicina de precisión, a las dianas PIC y PPC, para proporcionar un FSC adecuado a las necesidades metabólicas (acoplamiento óptimo); ya que ha demostrado que mejora los resultados clínicos del paciente [Jha RM, et al. Pathophysiology and treatment of cerebral edema in traumatic brain injury. Neuropharmacology. 2019;145(Pt B):230-246. doi: 10.1016/j.neuropharm.2018.08.004].
En cuanto a la hiperventilación como método para reducir la PIC elevada, solamente es efectiva si la vasorreactividad-CO2 neurovascular está preservada. Por otro lado, para minimizar la neuroisquemia; más que una hipocapmia (PaCO2) rutinaria o empírica, es más eficaz y efectiva la hipocapmia (PaCO2) optimizada según neuromonitorización ad hoc [(D(a-vj)O2, SjO2, PtiO2, Niroscopia u otro similar].
Para tratamiento de la hipertensión arterial grave y evitar el edema hidrostático por fallo de la autorregulación presora (curva de Lassen) se aconsejan aquellos fármacos (excepto contraindicación) sin efecto neurovasodilatador: esmolol, landiolol, labetalol y con cierta controversia: nicardipina, clevidipina y urapidilo
En cuanto a las convulsiones postneurotrauma grave las recomendaciones clínicas sugieren la profilaxis anticomicial para las crisis comiciales precoces, pero no para las tardías (>1 semana). Por otro lado, hay que considerar tanto la forma clínica convulsiva como la subclínica no convulsiva, p. ej.: la despolarización / depresión cortical propagada (DCP) y eventos DCP-like (despolarizaciones peri-infárticas) para minimizar la lesión nerviosa. Por tanto se requiere neuromonitorización, bien con EEG continuo o mejor la electrocorticografía (ECoG); así como su profilaxis y/o tratamiento específico [Sueiras M, Sahuquillo J, et al. Cortical spreading depolarization phenomena in patients with traumatic and ischemic brain injuries. Med Intensiva. 2014;38(7):413-21. doi: 10.1016/j.medin.2013.09.008].
Respecto a las neuroterapias específicas, el autor(s) deberá referir un tratamiento etiológico, p. ej. el edema transependimario (hidrocefalia), se sugiere ventriculostomía externa. Así mismo, el edema hidrostático y el osmótico requiere tratar al hipertensión arterial maligna y corregir el estado de hipo-osmolalidad, respectivamente.
Respecto a la osmoterapia, el autor (s) debe referenciar entre osmolaridad (mOsm/L) y osmolalidad (mOsm/Kg), equivalentes pero no iguales. Además del manitol 20% y el ClNa hipertónico: 3, 7,5, 10 y 23%; también debe mencionar otras disoluciones hipertónicas como el lactato sódico 0,5 M hipertónico [Ramos VY, et al. Osmoterapia en paciente con trauma cerebral severo. Rev Cub Med Int Emerg. 2018;17(Suppl: 2):63-56] y el piruvato sódico 2 M hipertónico [Saha B, et al. Therapeutic approach with Sodium Pyruvate on vital signs, acid-base, and metabolic disturbances in rats with a combined blast and hemorrhagic shock. Front Neurol. 2022;13:938076. doi: 10.3389/fneur.2022.938076].
Hay autores que administran tratamiento combinado (manitol y salino al 3%), pues parece que el salino al 3% compensa la hiponatremia e hipovolemia asociada al manitol y, por otro lado, el manitol ayuda a compensar el empeoramiento del edema vascular vasogénico que puede ocurrir con el uso prolongado del salino al 3%.
(<a href="https://www.aeped.es/sites/default/files/documentos/09_sind_hipertensivo.pdf" rel="nofollow ugc">https://www.aeped.es/sites/default/files/documentos/09_sind_hipertensivo.pdf</a>)
Una vez más hay que resaltar que la osmoterapia solamente es efectiva con unidad neurovascular no alterada. Asi mismo, es eficaz y efectiva en el edema de la fosa supratentorial, y apenas efectiva en la infratentorial; de ahí que se indica como “terapia puente” emergente hasta realizar la ventriculostomía externa o exéresis (craneotomía) de la lesión con efecto masa e incluso la cranectomía descompresiva infratentorial.
Con respecto a la sedo-analgesia del paciente, el autor(s) debe diferenciar entre dolor y nocicepción. Equivalentes pero con neurofisiopatología diferentes. La nocicepción (inconsciencia) se monitoriza (ANI: analgesia nocicepcion index, SPI: surgical pleth index, u otro), el dolor (consciencia) se evalúa con estadificación / gradación clínica.
Hasta la fecha, la osmoterapia y la descompresión quirúrgica siguen siendo los pilares de la HITC. Los conocimientos moleculares del edema encefálico proponen terapias emergentes para la profilaxis (minimizar la formación de edema) y/o tratamiento (edema ya instaurado) antiedema. Múltiples receptores, transportadores de iones y canales se han implicado en la formación del edema, incluidos: antagonistas NKCC1 (bumetanida, torsemida), inhibidores / activadores de acuaporina-4 (piroxicam, AER-271, aquaporumab), antagonistas de receptores de vasopresina (conivaptan), inhibidores de metaloproteinasas de matriz, inhibición de esfingosina-1-fosfato, inhibidores del canal SUR1 / TRPM4 (Sulfonyl Urea receptor-1 / Transient receptor potential melastatin-4): gGlibenclamide (glyburide), antagonistas de receptores de endotelina (ETA /ETB-R), inhibición/activación del VEGF (vascular endothelial growth factor) subtipo A y B (bevacizumab). Los datos preclínicos y clínicos actuales se han mostrado prometedores en la modulación de estos receptores como posible objetivo terapéutico antiedema encefálico. [Pergakis M, et al. An update on the pharmacological management and prevention of cerebral edema: current therapeutic strategies. Expert Opin Pharmacother. 2021;22(8):1025-1037. doi: 10.1080/14656566.2021.1876663]. [Mahajan S, Bhagat H. Cerebral oedema: Pathophysiological mechanisms and experimental therapies. J Neuroanaesthesiol Crit Care 2016;3:22-28].
En cuanto al manejo de la temperatura del paciente, el autor(s) debe considerar el gradiente térmico entre la temperatura central y la encefálica. En el ser humano sano, donde la temperatura central (esofágica, arteria pulmonar) suele ser <37 °C, la temperatura media del encéfalo es de 38,5 °C, y las regiones encefálicas más profundas suelen superar los 40 °C durante el día, sobre todo en mujeres. Por tanto, la variación diaria rítmica de la temperatura encefálica, no su temperatura absoluta, es la forma en la que la fisiología térmica del encéfalo se distingue de la fisiopatológica. [Rzechorzek NM, et al. A daily temperature rhythm in the human brain predicts survival after brain injury. Brain. 2022;145(6):2031-2048. doi: 10.1093/brain/awab466].
En cuanto al coma farmacológico inducido [barbitúrico (tiopental, fenobarbital), propofol] en la terapia de la HITC; el coma barbitúrico, guiado por EEG, se define mediante (burst suppression pattern; Swank and Watson, 1948) un patrón de salvas de supresión: >5 salvas/minuto. Una alternativa al EEG, es la utilización del índice biespectral (BIS), ya que hay buena correlación entre el EEG (patrón 3-5 salvas/min) con valores promedio de BIS 15 y Tasa de supresión 75%. La medición de niveles plasmáticas de barbitúricos tiene dos problemas: la gran variabilidad intra e interindividual por los fenómenos de inducción enzimática (tolerancia) y la existencia de metabolitos activos (acumulación).
Respecto al propofol, el autor(s) debe citar el síndrome de infusión por propofol (SIP), ya que su administración puede ser prolongada, más aún en neurocríticos. [Hemphill S, et al. Propofol infusion syndrome: a structured literature review and analysis of published case reports. Br J Anasth. 2019; 122(4): 448-459. doi:10.1016/j.bja.2018.12.025]
Finalmente, tanto en el texto del manuscrito, como en el Algoritmo 1 (Medidas de hipertensión craneal), se considera que en situaciones HITC refractaria a la terapia médica, entre las medidas de segundo nivel se encuentra la cranectomía descompresiva (CD), es decir cranectomía osteoclástica con duratomía amplia y plastia de duramadre (la craneotomía en general es osteoplástica). [Hawryluk GWJ, et al. Guidelines for the Management of Severe Traumatic Brain Injury: 2020. Update of the Decompressive Craniectomy Recommendations. Neurosurgery. 2020;87(3):427-434. doi: 10.1093/neuros/nyaa278]. Las controversias de la CD son el momento adecuado (timing) de ejecutarla y el tipo a realizar: hemicranectomía, cranectomía bifrontal e incluso cranectomía bifronto-témporo-parieto-occipital. Según su objetivo la CD se divide en primaria (evacuación de lesión efecto masa y descompresión: retirada de colgajo óseo y duraplastia) y secundaria cuando la descompresión se realiza para controlar la HITC tras fracaso de la primera línea terapéutica (edema encefálico maligno). La CD reduce el riesgo de muerte, pero aumenta la discapacidad funcional y por tanto las cargas asistenciales.
[Gantner D, et al. Decompressive Craniectomy Practice following Traumatic Brain Injury in Comparison with Randomized Trials: Harmonized, Multi-Center Cohort Studies in Europe, the United Kingdom, and Australia. J Neurotrauma. 2022;39(11-12):860-869. doi: 10.1089/neu.2021.0312].
Figura 1.- Clasificación del Edema Encefálico:
CITOTÓXICO VASOGÉNICO INTERSTICIAL OSMÓTICO HIDROSTÁTICO EXCITOTÓXICO
Alteración Alteración de Traspaso de Aumento Elevación del Neuroexcito-
bombas la Unidad LCR al gradiente gradiente toxinas
iónicas Neurovascular intersticio osmótico hidrostático sinápticas.