Gutiérrez Martínez D (1), García-Gil García JC (2), de Ancos Álvaro J (3), García Fernández J (4)
(1) F.E.A. Servicio de Anestesiología y Reanimación del Hospital Universitario Puerta de Hierro, Madrid. España.
(2) F.E.A. Servicio de Radiodiagnóstico del Hospital Universitario La Princesa, Madrid. España.
(3) Médico residente. Servicio de Anestesiología y Reanimación del Hospital Universitario La Princesa, Madrid. España.
(4) Jefe de Servicio de Anestesiología y Reanimación del Hospital Universitario Puerta de Hierro, Majadahonda. Madrid. España.
Cómo citar este artículo: Gutiérrez Martínez, D., García-Gil García, J. C., De Ancos Álvaro, J. ., & García Fernández, J. (2022). Pericardiocentesis emergente en miocardiopericarditis por SARS-CoV-2. Revista Electrónica AnestesiaR, 14(11). https://doi.org/10.30445/rear.v14i11.1113
Introducción
Las complicaciones en la esfera cardiovascular producidas por la infección SARS-CoV-2 son menos frecuentes, si bien se asocian a mayor morbimortalidad. Dentro de este grupo encontramos la miocarditis, el infarto agudo de miocardio, taponamiento cardiaco o arritmias cardiacas. El diagnóstico precoz puede ser decisivo en la evolución de dichas complicaciones.
Presentamos el caso de una mujer de 45 años que sufre una parada cardiaca por taponamiento cardiaco en el curso de una miocardiopericarditis tras haber sido diagnosticada de SARS-CoV-2.
Caso clínico
Mujer de 45 años de origen asiático sin antecedentes médicos de interés. No recibió pauta de vacunación para SARS-CoV-2. A su llegada a urgencias presenta fiebre de 38C, disnea y tos de 9 días de evolución, por lo que se decide ingreso hospitalario (Figura 1). Se inicia tratamiento corticoideo con dexametasona 20 mg diarios. No recibe tratamiento con inhibidores de interleucina 6 (tocilizumab) o remdesivir. Tras dos días de hospitalización se solicita ingreso en la unidad de cuidados intensivos (UCI). Se aprecia taquipnea de 35 respiraciones por minuto y una marcada hipoxemia con una saturación de oxígeno obtenida mediante pulsioximetría de 86%, a pesar de ventilación mecánica no invasiva en modo CPAP con presión de 10 cm de agua y fracción inspirada de oxígeno de 0,9. Se procede a la intubación endotraqueal y conexión a ventilación mecánica.
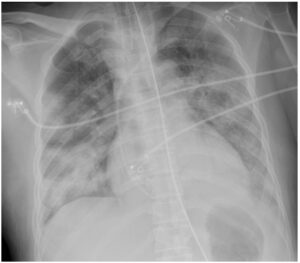
Se inicia terapia ventilatoria mediante respirador Servo U (Maquet) con parámetros protectivos que incluye volumen corriente 6ml/kg, Driving pressure menor de 15 cm H2O, presión meseta menor de 30 cm H2O y PEEP por encima de 5 cm de agua según las guías recomendadas por Papazian et al en Annals of Intensive Care en 2019.
A los 30 minutos de iniciar la terapia ventilatoria se obtiene un índice de oxigenación PaFI (relación entre presión arterial de oxígeno y la fracción inspirada de oxígeno) mayor de 200. Durante las siguiente 6 horas la paciente no sufre ningún episodio de hipotensión arterial o alteraciones de la conducción cardiaca que precisen el uso de fármacos vasopresores o inotrópicos. Sus constantes vitales son taquicardia sinusal a 120 lpm y tensiones arteriales en torno a 120/70 mmHg. La paciente presenta un episodio de hipotensión arterial que se resuelve de manera puntual con bolo de 250 ml de ringer lactado y efedrina 10 mg intravenoso. A los 2 minutos la paciente sufre una parada cardiaca cuyo ritmo inicial es actividad eléctrica sin pulso (AESP), iniciándose maniobras de resucitación cardiopulmonar avanzada (RCP) según las guías de la European Resuscitation Council (ERC). Se administra en total 2 mg de adrenalina por la vía venosa central, al inicio y a los 4 minutos de la RCP. Se realiza una ecografía rápida a pie de cama (EcoFAST) donde se observa en ventana subxifoidea derrame pericárdico abundante y cámaras cardiacas colapsadas, descartando neumotórax o derrames pleurales. Dado el taponamiento cardiaco, se efectúa pericardiocentesis evacuadora emergente con aguja de set de vía venosa central obteniendo 200 ml de líquido pericárdico de aspecto seroso. Drenado el taponamiento cardiaco se recupera la circulación espontánea tras 5 minutos de RCP. En el monitor se objetiva una taquicardia sinusal a 140 lpm y tensiones arteriales con valores de 200/120 mmHg. Se repite ecocardiografía transtorácica visualizando disfunción sistólica grave del ventrículo izquierdo con fracción de eyección del ventrículo izquierdo (FEVI) de 15% y aquinesia de segmentos medios y apicales con escaso derrame pericárdico. Se inicia tratamiento con dobutamina a 6ug/kg/min y noradrenalina a 0,1ug/kg/min, mejorando la FEVI al 25%. El hospital en el que ingresa la paciente no dispone de dispositivos de asistencia circulatoria, por lo que se traslada a su hospital de referencia.
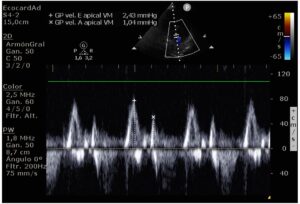
A su llegada a la UCI de dicho hospital, se realiza analítica de control y ecocardiografía transtorácica. Los valores de troponina T son 336,4 ng/L y CK 80 U/L. La ecografía confirma FEVI severamente deprimida (visual 15-20%) con aquinesia de segmentos medios y apicales, preservando contractilidad a nivel muy basal de todas las caras. Al medir el flujo transmitral se obtiene un cociente E/A (razón entre onda E de llenado rápido protodiastólico y onda A dependiente de la contracción auricular) mayor de 2, lo que clasifica la insuficiencia diastólica como grave o grado III (Figura 2). No se observa dilatación del ventrículo derecho con un índice TAPSE 20 mm. Las aurículas son de tamaño normal y las válvulas cardiacas normofuncionantes. Se estima el gasto cardiaco como el producto del volumen sistólico, obtenido a partir de la integral velocidad tiempo subaórtica, y multiplicado por la frecuencia cardiaca en conformidad con las recomendaciones de la European Association of Cardiovascular Imaging y de la American Society of Echocardiography1,2. La integral velocidad tiempo fue 15,7 cm (valor normal mayor de 17 cm) y el gasto cardiaco estimado fue 5,6 L/min con dobutamina a 6ug/kg/min. Debido a la buena respuesta del tratamiento inotrópico con dobutamina, se decide manejo conservador.
La mejoría respiratoria y cardiológica durante el ingreso es significativa permitiendo proceder a la extubación a los tres días y suspensión de dobutamina a los 5 días. La paciente no presenta disnea y mantiene saturaciones de oxígeno por encima del 96% con oxigenoterapia administrada mediante gafas nasales a 3 litros por minuto. Se decide alta de la UCI.
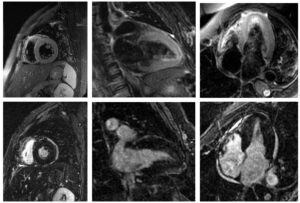
Durante el ingreso en hospitalización se realiza un estudio de resonancia magnética cardiaca con gadolinio. El miocardio muestra una hiperintensidad de señal difusa en la secuencia T2 doble IR, sin focos de realce tardío. El ratio de intensidad de señal del miocardio / músculo esquelético es de 2,01 (significativo cuando es ≥ 2). Estos hallazgos son compatibles con edema miocárdico difuso y, dado el contexto clínico de la paciente, el diagnóstico más probable es el de miocarditis. También se objetiva derrame pericárdico leve. En las secuencias de cine (no incluidas) no se aprecian alteraciones de la contractilidad ni disfunción ventricular (FEVI estimada: 66%). Figura 3.
A los siete días de la parada cardiaca se realiza una nueva ecocardiografía transtorácica en la que no se observan alteraciones significativas de la contractilidad segmentaria presentando una FEVI 78% y ausencia de derrame pericárdico. Finalmente se decide alta a domicilio.
El cuadro clínico es altamente sugestivo de taponamiento cardiaco en el contexto de miocardiopericarditis vírica secundaria a infección por SARS-CoV-2.
Discusión
Los síntomas más frecuentes de la enfermedad producida por el coronavirus SARS-CoV-2 son de origen respiratorio, pero conforme profundizamos su estudio descubrimos que su implicación cardiovascular es asimismo evidente.
De la misma forma que el MERS-CoV (coronavirus del síndrome respiratorio de Oriente Medio) se asocia a miocarditis y fallo cardiaco, encontramos esta misma comorbilidad por la infección del virus SARS-CoV-2.
La afinidad del SARS-CoV-2 por el sistema respiratorio y cardiovascular se debe a la presencia abundante de proteínas ACE2 en la membrana celular que actúan como receptores uniéndose a la proteína espícula S del virus facilitando su ingreso. En el interior de la célula se inicia un proceso de replicación de su ARN, generando nuevo material genético viral que se liberará al resto de los órganos. La íntima relación fisiológica entre el pulmón y el corazón contribuye a que, cambios a nivel pulmonar tales como el aumento del shunt y la presencia de vasoconstricción pulmonar hipóxica, den lugar a un daño cardiaco añadido al producido por el propio virus dentro de los miocardiocitos3.
Respecto al estudio anatomopatológico realizado en pacientes fallecidos, se objetiva infiltración del miocardio por células inflamatorias mononucleares, lo cual reafirma la afectación miocárdica del SARS-CoV-24. El daño miocárdico tiene lugar desde el 22,2% de los pacientes que requieren ingreso en una unidad de cuidados críticos hasta el 59% de los pacientes que finalmente fallecen por la infección. La incidencia anual de miocarditis viral por SARS-CoV-2 es de 22 casos cada 100.000 de los cuales hasta un 5% pueden sufrir fallo cardiaco5,6.
La pericarditis de origen viral es la etiología de derrame pericárdico más frecuente en los países desarrollados. Se suele presentar como una enfermedad autolimitada con rápida recuperación y sin complicaciones. Sin embargo, en ocasiones puede complicarse con cuadros de taponamiento cardiaco, pericarditis recurrente y, en menor frecuencia, pericarditis constrictiva. La clínica depende de la cuantía y de la velocidad de instauración del derrame pericárdico. Así, pequeños volúmenes en un corto periodo de tiempo, pueden condicionar un taponamiento cardiaco3.
La incidencia de parada cardiaca en paciente COVID19 se encuentra entre el 1-2% de la población infectada7, aumentando hasta un 14% en paciente crítico. Los ritmos cardiacos más frecuentes son la actividad eléctrica sin pulso (49,8%) y la asistolia (23.8%)8. El estudio de Fei Shao et al, estudia la etiología de la parada cardiaca en una muestra de 136 pacientes, encontrando origen respiratorio en el 87,5% y causa cardiológica sólo en el 7.3%, sin especificar la patología cardiológica que lo provoca9.
La sospecha de parada cardiaca secundaria a taponamiento cardiaco, fue confirmada mediante la demostración de derrame pericárdico en la ecocardiografía transtorácica y la recuperación de la circulación espontánea tras la pericardiocentesis terapéutica. El derrame pericárdico condiciona insuficiencia cardiaca al comprometer el llenado de las cavidades cardiacas derechas, lo cual explica el empeoramiento gasométrico progresivo de la paciente con aumento de infiltrados alveolares bilaterales a pesar del inicio de la ventilación mecánica. Tras la pericardiocentesis terapéutica dicho compromiso cardiaco desaparece y la recuperación clínica es rápida, descartando la evolución de su neumonía a síndrome de distress respiratorio (SDRA).
Con objeto de corroborar la sospecha de pericarditis viral asociada a miocarditis se realizó una resonancia magnética cardiaca. La información que nos aporta es muy útil para confirmar la sospecha clínico-analítica de miocarditis aguda. Asimismo, permite descartar otras patologías que pueden producir daño miocardio, fundamentalmente la cardiopatía isquémica. Existen criterios consensuados para el diagnóstico de miocarditis aguda. Son los denominados criterios de Lake Louise, cuya última actualización se llevó a cabo en 2018. En nuestro caso, como se puede observar en la Figura 3, se cumple un criterio T2 (hiperintensidad de señal difusa del miocardio, con un ratio de intensidad de señal del miocardio/músculo esquelético de 2,01) y un criterio adicional (derrame pericárdico leve). Estos hallazgos junto con la alta sospecha clínica y analítica, permitieron establecer el diagnóstico de miocarditis aguda10.
Conclusión
La miocardiopericarditis y taponamiento cardiaco son complicaciones graves de la infección por el virus SARS-CoV-2. Su diagnóstico y tratamiento precoz es decisivo para la evolución y el pronóstico. El uso de la ecocardiografía transtorácica en el paciente crítico es imprescindible para el diagnóstico diferencial de la parada cardiocirculatoria. Recomendamos por lo tanto el uso protocolizado de la ecocardiografía transtorácica en las unidades de cuidados críticos.
Bibliografía
1. Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for Cardiac Chamber Quantification by Echocardiography in Adults: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Journal of the American Society of Echocardiography. 2015;28(1):1-39.e14. doi:10.1016/j.echo.2014.10.003 (PubMed)
2. Quiñones MA, Otto CM, Stoddard M, Waggoner A, Zoghbi WA. Recommendations for quantification of Doppler echocardiography: A report from the Doppler quantification task force of the nomenclature and standards committee of the American Society of Echocardiography. Journal of the American Society of Echocardiography. 2002;15(2):167-184. doi:10.1067/mje.2002.120202 (PubMed)
3. Adler Y, Charron P, Imazio M, et al. 2015 ESC Guidelines for the diagnosis and management of pericardial diseases. European Heart Journal. 2015;36(42):2921-2964. doi:10.1093/eurheartj/ehv318 (PubMed)
4. Xu Z, Shi L, Wang Y, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. The Lancet Respiratory Medicine. 2020;8(4):420-422. doi:10.1016/S2213-2600(20)30076-X (PubMed)
5. Dhakal BP, Sweitzer NK, Indik JH, Acharya D, William P. SARS-CoV-2 Infection and Cardiovascular Disease: COVID-19 Heart. Heart, Lung and Circulation. 2020;29(7):973-987. doi:10.1016/j.hlc.2020.05.101 (PubMed)
6. Kariyanna PT, Sutarjono B, Grewal E, et al. A Systematic Review of COVID-19 and Myocarditis. Am J Med Case Rep. 2020;8(9):299-305. (PubMed)
7. Bhatla A, Mayer MM, Adusumalli S, et al. COVID-19 and cardiac arrhythmias. Heart Rhythm. 2020;17(9):1439-1444. doi:10.1016/j.hrthm.2020.06.016 (PubMed)
8. Hayek SS, Brenner SK, Azam TU, et al. In-hospital cardiac arrest in critically ill patients with covid-19: multicenter cohort study. BMJ. Published online September 30, 2020:m3513. doi:10.1136/bmj.m3513 (BMJ)
9. Shao F, Xu S, Ma X, et al. In-hospital cardiac arrest outcomes among patients with COVID-19 pneumonia in Wuhan, China. Resuscitation. 2020;151:18-23. doi:10.1016/j.resuscitation.2020.04.005 (PubMed)
10. Mester A, Benedek I, Rat N, Tolescu C, Polexa SA, Benedek T. Imaging Cardiovascular Inflammation in the COVID-19 Era. Diagnostics. 2021;11(6):1114. doi:10.3390/diagnostics11061114 (PubMed)



la paciente habia recibido alguna vacuna con el covid previo a su miocarditis?
No recibió pauta de vacunación previo al ingreso.