Serna Gandía MB (1) Cuesta Montero P (2) Paz Martín D (3)
(1) Facultativa del Servicio de Anestesia y Cuidados Intensivos del Hospital de Denia – Marina Salud. Profesora de ECOCRITIC.
(2) Facultativo del Servicio de Anestesia y Reanimación del H.G.U. de Albacete. Profesor de ECOCRITIC
(3) Facultativo del Servicio de Anestesia y Reanimación de Complejo Hospitalario de Toledo.
Cómo citar este artículo: Serna Gandía, M. B., Cuesta Montero, P., & Paz-Martín, D. (2021). Ultrasonografía en UCI. Revista Electrónica AnestesiaR, 13(11). https://doi.org/10.30445/rear.v13i11.972
Introducción
Durante la última década, la ecografía en las unidades de cuidados críticos (UCCs) ha ganado terreno como sistema de monitorización y detección de enfermedades potencialmente graves. Un mejor entendimiento del pulmón, del abdomen y de la ecografía vascular, unido a la accesibilidad actual de los sistemas portátiles de ultrasonidos (US), está revolucionando la exploración del paciente crítico a pie de cama.
Su uso no solo ha demostrado superioridad en el diagnóstico de la disnea frente a las técnicas convencionales, sino que además ha supuesto un cambio de actitud terapéutica al incorporar su uso de forma protocolizada al ingreso del paciente en la UCC (1, 2).
La ecocardiografía a pie de cama ha sido aceptada como herramienta de monitorización hemodinámica para la estimación de la precarga y de la volemia del paciente inestable. Su carácter no invasivo hace de la ecografía un método ideal para el paciente crítico en diferentes situaciones clínicas (3).
Las últimas recomendaciones de la Sociedad Europea de Cuidados Intensivos indican como medida inicial en el diagnóstico del shock, la realización de una ecocardiografía (4).
La exploración ecográfica de los médicos dedicados al cuidado del paciente crítico es amplia y por tanto, la dividimos en tres áreas:
· La ecografía general en el paciente crítico
· La ecocardiografía básica
· La ecocardiografía avanzada
Es importante conocer un poco la física de los ultrasonidos (US) y las distintas aplica-ciones que tiene en medicina. Las características, los diferentes modos y sondas que existen, se vieron en una monografía anterior en esta misma revista (5).
Ecografía General
La ecografía general incluye la ecografía abdominal, pleural, pulmonar y vascular. Para la adquisición del nivel básico en ecografía general los expertos recomiendan la realización de 10 horas de teoría junto con casos clínicos representativos de las patologías más frecuentes. El objetivo es detectar patologías potencialmente graves (hemoperitneo, neumotórax, derrame pleural, neumonía, etc.), realizando una exploración focalizada.(6)
2.1. Ecografía vascular
La ecografía vascular no sólo permite localizar los vasos, sino además servir como guía durante los procedimientos de canalización de los mismos. La ecografía vascular está sobre todo indicada en el diagnóstico de una trombosis venosa profunda (TVP) o de patología arterial periférica (Figura 1).
Actualmente la exploración vascular se ha extendido a vasos periféricos, más allá de la vena cava inferior (VCI) y de la aorta, para el estudio de la perfusión y congestión de órganos, como el riñón, el hígado, etc. (7-8)
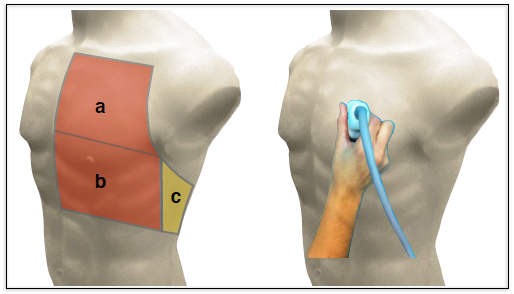
2.2. Ecografía abdominal
Las indicaciones de la ecografía abdominal son: utilización como guía en la paracentesis, sospecha de hemoperitoneo, sospecha de síndrome compartimental u otros síndromes de hipoperfusión, sospecha de hematoma retroperitoneal, sospecha de síndrome aórtico agudo, insuficiencia renal e insuficiencia hepática (Tabla 1).
Resulta de gran utilidad en la ecografía focalizada en el paciente politraumatizado con el objetivo de detectar líquido libre intrabdominal y/o patologías que requieran cirugía urgente.
2.3. Ecografía Pulmonar
La ecografía pulmonar ha sido siempre considerada como “terreno prohibido” para los ultrasonidos, pues el pulmón al contener aire no se puede visualizar. La valoración, por lo tanto, de la patología pulmonar se hace en base a los artefactos que generan los ultrasonidos al atravesar diferentes medios con distintas impedancias.
El análisis de los artefactos se pueden integrar en un protocolo, el protocolo BLUE, descrito por Lichtenstein y que orienta en el diagnóstico de patologías pulmonares.(9)
Las áreas básicas de exploración son 6. Se inicia la exploración en la cara anterior de ambos hemitórax dividiéndolos en dos cuadrantes, superior e inferior. Luego se visualiza el punto posteroinferior (PPI), también de cada lado, obteniendo así los 6 puntos de exploración (Figura 2). En función del artefacto hallado, tendrá uno u otro significado. (10)
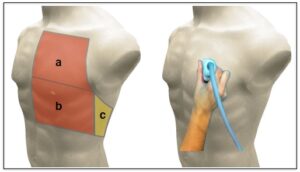
En la imagen de la izquierda se muestran las áreas de exploración pulmonar: a) cuadrante anterosuperior, b) cuadrante anteroinferior, c) punto posteroinferior (PPI). En la imagen de la derecha se observa la colocación de la sonda sobre el tórax, transversal a las costillas para poder así visualizar la línea pleural y el parénquima.
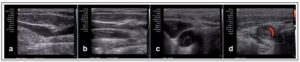
Al posicionar la sonda sobre el tórax, perpendicularmente a las costillas (Figura 3), se visualiza el tejido celular subcutáneo, seguido de una línea paralela e hiperecoica que representa la línea pleural y que se denomina Línea A. A ambos lados de la línea A, se encuentran dos sombras acústicas e hipoecoicas, que se corresponden con las costillas y que crean la imagen del signo del murciélago (las costillas simulan las alas de un murciélago).
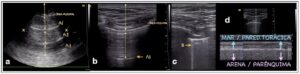
a) Se observa la línea pleural y las líneas de reverberación equidistantes entre sí y nombradas como A1, A2 y A3. Con una x vienen marcadas dos imágenes hipoecogénicas que recuerdan a las alas de un murciélago y que representan la sombra de las costillas b) Línea pleural ampliada con la sonda lineal c) Línea B perpendicular a la línea pleural. d) En el modo M, se observa el tejido celular subcutáneo como una imagen lineal que recuerda a las olas del mar. A continuación, separado por la línea pleural se observa un tejido de aspecto granulado, que recuerda a la arena de la playa y que se corresponde con el parénquima pulmonar.
A continuación, aparecen varias líneas A, paralelas a la línea pleural, a causa de un artefacto de reverberación. El movimiento de hormigueo de la línea A, se corresponde al deslizamiento entre las hojas pleural y visceral de la pleura, representando el pulmón normal. Al aplicar el modo M en el centro de la imagen, se puede observar el signo de la playa.
A partir de la línea pleural salen de forma perpendicular a ésta y borrando las líneas A, las líneas B, simulando una cola de cometa.
Como el aire tiende a subir y el agua a bajar, en el punto posteroinferior (PPI) que es la parte más declive de un paciente semisentado, se detectarán los derrames pleurales. Se representan como una imagen hipoecogénica, pues transmiten los ultrasonidos. Se pueden además distinguir dos tipos de consolidaciones, las que se asemejan al parénquima hepático son consolidaciones translobares, mientras que las consolidacio-nes no translobares se visualizan como tejido fraccionado e irregular. Éstas pueden estar asociadas o no, a un derrame pleural. (Figura 4)
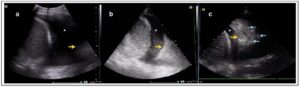
En las tres imágenes se observa el diafragma como una línea semicircular hiperecogénica, a cuya izquierda se encuentra el hígado y a la derecha el parénquima pulmonar (flecha amarilla). El derrame se observa como una imagen hipoecogénica marcada con un asterisco, a causa de distintas patologías: a) derrame pleural masivo en paciente con insuficiencia cardíaca congestiva (se drenaron 1500ml), b) derrame pleural con atelectasia asociada, que en movimiento simula el nado de una medusa, c) derrame pleural paraneumónico. Nótese la diferencia del parénquima con la imagen anterior. Las flechas azules marcan los puntos hiperecogénicos que se corresponden al bronco-grama aéreo, que aparece en la neumonía. En la imagen b, el parénquima es homogéneo.
En la cara anterior del tórax, la aparición de más de 3-5 líneas B entre dos espacios intercostales, se produce por la aparición de edema intersticial y da la imagen del signo del cohete. (Figura 5c)
La ausencia de deslizamiento pulmonar y de líneas B, son un signo básico de neumotórax. Al aplicar en este caso el modo-M, se observa el signo del código de barras, en el que se pierde la diferencia entre la arena y el agua de la playa. Al inspirar el paciente, si el neumotórax es pequeño y la pleura visceral llega a contactar de nuevo con la parietal, se puede visualizar el punto pulmón, pudiendo delimitar el área del neumotórax. (Figura 5a-b) En el neumotórax a tensión, el signo del punto pulmón no se puede visualizar, porque las pleuras nunca llegan a contactar entre ambas.
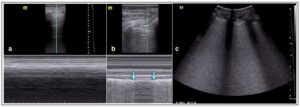
a) Modo M. Patrón de líneas A en ausencia de deslizamiento pulmonar, sugestivo de neumotórax. Nótese la diferencia con la Figura 4.d. En este caso desaparece el parénquima pulmonar, “no hay arena”. b) Imagen del punto pulmón que se produce en pequeños neumotórax cuando la pleura visceral contacta con la pleura parietal, durante la inspiración, creando un patrón de playa intermitente. Las flechas delimitan la espiración, durante la cual no hay parénquima. c) Signo del cohete, creado por un elevado número de líneas B, provocadas por edema intersticial.
En el protocolo BLUE, descrito por Lichtenstein en pacientes que consultan por disnea en urgencias, se definen 8 perfiles correspondientes a 6 patologías: (9)
• Perfil-A, se corresponde a una superficie pulmonar normal, con deslizamiento pulmonar.
• Asociado a una TVP, indica la presencia de un embolismo pulmonar en un 99% de los casos.
• Asociado a un síndrome alveolar en la cara posteroinferior o a un derrame pleural, sugiere neumonía, con un 96% de especificidad.
• En caso de ausencia de TVP, derrame pleural o síndrome alveolar, se de-nomina perfil desnudo y es sugestivo de asma o EPOC con una especificidad del 97%.
• Perfil-A’, se corresponde a la presencia de líneas A con ausencia de deslizamiento pulmonar y es sugestiva de neumotórax.
• Perfil B, asocia la presencia de deslizamiento pulmonar y el signo del cohete, definido como la presencia de 3 o más líneas B entre dos espacios intercostales. Si aparece de forma bilateral y uniforme se corresponde a edema pulmonar de origen cardiogénico (especificidad del 95%).
• Perfil B’, se corresponde a la presencia del signo del cohete, asociado a la ausencia de deslizamiento pulmonar. Indica neumonía (especificidad 100%). Normalmente se trata de un patrón no uniforme, correlacionado con infiltrados intersticiales parcheados que habitualmente aparecen en las neumonías.
• Perfil C, define consolidaciones en cara anterior. Desde grandes volúmenes afectados hasta pequeños engrosamientos de la línea pleural en la que en ocasiones pueden aparecer pequeñas colecciones, siempre adyacentes a la pleura y que redundantemente se denominan subpleurales. De nuevo, sugiere el diagnóstico de neumonía (especificidad 99%).
2.4. Ecocardiografía
La ecocardiografía es en estos momentos la primera exploración indicada en el pacien-te con shock hemodinámico. No sólo aporta el origen del shock, sino que además per-mite evaluar en cada momento la situación del paciente inestable y el efecto que los cambios terapéuticos le producen. Es por tanto una herramienta a día de hoy indispen-sable en las unidades de críticos, que cada vez tienden a ser menos agresivas. (4)
2.4.1. Ventanas ecocardiográficas
Las ventanas ecocardiográficas van a dar lugar a la visualización de distintos planos. Los planos que más se utilizan son: (Figura 6) (11)
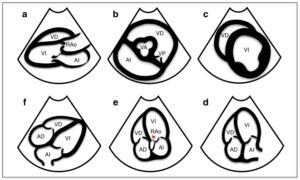
a) Plano paraesternal longitudinal, b) Plano paraesternal transversal (PET), a nivel de los grandes vasos, c) PET, a nivel de los músculos papilares, d) Plano apical de cuatro cámaras, e) Plano apical de 5 cámaras, f) Plano subcostal. VD ventrículo derecho, VI ventrículo izquierdo, AD aurícula derecha, AI aurícula izquierda, RAo raíz aórtica, VP válvula pulmonar, VA válvula aórtica.
• Plano paraesternal longitudinal (PEL). Aporta información acerca de la función del ventrículo izquierdo (VI) y permite visualizar las válvulas aórtica (VA) y mitral (VM).
• Plano paraesternal transversal (PET). Aporta información acerca de la contractilidad global y estructural del VI y de su relación con el ventrículo derecho (VD). Per-mite visualizar la arteria pulmonar (AP) y hacer un análisis estructural de la VA.
• Plano apical 4 cámaras (A4C). Aporta información acerca de la función del VI y de su relación con el VD.
• Plano apical 5 cámaras (A5C). Es el plano que junto con el anterior, permitirá realizar los cálculos necesarios para hacer el estudio hemodinámico del paciente inestable.
• Plano subcostal (PS). Permite valorar la función biventricular y la relación entre ambos ventrículos. Es el plano desde el que se observa la vena cava inferior (VCI) para valorar la precarga del VD y la respuesta a volumen.
2.4.2. Ecocardiografía básica
El estudio de la ecocardiografía resulta de mayor complejidad dividiéndose así en dos niveles, básico y avanzado. Para el nivel básico se recomienda la realización de 10 horas de formación teórica, junto con 30 exploraciones tutorizadas por un experto, con el objetivo de diagnosticar patologías graves de forma cualitativa.
Los médicos deben ser capaces de identificar la función normal o anormal del ventrículo izquierdo, la necesidad de administrar fluidoterapia o el uso de drogas vasoactivas. La exploración transtorácica resulta suficiente en la mayoría de los casos, pero en caso de una mala ventana, la realización de una ecografía transesofágica permite completar el estudio de forma satisfactoria.
La exploración protocolizada en este contexto puede mejorar los cuidados del paciente, especialmente ante la sospecha de taponamiento cardiaco, parada cardiorrespiratoria, disfunción global sistólica, dilatación del VI, e hipovolemia. (2) (Figura 7)
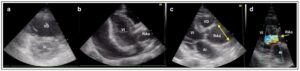
a) Dilatación severa del VD en paciente con TEP masivo. Obsérvese que el tamaño del VD es mayor que el del VI. b) Taponamiento cardiaco. La imagen hipoecogénica que rodea al VI es compatible con derrame. c) Aneurisma de aorta ascendente de 55mm. d) El mismo paciente que en c, al aplicarle color, muestra un jet de regurgitación, señalado con una flecha amarilla, compatible con insuficiencia aórtica severa, ya que ocupa todo el tracto de salida del VI.
La ecocardiografía en la UCC no tiene el objetivo de sustituir la exploración reglada del cardiólogo sino el de valorar el estado hemodinámico del paciente en shock y su res-puesta al tratamiento.
2.4.2.1. Función sistólica
En la valoración de la función cardiaca, la estimación subjetiva de la contractilidad del VI, resulta tan eficaz y reproducible como el cálculo mediante la fracción de eyección (Teicholz, Simpson, fracción de acortamiento) para la detección de una función severamente deprimida.(12) El objetivo principal es detectar una alteración severa de la contractilidad y la repercusión hemodinámica que ésta conlleva. (Figura 8)
El diagnóstico detallado de la cardiopatía isquémica, consume tiempo y no es el objetivo de la exploración básica.
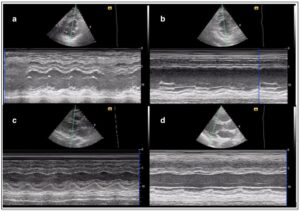
En las imágenes se observan dos planos, en a y b PET y el PEL en c y d. Aplicando el modo M a través del VI, se puede fácilmente distinguir una fracción de eyección de >50% en las imágenes a y c de una función severamente deprimida, que se muestra en b y d.
La función global del VD y las presiones de llenado también se pueden valorar de forma sencilla. Mediante la excursión del anillo tricuspídeo (TAPSE), que mide el desplaza-miento del mismo durante la sístole, se puede estimar una disfunción cuando éste es < de 14mm. (Figura 9) En condiciones normales el tamaño del VD representa un 1/3 del VI. El VD se encuentra dilatado cuando su base, en un plano A4C mide más de 42mm o cuando ambos ventrículos tienen el mismo tamaño. Se encuentra severamente dila-tado cuando su tamaño excede al del VI (VD>VI).(Figura 7.a) El aplanamiento del septo puede indicar disfunción del VD atribuible a un exceso de volumen o de presión que pueden aparecer en la hipertensión pulmonar o en el tromboembolismo pulmonar.
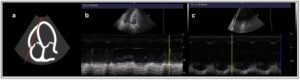
Al aplicar el modo M en el borde libre del VD, podemos observar el desplazamiento del anillo tricuspídeo. b) Paciente en shock por sepsis de origen pulmonar e intubado, con fibrilación auricular y disfunción severa del VD (TAPSE 8.8mm). c) Tras revertirlo a ritmo sinusal y administrar levosimendan, mejora significativamente la función sistólica (TAPSE 18.8) y se consigue la estabilización hemodinámica.
Existen diversos comportamientos de las cavidades cardiacas en función del tipo de shock que presenta el paciente y que orientan al diagnóstico. El shock hipovolémico se asocia a una disminución de los volúmenes ventriculares telediastólicos y telesistólicos. En el shock cardiogénico, el VI se muestra hipocinético y en algunos casos puede en-contrarse dilatado. En el shock distributivo se puede observar un corazón hiperdinámico con o sin disfunción miocárdica y/o dilatación del VI. En el shock obstructivo por un TEP se observa un VD severamente dilatado con aplanamiento del septo.
2.4.2.2. Función diastólica del VI
La valoración de la presión de llenado del VI en el paciente inestable se puede estimar a partir de la medición de la velocidad máxima de la sangre durante el llenado precoz del VI (E) y de la velocidad tisular del anillo de la válvula mitral (e’) en ese mismo momento. La e´ es relativamente independiente de las condiciones de precarga. Un valor e’ < 10 cm/s es indicativo de disfunción de la relajación miocárdica. Valores de E/e’ se relacionan con presiones de enclavamiento de la arteria pulmonar. Valores de E/e’ > 7 su-pone una presión de enclavamiento >13mm de Hg. La valoración adecuada de las presiones de llenado requiere entrenamiento y debería ser realizada únicamente por médicos con un grado avanzado en ecocardiografía.
2.4.2.3. Gasto cardiaco
La medición del volumen sistólico (Vs) y del gasto cardiaco (Gc) mediante ecocardiografía transtorácica (ETT) puede obtenerse de dos formas. A partir del cálculo de la fracción de eyección (FE) mediante la fórmula de Teicholz o mediante doppler. Si se imagina cada sístole como un cilindro de sangre que sale del VI, la base del cilindro la constituye el área (A) del tracto de salida del VI (TSVI) que se obtiene a partir de su diámetro. Éste se mide justo por debajo de la VA en el plano PEL, según la fórmula A= πr2, que se puede simplificar como A = 0,785 x DTSVI2 (en cm).
Para estimar el Vs, se precisa la altura del cilindro. Al aplicar el doppler en el TSVI (plano A5C) y trazando la onda de flujo obtenida, se puede calcular la integral de velocidad tiempo (IVT). La IVT se corresponde a la altura del cilindro, obteniendo finalmente el Vs como ATSVI x IVTTSVI. (Figura 10)
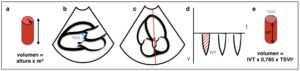
a) Altura x πr2, se corresponde al volumen del cilindro que el VI eyecta en cada latido. b) Se mide el diámetro del cilindro en un plano PEL y se aplica la fórmula A = 0,785 x DTSVI2. c) Se posiciona el volumen de muestra del DP en el TSVl en un plano A5C y d) se obtiene en una gráfica la velocidad de todos los hematíes que pasan por el TSVI. Se calcula la IVT. d) La IVT se corresponde con la altura del cilindro, obteniendo así todos los valores de la fórmula.
2.4.2.4. Valoración de disfunción valvular severa
La presencia de una estenosis y/o insuficiencia mitral o aórtica, puede desencadenar una descompensación aguda del paciente en la UCC. Por ello, el médico debe ser ca-paz de sospechar estas patologías y establecer el grado de descompensación que le genera al paciente. Las insuficiencias son fáciles de visualizar con el doppler color (Figura 7.d). La estimación de los grados de estenosis y su repercusión según el con-texto clínico, requieren mayor experiencia.
2.4.3. Ecocardiografía avanzada
La ecocardiografía permite no sólo diagnosticar sino guiar la terapia del paciente hemo-dinámicamente inestable, de forma cuantitativa y aproximada a los métodos de monitorización invasivos tradicionales, como el catéter de arteria pulmonar, con un uso actual más limitado.(13-14)
La monitorización hemodinámica avanzada del paciente crítico mediante ecocardiografía requiere una curva de aprendizaje más larga, de 40 horas de teoría y la realización de, al menos, 100 estudios tutorizados.(15)
La adquisición de las competencias en ecocardiografía avanzada tras el cumplimiento del programa de formación, precisa además una titulación específica que acredite al médico para la realización de esta técnica. (16)
Actualmente los expertos remarcan la obligación de que los médicos dedicados al cui-dado del paciente crítico adquieran un nivel básico en ecografía que incluya el diagnóstico de patología cardiaca grave de forma cualitativa.(17)
Otros usos de la ecografía en críticos
La ecografía también se utiliza en la detección del aumento de la presión intracraneal mediante la medición de la vaina del nervio óptico.
El doppler transcraneal sobre las arterias cerebrales permite detectar signos de vasoespasmo en pacientes con hemorragia subaracnoidea, así como la detección de la hipertensión intracraneal y el diagnóstico de muerte encefálica.
Conclusiones
• El uso de la ecografía básica (pulmonar, abdominal, ecocardiografía y ecografía de vasos) ha supuesto un cambio de actitud terapéutica al incorporar su uso de forma protocolizada al ingreso del paciente en la UCC (2). Su formación está considerada como obligatoria por los expertos (3).
• Permite realizar el diagnóstico diferencial de la disnea en el 95% de los casos que ingresan en urgencias (1).
• Está indicada como primera medida en el paciente con shock hemodinámico, tanto para el diagnóstico, como para guiar el tratamiento (4).
• La ecocardiografía básica tiene como objetivo el diagnóstico de patologías potencialmente graves, así como la valoración de la función del VI, función del VD, valvulopatías severas, cálculo del Vs y del Gc mediante la realización de 10 horas de teoría y 50 exploraciones guiadas (3, 6, 17).
• La ecocardiografía avanzada permite hacer una monitorización hemodinámica avanzada mediante ecografía con una formación teórica de 40 horas y la realización de 100 ecografías tutorizadas. Precisa una titulación específica (15).
Bibliografía
- Pirozzi C, Numis FG, Pagano A, Melillo P, Copetti R, Schiraldi F. Immediate versus delayed integrated point-of-care-ultrasonography to manage acute dyspnea in the emergency department. Crit Ultrasound J. 2014 Apr 27;6(1):5. doi: 10.1186/2036-7902-6-5. eCollection 2014. (PubMed).
- Manno E, Navarra M, Faccio L, Motevallian M, Bertolaccini L, Mfochivè A, Pesce M, Evangelista A. Deep impact of ultrasound in the intensive care unit: the “ICU-sound” protocol. Anesthesiology. 2012 Oct; 117(4):801-9. (PubMed).
- Mayo PH, Beaulieu Y, Doelken P, Feller-Kopman D, Harrod C, Kaplan A, et al. American College of Chest Physicians/La Société de Réanimation de Langue Française state-ment on competence in critical care ultrasonography. 2009 Apr; 135(4):1050-60. doi: 10.1378/chest.08-2305. Epub 2009 Feb 2. (PubMed)
- Cecconi M, De Backer D, Antonelli M, Beale R, Bakker J, Hofer C, et al. Consensus on circulatory shock and hemodynamic monitoring. Task force of the European Society of Intensive Care Medicine. Intensive Care Med. 2014 Dec; 40(12):1795-815. doi: 10.1007/s00134-014-3525-z. Epub 2014 Nov 13. (PubMed).
- Serna Gandía MB, Vicho Pereira R. Conocimientos básicos en ecografía – El Odioso Doppler. Rev Elect AnestesiaR [Internet]. 31 de agosto de 2016 [citado 25 de octubre de 2020];8(8):2. Disponible en: http://revistaanestesiar.org/index.php/rear/article/view/124
- Fagley RE, Haney MF, Beraud AS, Comfere T, Kohl BA, Merkel MJ, et al. Critical Care Basic Ultrasound Learning Goals for American Anesthesiology Critical Care Trainees: Recommendations from an Expert Group. Anesth Analg. 2015 May; 120(5):1041-53. doi: 10.1213/ANE.0000000000000652. (PubMed).
- Beaubien-Souligny, W., Rola, P., Haycock, K., Bouchard, J., Lamarche, Y., Spiegel, R., Denault, A. Y. Quantifying systemic congestion with Point-Of-Care ultrasound: de-velopment of the venous excess ultrasound grading system. Ultrasound J. 2020; 12: 1-12. DOI: 10.1186/s13089-020-00163-w. (HTML)
- https://anestesiar.org/2020/vexus-nuevo-sistema-de-valoracion-de-la-congestion-venosa-con-pocus-cerrando-el-circulo-del-manejo-del-shock
- Lichtenstein DA. BLUE-protocol and FALLS-protocol: two applications of lung ul-trasound in the critically ill. Chest. 2015 Jun; 147(6):1659-70. doi: 10.1378/chest.14-1313. (PubMed).
- https://anestesiar.org/2016/conocimientos-basicos-en-ecografia-pulmonar-ecocritic-2/
- https://anestesiar.org/2016/conocimientos-basicos-en-ecografia/
- Melamed R, Sprenkle MD, Ulstad VK, Herzog CA, Leatherman JW. Assessment of left ventricular function by intensivists using hand-held echocardiography. Chest. 2009 Jun; 135(6):1416-20. doi: 10.1378/chest.08-2440. Epub 2009 Feb 18. (PubMed)
- Melanie Meersch, Christoph Schmidt, Alexander Zarbock. Echophysiology: the tran-sesophageal echo probe as a noninvasive Swan-Ganz catheter. Opin Anaesthesiol. 2016 Feb;29(1):36-45. DOI: 10.1097/ACO.0000000000000277 (PubMed)
- Vincent JL. The pulmonary artery catheter. J Clin Monit Comput. 2012 Oct; 26(5):341-5. doi: 10.1007/s10877-012-9389-2. Epub 2012 Aug 12. (PubMed)
- International consensus statement on training standards for advanced critical care echocardiography. Expert Round Table on Echocardiography in ICU. Intensive Care Med. 2014 May; 40(5):654-66. doi: 10.1007/s00134-014-3228-5. Epub 2014 Mar 11. (PubMed)
- https://www.esicm.org/education/edec-2/
- Expert Round Table on Ultrasound in ICU. International expert statement on training standards for critical care ultrasonography. Intensive Care Med. 2011 Jul; 37(7):1077-83. doi: 10.1007/s00134-011-2246-9. Epub 2011 May 26. (PubMed)