Garnero F (1), Saez RM (2), Antuña Cepellotti MP (3), Calatroni M (4)
(1) Médica residente de Anestesiología del Hospital San Martín de La Plata, Buenos Aires. Argentina.
(2) Anestesiólogo adjunto del Hospital San Martín de La Plata, Buenos Aires. Argentina.
(3) Médica residente de Neurocirugía del Hospital San Martín. La Plata, Buenos Aires. Argentina.
(4) Neurocirujano del Hospital San Martín. La Plata, Buenos Aires. Argentina.
Cómo citar este artículo: Garnero, F. A., Saenz, R. M., Antuña Cepellotti, M. P., & Calatroni, M. (2023). Craneotomía en paciente despierto para la resección de glioma en institución con escasos recursos. Revista Electrónica AnestesiaR, 15(3). https://doi.org/10.30445/rear.v15i3.1079
Introducción
Actualmente, el cuerpo de evidencia disponible en relación a la cirugía de gliomas, sugiere que el grado de resección tumoral se correlaciona positivamente con la supervivencia global, la persistencia libre de enfermedad y la disminución de la transformación maligna (1).
A lo largo de la historia de la neurocirugía, la estrategia de realizar cirugías en pacientes despiertos se ha implementado en numerosas y diversas indicaciones, con el fin último de incrementar la seguridad del paciente. Descrita originalmente por Horsley hace más de 120 años, popularizada por Penfield e introducida en la era moderna por Ojemann, entre otros, la cirugía en paciente despierto, complementada con la estimulación cortical y subcortical intraoperatoria, ha demostrado mejorar el grado de resección tumoral y disminuir la morbilidad hasta en un 58% (2). Constituye la mejor estrategia para identificar áreas elocuentes en tiempo real, permitiendo, al mismo tiempo, una resección tumoral óptima y la preservación de parénquima cerebral funcionante (3). Sin embargo, a pesar de su eficacia y seguridad, se utiliza en menos del 22% de las cirugías de gliomas, particularmente, en aquellos países de medianos/bajos ingresos que cuentan con una mayor proporción de instituciones con escasos recursos (4).
Esto podría deberse a la falta de información sobre la craneotomía en paciente despierto y sus beneficios entre los neurocirujanos y anestesistas. Desde la perspectiva económica, este procedimiento puede disminuir la utilización de recursos al reducir el uso de monitorización invasiva, la duración de la operación y la estancia hospitalaria postoperatoria. Todas estas razones también favorecen su uso en el mundo en desarrollo, donde la disponibilidad de recursos sigue siendo un desafío (5).
La terminología «despierto» es en cierto modo engañosa, ya que la participación activa y la comunicación con el paciente para el mapeo de la función neuronal y motora sólo se requiere durante la manipulación quirúrgica del tejido cerebral elocuente y el paciente está «sedado» durante otras partes del procedimiento (6).
Aunque la anestesia para la craneotomía en paciente despierto con mapeo funcional intraoperatorio suele ser bien tolerada, requiere un amplio conocimiento de los principios subyacentes a la neuroanestesia y de las estrategias técnicas especiales, como la anestesia local para el bloqueo del cuero cabelludo, el manejo avanzado de la vía aérea, los protocolos de sedación específicos y el manejo hábil de la hemodinámica (7).
Siempre se han planteado preocupaciones en el contexto de la cooperación y la aceptación del paciente, así como de la seguridad en relación con la estabilidad hemodinámica y, sobre todo, la seguridad de las vías respiratorias. El reto anestésico consiste en proporcionar un paciente en condiciones de colaborar con la evaluación neurológica, pero con una analgesia adecuada y una estabilidad hemodinámica y respiratoria durante todas las fases del procedimiento (6).
A continuación, presentaremos un caso de craneotomía realizada en paciente despierto con un glioma de bajo grado ubicado en la región fronto-temporo-insular derecha, realizada en una institución de salud pública con recursos limitados.
Caso clínico
Varón de 46 años (peso 105 kg, altura: 180 cm), ASA 3 por su patología tumoral de base, ingresó en el hospital para cirugía de exéresis de un glioma de bajo grado en región insular, mediante técnica de craneotomía con paciente despierto. Las pruebas de laboratorio de rutina preoperatorias no indicaron ningún hallazgo anormal. El paciente no presentaba comorbilidades ni problemas de cognición o comunicación. La única manifestación clínica que refería por su tumor eran crisis convulsivas dos o tres veces por semana. Se encontraba bajo tratamiento vía oral con fenitoína 100 mg cada 6h y levetiracetam 1 gr cada 12 h.
Durante la evaluación preoperatoria, se realizaron varios encuentros junto al equipo de neurocirugía, psiquiatría, anestesia y el electrofisiólogo a cargo de la evaluación intraoperatoria. El paciente se mostró totalmente cooperativo y comprendió el procedimiento que se le iba a realizar. Se explicaron los riesgos y beneficios de realizar la cirugía bajo vigilia versus anestesia general. El paciente optó por someterse a la craneotomía permaneciendo despierto, previa firma de consentimiento informado. La técnica, por tanto, utilizada fue paciente dormido-despierto-dormido.
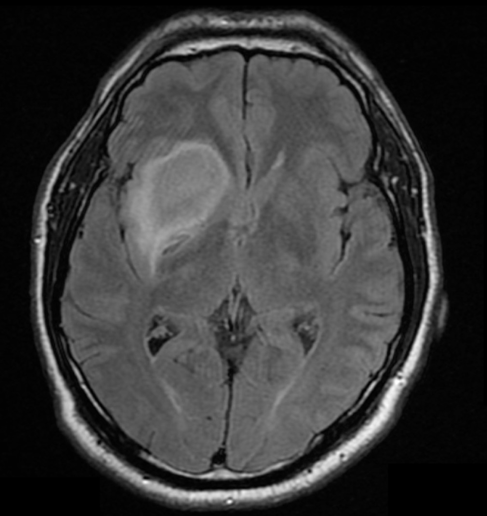
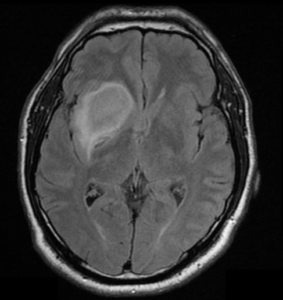
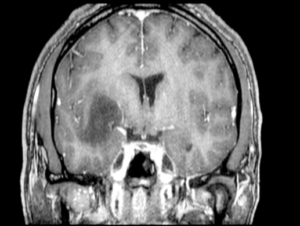
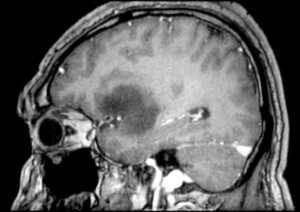
La topografía y las características tumorales fueron caracterizadas mediante secuencias convencionales de RNM. Sus límites se definieron en función de las anormalidades presentes en las ponderaciones T2, FLAIR predominantemente hiperintensos y T1 prevaleciendo hipointenso sin realce tras la administración de contraste intravenoso (Figuras 1,2 y 3). Con respecto a sus dimensiones, se obtuvieron las siguientes medidas: 31mm diámetro antero-posterior x 30mm diámetro latero-lateral x 33mm diámetro cefalocaudal. Asimismo, fue posible determinar la relación existente entre el tumor y las fibras del tracto cortico-espinal, mediante DTI-Tractografía.
Si bien no se dispone de secuencias de RNM funcional, no lo consideramos determinante, ya que la planificación quirúrgica contempla la estimulación cortical directa intraoperatoria.
Al ingresar al quirófano se aplicó pulsioximetría, monitorización no invasiva de la presión arterial, control de la temperatura y monitorización con electrocardiograma. Se insertó un catéter arterial bajo anestesia local para mediciones directas de la presión arterial. La presión arterial y la frecuencia cardiaca fueron 130/95 mmHg y 85 latidos / min, respectivamente.
Al no contar con levetiracetam endovenoso, se administró un mantenimiento de fenitoína de 7 mg/kg/24 h en tres dosis (una cada 8h).
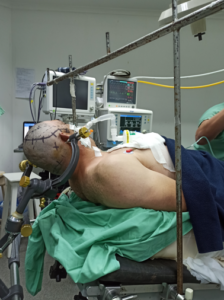
Se realizó anestesia total intravenosa con propofol y remifentanilo en infusión contínua. Se abordó la vía aérea con un dispositivo supraglótico de segunda generación (I GEL n° 5) . Para la colocación del cabezal de Mayfield se practicaron los bloqueos supraorbitarios, supratroclear, cigomáticofacial, auriculotemporal, occipital menor y occipital mayor con lidocaína sin epinefrina al 2 % con 0,5 -1 ml en cada región. El paciente se posicionó en decúbito dorsal, con realces en las distintas zonas de decúbito, elevación y rotación cefálica hacia la izquierda de aproximadamente 30°, dejando libre acceso a los miembros superior e inferior del lado izquierdo para su evaluación (Figura 4).
Se realizó craneotomía fronto-temporo-parietal derecha, con infiltración local con 0,3 ml de lidocaína sin epinefrina al 2% a la duramadre adyacente a la arteria meníngea media a nivel proximal con posterior durotomía arciforme. Una vez expuesta la superficie cortical, se realizó una apertura completa del valle Silviano, desde el punto Silviano posterior hasta la cisterna carotídea, exponiendo la superficie insular. Posteriormente, electrodos de superficie fueron posicionados anatómicamente sobre las cortezas primarias motora y sensitiva, corroborando su ubicación desde el punto de vista electrofisiológico mediante la inversión de fase N20, permitiendo, al mismo tiempo, el registro continuo de la actividad eléctrica durante la cirugía.
Asegurado el campo quirúrgico, se inició el despertar del paciente, suspendiendo la infusión de propofol y disminuyendo el remifentanilo a una dosis subapneica de 0,03-0,06 mcg/Kg/min. Transcurridos 10 minutos, tras una adecuada superficialización, se retiró la máscara laríngea. El paciente mantuvo la respiración espontanea apoyada con oxígeno a 3lts/min mediante bigotera.
Al interrogatorio, se encontraba sedado pero consciente, orientado en tiempo y espacio, sin dolor, movilizando los cuatro miembros espontáneamente y a la orden verbal. Tras corroborar la estabilidad hemodinámica, una adecuada ventilación y oxigenación, se procedió a la estimulación de los opérculos frontal, parietal y temporal, confirmando la ausencia de áreas del lenguaje. Se utilizó un estimulador bipolar de corriente continua distribuida en ondas bifásicas de 4 segundos a 60Hz.
El tiempo quirúrgico fue de 10h, como incidencia se produjo una crisis convulsiva de aproximadamente 5 segundos que fue rápidamente abortada mediante la instilación de solución ringer lactato helado directamente sobre la corteza cerebral. Posteriormente, el paciente no presentó mayores dificultades para tolerar el resto de la cirugía y las pruebas funcionales.
Previo al traslado a la unidad de cuidados intensivos, se administraron vía endovenosa 60 mg de ketorolaco, 4 mg de morfina y 4 mg de ondansetrón, para manejo del dolor postoperatorio. El paciente ingresó en la unidad de cuidados intensivos para observación durante las primeras 24hs postoperatorias. A las 48hs de la cirugía se decidió su pase a sala de hospitalización.
Discusión
La principal razón para realizar la cirugía con el paciente despierto es para evitar las complicaciones postoperatorias, con el fin de preservar la actividad motora, el lenguaje y la función neurocognitiva. El éxito de la cirugía viene de la mano de una comunicación efectiva entre anestesista, electrofisiólogo y neurocirujano generando un plan de trabajo pautado. Además, también depende de un mapeo correcto, evitando realizar una sedación excesiva y sobre todo, brindándole el máximo confort.
No hay un esquema óptimo de manejo anestésico, lo principal es la selección adecuada del paciente, el análisis de la localización del tumor, la duración de la cirugía y la experiencia del anestesiólogo.
La combinación de propofol y remifentanilo ha sido el enfoque estándar para la sedación durante la fase previa al despertar en este tipo de intervenciones durante más de dos décadas. La seguridad y eficacia de la sedación con dexmedetomidina como alternativa al propofol para este tipo de procedimiento sigue siendo objeto de ensayos clínicos (8).
Las crisis convulsivas preoperatorias, se observan en el 70% de los casos sometidos a craneotomía con paciente despierto, 68% de los cuales se encuentra en tratamiento preoperatorio con medicación antiepiléptica. Aquellas inducidas por estimulación, ocurren entre el 2,2% – 21,5% de los casos independientemente de la intensidad de corriente utilizada y son rápidamente abortadas mediante solución de ringer lactato helado. La administración preoperatoria de medicación antiepiléptica y el grado tumoral, no tienen injerencia en la ocurrencia de las crisis inducidas por estimulación. Los antecedentes de crisis convulsivas y la localización tumoral, se asocian a las crisis inducidas por estimulación. Actualmente, se utiliza la estrategia de irrigar solución helada al mismo tiempo que se realiza la estimulación, particularmente, en aquellas áreas infiltradas por tumor (3).
Conclusiones
La craneotomía en paciente despierto es un procedimiento factible de realizar en países con escasos recursos y con resultados prometedores.
Los resultados a nivel global muestran que la cirugía puede llevarse a cabo en forma segura y con una baja incidencia de complicaciones y fallas técnicas.
La identificación y rápido tratamiento de las convulsiones inducidas por estimulación, mediante irrigación de solución helada, es crucial para finalizar exitosamente la cirugía
La mayoría de los investigadores y estudios coinciden en que la craneotomía en paciente despierto es el mejor enfoque disponible actualmente para optimizar el equilibrio oncofuncional en esta población de pacientes difícil de tratar (9).
Una selección adecuada de los pacientes y un excelente trabajo del equipo multidisciplinar se asocian con altos niveles de éxito de la intervención y de satisfacción de los pacientes (10).
Bibliografía
1) McGirt J, Chaichana L, Attenello FJ, Weingart JD, Than , Burger PC, et al. Extent of surgical resection is independently associated with survival in patients with hemispheric infiltrating low-grade gliomas. Neurosurgery. 2008; 63(4): 700-7. doi: 10.1227/01.NEU.0000325729.41085.73. (PubMed)
2) Duffau , Capelle , Denvil D, Sichez N, Gatignol , Taillandier , et al. Usefulness of intraoperative electrical subcortical mapping during surgery for low-grade gliomas located within eloquent brain regions: functional results in a consecutive series of 103 patients. 2003. 2003; 98(4): 764–778. doi: 10.3171/jns.2003.98.4.0764. (PubMed)
3) Hervey-Jumper S, Li , Lau , Molinaro , Perry , Meng , et al. Awake craniotomy to maximize glioma resection: methods and technical nuances over a 27-year period. J Neurosurg. 2015; 123 (2): 325-39. doi: 10.3171/2014.10.JNS141520. (PubMed)
4) Chang SM, Parney IF, Huang W, Anderson FA Jr , Asher AL, Bernstein M, et al. Patterns of care for adults with newly diagnosed malignant glioma. JAMA. 2005; 293(5):557-564. doi: 10.1001/jama.293.5.557. (HTML)
5) Amiri HR, Kouhnavard M, Safari S. Scalp block for awake craniotomy in a patient with a frontal bone mass: a case report. Anesth Pain Med. 2012; 1(3): 187–190. doi: 10.5812/kowsar.22287523.3608 (HTML)
6) Grabert J, Klaschik S, Güresir A, Jakobs S, Soehle M, Vatter H, et al. Supraglottic devices for airway management in awake craniotomy. Medicine (Baltimore). 2019; 98(40): e17473. doi: 10.1097/MD.0000000000017473 (PubMed)
7) Stevanovic A, Rossaint R, Veldeman M, Bilotta F, Coburn M. Anaesthesia Management for Awake Craniotomy: Systematic Review and Meta-Analysis. PLoS One. 2016; 11(5):e0156448. doi: 10.1371/journal.pone.0156448. (PubMed)
8) Kulikov A, Lubnin A. Anesthesia for awake craniotomy. Curr Opin Anaesthesiol. 2018; 31(5):506-510. doi: 10.1097/ACO.0000000000000625. (PubMed)
9) Foster CH, Morone PJ, Cohen-Gadol A. Awake craniotomy in glioma surgery: is it necessary? J Neurosurg Sci. 2019; 63(2):162-178. doi: 10.23736/S0390-5616.18.04590-3. (PubMed)
10) Sewell D, Smith M. Awake craniotomy: anesthetic considerations based on outcome evidence. Curr Opin Anaesthesiol. 2019; 32(5):546-552. doi: 10.1097/ACO.0000000000000750. (PubMed)