 Marta Fernández Hernández*, Daniel Bouzas Pérez**, Sergio Maldonado Vega*, Carceller Malo J M*
Marta Fernández Hernández*, Daniel Bouzas Pérez**, Sergio Maldonado Vega*, Carceller Malo J M*
*Hospital Universitario Marqués de Valdecilla, Santander, Cantabria (España)
** Hospital de Laredo, Cantabria (España)
Resumen
El dolor es una sensación desagradable producida bien por la exposición del organismo a estímulos nocivos capaces de producir daño tisular, o bien por lesión del sistema nervioso central. Afecta hoy en día a un porcentaje importante de la población, siendo a veces muy complicado de manejar y constituyendo frecuentemente causa de interconsulta a especialistas en su tratamiento.
El objetivo de esta guía es dar unas pautas de manejo farmacológico del dolor mediante la exposición de cada grupo farmacológico (AINES, antiepilépticos, antidepresivos, opioides, ….) que se emplea a este efecto así como sus indicaciones, guiadas por la escalera-ascensor terapéutico del dolor de la OMS. Así mismo se indicarán los principales efectos secundarios y su tratamiento, así como los contraindicaciones absolutas y relativas de cada grupo farmacológico.
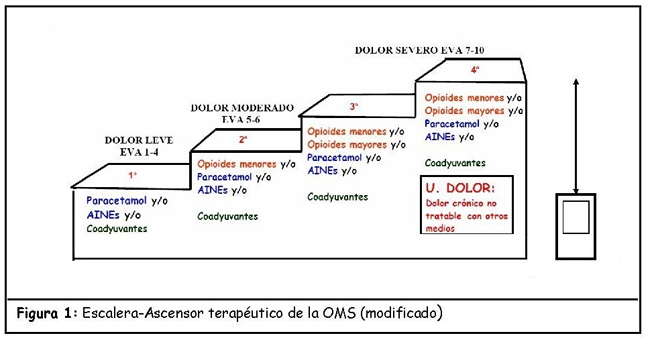
ESCALERA-ASCENSOR ANALGÉSICO DE LA OMS
La escalera analgésica(2) (Figura 1) es una estrategia terapéutica (diseñada principalmente para manejo de dolor crónico) en la que, dependiendo de la intensidad del dolor, se pasa de un escalón a otro. El objetivo de la OMS al crearla era:
– Reconocimiento precoz de los síntomas.
– Aportar unas escalas de valoración.
– La reevaluación periódica de los síntomas.
– Dar una pauta analgésica en función de la intensidad del dolor
- 1er escalón: dolor leve-moderado. AINES, AAP (Analgésicos antipiréticos).
- 2º escalón: dolor moderado-intenso. Opioides menores +/- AINES- AAP.
- 3er escalón: dolor intenso. Opioides mayores +/- AINES-AAP.
– Administración a intervalos fijos de la medicación.
– Prescribir analgesia de rescate:
- Dolor leve- moderado: Opioides menores o mayores.
- Dolor moderado-severo: Opioides mayores.
– Prevenir efectos secundarios.
El ascensor terapéutico(3) es una táctica basada en la escalera analgésica, que implica empezar el tratamiento por el escalón que más se adecue al tratamiento del dolor en función de la intensidad del mismo: comenzar por el 2º o 3º escalón en la fase de mayor dolor, abandonándolos paulatinamente y dejando otros analgésicos menos potentes a medida que el dolor disminuya.
Tipos de Dolor
– Según su cronología
– Dolor agudo: el causado por estímulos debido a lesiones, enfermedad o función anormal de músculos o vísceras. Carácter transitorio. Casi siempre es nociceptivo. Ejemplos: postraumático, postoperatorio, obstétrico, IAM, pancreatitis…
– Dolor crónico: el que persiste más allá de lo normal para una enfermedad aguda o después del tiempo razonable de curación. Carácter permanente, recurrente. Nociceptivo y/o neuropático. Ejemplos: neuropatía diabética, neuralgia del trigémino…
- Según su patogenia:
– Neuropático: producido por estímulo directo del sistema nervioso central o por lesión de vías nerviosas periféricas. Descrito como: punzante, quemante, acompañado de parestesias y disestesias, hiperalgesia, hiperestesia y alodinia.
– Nocioceptivo: es el más frecuente y se divide en somático y visceral.
– Psicógeno: Interviene el ambiente psico-social que rodea al individuo, es típico el aumento de las dosis de analgésicos con escasa eficacia.
- Según la localización:
– Somático: procedente de zonas superficiales o profundos (piel, musculoesquelético, vasos, metástasis óseas, etc). Es un dolor localizado, punzante y que se irradia siguiendo trayectos nerviosos. Responde bien a AINES.
– Visceral: debido a enfermedad o función anormal de un órgano. Mal localizado; sordo, continuo, puede irradiarse. IAM, cólico, pancreatitis. Responde a opioides.
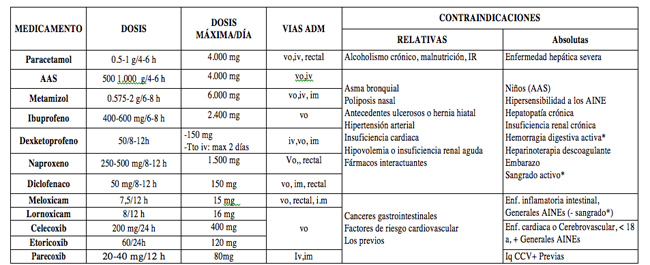
PARACETAMOL y AINEs
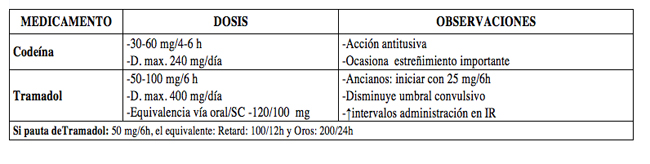
- Dosis y contraindicaciones: (Tabla 1)
- Rescates: Con opioides menores:
- Si precisa más de 2-3 rescates en 24 h: pautar opioide menor con dosis de inicio y dejar de rescate dosis equivalente (ej: Tramadol 50 mg/8h, rescate Tramadol 50 mg/6-8h si dolor),
- Si precisa aumentar pauta de opioide menor hasta dosis techo: pasar a siguiente escalón.
- Reacciones adversas: No exentos de riesgos graves. Reacciones gastrointestinales: Prevención en pacientes de riesgo (mayores de 60, antecedentes de ulcus, coexistencia con corticoides, anticoagulantes o enfermedad grave) y tratamiento con: omeprazol 20 mg/24 h vo (40 mg ev) o misoprostol 800 μg/24 h. (no en mujeres fértiles).
OPIOIDES MENORES
- Dosis y contraindicaciones: (Tabla 2)
- Rescates:
- Si opioide menor a dosis inicio: aumentar dosis pautada y dejar rescates hasta dosis techo.
- Si opioide menor a dosis techo rescates con Opioides mayoresí si más de 2-3 rescates/24 h: pasar a siguiente escalón.
- Interacciones:
- TRAMADOL:
-
- Sd serotoninérgico con: IMAO, ISRS, triptanes, linezolid;
- Aumentan su efecto: depresores centrales, inhibidores de CYP3A4 o CYP2D6, cimetidina,;
- Disminuyen su efecto: ondasetron, carbamazepina, agonistas/antagonistas opiáceos (ej. buprenorfina, nalbufina, pentazocina), naltrexona.
- Disminuye el umbral convulsiva asociado con: ISRS, antidepresivos tricíclicos, antipsicóticos, neurolépticos, mefloquina, bupropión. †‘INR.
- CODEINA: Aumento de excitabilidad con: IMAO, antidepresivos tricíclicos.
OPIOIDES MAYORES(10,11,13-30)
- Dosis y contraindicaciones (Tabla 3)
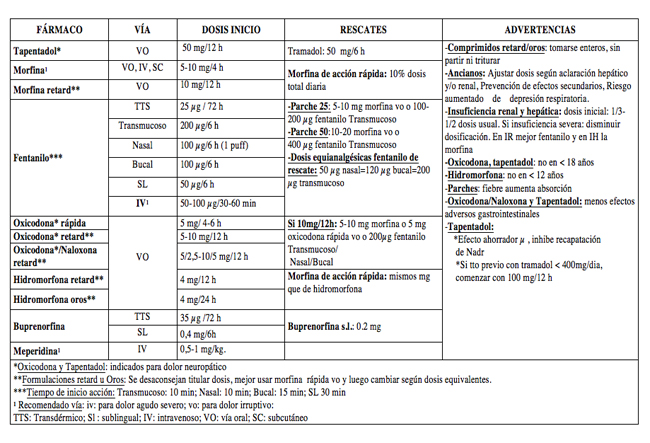
- Rescate: Opioides mayores, si precisa más de 2-3 rescates/24 h: aumentar dosis de opioide mayor pautado en un 30-50%
- Interacciones: Alcohol, antidepresivos tricíclicos, IMAO, hipnóticos, Betabloqueantes, Fenotiazinas, fármacos metabolizados por:CYP3AY/2D6 o CYP450
- Rotación opioide:
- ¿Cuándo?
-
- Efectos secundarios severos que no responden a tratamiento
- Hiperalgesia
- Tolerancia
- Mal control del dolor o dolor refractario.
- Aparición de toxicidad: Neurotoxicidad,….
- Insuficiencia renal.
- Dosis elevadas de opioide que hacen difícil o impracticable su administración
- ¿Cómo?
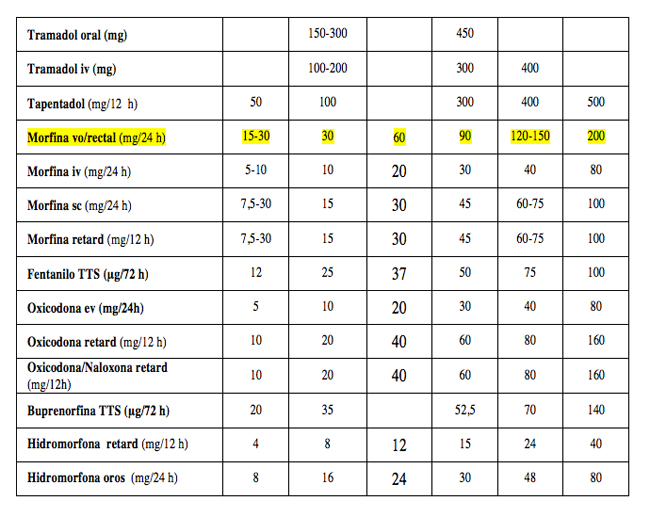
1º. Usando dosis equianalgésicas (Tabla 4): calcular la dosis diaria del opioide que está tomando el paciente.
2º. Calcular la dosis total diaria del nuevo opioide según dosis equianalgésicas.
3º. Reducir del 30-50% de la dosis equianalgésica resultante para evitar la tolerancia cruzada:
- Ancianos, enfermedad hepática o renal: reducir más la dosis.
- En dolor intenso: considerar menor reducción de la dosis.
4º. Dosis de rescate del nuevo opioide 1/6 de la dosis total.
5º. Reevaluar al paciente con frecuencia.
6º. Según opioide elegido:
- Cambio a parche: con el primer parche se administrará la última dosis de opioide retardado.
- Retirar parche: hincar nuevo opioide las 24 h posteriores a la retirada
Dosis equianalgésicas: (Tabla 4)
- Reacciones adversas:
– Estreñimiento: pautar siempre laxantes al inicio del tratamiento con opioides. Combinar docusato sódico (hasta 500 mg/24 h. vo) con bisacodilo (5-10 mg vo o rectal) o fenolftaleína (30-200 mg/24 h vo). Si es necesario añadir un laxante osmótico como lactulosa 5-10 g al día, incluso enemas de limpieza. En casos rebeldes se puede usar METILNALTREXONA 0,15 mg/kg s.c. cada 48h.
– Náuseas y vómitos: siempre pautar profilaxis antiemética al iniciar tratamiento con opioide, aunque se desarrolla tolerancia con relativa rapidez. Si predomina la gastroparesia metoclopramida 10 mg vo/8 h. Si predomina el componente vertiginoso hidroxicina 25-50 mg/8h. Otros antieméticos: domperidona (10 mg/8h.), haloperidol (5 mg sc), dexametasona (10-20 mg ev al día), ondansetrón (8 mg/8 h vo.).
– Reacciones delirantes (atribuibles a opiáceos): Haloperidol, inicio con 0,5 mg /8 h.
– Depresión respiratoria: Naloxona, administrar una dosis entre 0,1 y 2 mg según respuesta.
– Prurito: empíricamente puede utilizarse clorfeniramina 4 mg/12-8 h., en casos severos: naloxona a dosis bajas.
– Somnolencia: disminuir dosis.
COADYUVANTES (10,31,32)
Usados primariamente para otros fines, actúan como analgésicos frente a algunos tipos de dolor resistentes a fármacos convencionales. Precisan aumentos de dosis paulatinos y su retirada debe hacerse igual (no suspender bruscamente). Tiempo para ver los efectos: más de 15 a 30 días.
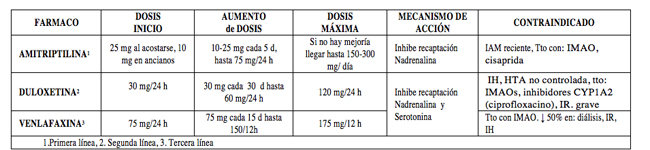
- Antidepresivos(35-40) (Tabla 5): indicados en dolor neuropático, de elección en: neuralgia postherpética, neuropatía diabética o dolor por isquemia vascular).
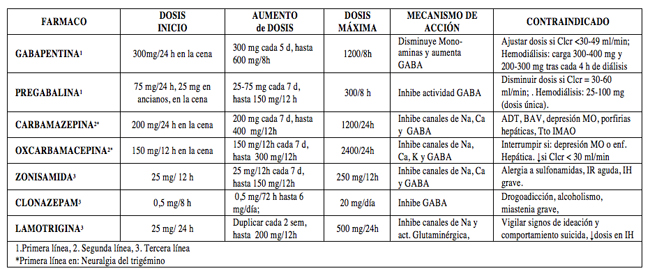
- Anticonvulsivantes(41-45) (Tabla 6): indicados en dolor neuropático con predominio del componente lancinante y paroxístico.
- Corticoesteroides(46,47):
- Vía oral: Indicados en dolores cuya causa determinante sea un proceso inflamatorio, y siempre en tandas cortas de tratamiento para evitar la inhibición del eje hipotálamo-hipofisario-suprarrenal. Prednisona, metilprednisolona, triamcinolona, dexametasona.
- Infiltraciones: uso de preparados depot (ej: acetónido Triamcinolona) para bloqueos periféricos o infiltraciones epidurales/caudales/transforaminales/rizolisis,….
- Anestésicos locales(48,49):
-
- Lidocaína:
- VíA ENDOVENOSA: de 1 a 5 mg/kg en 1 hora, o en bolo de 1,5mg/kg en un minuto, pueden ser útiles en situaciones AGUDAS de dolor neuropático (neuralgias diversas, esclerosis múltiple,…).
- PARCHES: durante 12 horas al día cubriendo zona afecta (no usar más de 3 parches), no se pueden mojar. En: neuralgia postherpética, trigeminal, distrofia simpáticorrefleja y dolor neuropático en pacientes oncológicos
- Mexiletina: Vía oral, dosis inicial:150-200 mg al día, hasta 1200 mg/24 h, en 3-4 tomas. Eficaz para dolor crónico en neuropatía diabética, postinfarto cerebral, esclerosis múltiple, miembro fantasma,….No usar si Bloqueo AV.
- Ropivacaina/Levo-bupivacaina: usadas en infiltraciones junto a corticoide depot.
- Baclofeno:Tratamiento de la espasticidad de origen central. Dosis de inicio: 5 mg/12 h, hasta 30-100 mg/día.
- Capsaicina(50): en neuralgia postherpética, trigeminal, distrofia simpáticorrefleja y dolor neuropático en pacientes oncológicos
- POMADA 0,0075%: Vía tópica, 3 o 4 veces al día,
- PARCHES 8%: de 30-60 minutos cada 3 meses, aplicar por personal cualificado
- Reacciones adversas: lo más indicado es suspender fármaco e introducir otro coadyuvante
- Antidepresivos: boca seca, estreñimiento, retención urinaria, íleo paralítico, sedación, temblor, hipotensión, palpitaciones, taquicardia.
- Antiepilépticos: náuseas y vómitos, sedación, ataxia, confusión, Toxicidad medular.
- Baclofeno: Sopor/somnolencia, mareos, cefaleas, náusea, hipotensión, hipotonía
- Parches y pomadas: irritación local
Bibliografía
- Ortega J L, Neira F. Guías de Práctica Clínica en el Tratamiento del Dolor. Una herramienta en la práctica clínica. Rev Soc Esp Dolor 2008; 6: 399-413. (PubMed)
- World Health Organization . Cancer Pain Relief (2nd edition) Geneva, Switzerland. World Health Organization, 1996. (PubMed)
- Torres L M, Calderón e, Pernia A, Martínez-Vázquez J, Micó J A. De la escalera al ascensor. Rev Soc Esp Dolor 2002; 9: 289-290. (PubMed)
- F. Puebla Díaz. Tipos de dolor y escala terapéutica de la O.M.S. Dolor iatrogénico. Oncología, 2005; 28 (3): 139-143. (PubMed)
- McNicol E, Strassels SA, Goudas L, Lau J, Carr DB . NSAIDS or paracetamol, alone or combined with opioids, for cancer pain . (Review). The Cochrane Database Syst Rev. 2005 Jan 25; (1): CD005180. (PubMed)
- Gené E, Calvetr X, Morón A, Iglesias M L . Recomendaciones en la prescripción de antiinflamatorios e indicaciones de gastroprotección en urgencias. Emergencias 2009; 21: 295-300. (PubMed)
- E Loza. AINEs en la práctica clínica: lo que hay que saber. Inf Ter Sist Nac Salud 2011; 35: 88-95. (PubMed)
- Kearney PM, Baigent C, Godwin J, et al. Do selective cyclo-oxygenase inhibitors and traditional non-steroidal anti-inflammatory drugs increase the risk of atherothrombosis? Meta-analysis of randomised trials. British Medical Journal 2006; 332: 1302““05. (PubMed)
- Seoane de Lucas A, Franco M L. Características del dolor crónico en el anciano: tratamiento. Rev Soc Esp Dolor 2001; 8(1): 29 ““ 38. (PubMed)
- Nadine Attal. Neuropathic Pain.: Mechanisms, Therapeutic Approach, and Interpretation of Clinical Trials. Continuum Lifelong Learning Neurol 2012; 18(1): 161““175. (PubMed)
- Smith H S. The Metabolism of Opioid Agents and the Clinical Impact of Their Active Metabolites. Clin J Pain 2011; 27: 824““838. (PubMed)
- Barkin R L. Pharmacodynamic Focus on Effectiveness and Safety in Patients with Chronic/Persistent Pain. American Journal of Therapeutics 2008: 15(2): 157-166. (PubMed)
- Hartrick C T, Rodríguez J R. Tapentadol for pain: a treatment evaluation. Expert Opinion on Pharmacotherapy 2012; 13 (2 ): 283-286. (PubMed)
- Torres L M. Tapentadol retard en el dolor crónico intenso. Rev Soc Esp Dolor 2011; 18(5): 283““290. (PubMed)
- Eisenberg E, McNicol ED, Carr DB. Efficacy of mu-opioid agonists in the treatment of evoked neuropathic pain: Systematic review of randomized controlled trials. Eur J Pain. 2006: 10(8): 667-76. (PubMed)
- Sánchez-Montero F, Yusta G, García-Castaño M, Muriel C. Citrato de fentanilo transmucosa oral (OTFC): Rev Soc Esp Dolor 2000; 7 (5): 319 ““ 326. (PubMed)
- Sanz J. Oxicodona. Rev Soc Esp Dolor 2005; 12(8): 525 ““ 531. (PubMed)
- Mercadante S. Prospects and challenges in opioid analgesia for pain management. Curr Med Res Opin. 2011; 27 (9): 1741-3. (PubMed)
- E. Rionda, M.G. Rivera, C.P. Canseco, J.C. Torres, S. Tenopala, A. Díaz-Coto, M.A. Quintero, G. Bequer, L.C. Castillo, M. Golzarri y J.R. Hernández-Santos. Dosis efectiva de hidromorfona en pacientes con dolor crónico oncológico: experiencia de 4 años en el Centro Médico Nacional «20 de Noviembre» ISSSTE. Rev. Soc Esp Dolor 2009: 16 (5): 270-274. (PubMed)
- Sabatowski R, et al. Pharmacotherapy of chronic, non-tumour related pain. Efficacy, tolerability and patient benefit of an oral osmotic system with hydromorphone. MMW Fortschr Med. 2007; 149 Suppl 3: 119-24. (PubMed)
- Mercadante S, Bruera E. Opioid switching: A systematic and critical review. Cancer treat Rev 2006; 32: 304-315. (PubMed)
- Pergolizzi J, Bí¶ger R H, Budd K, Dahan A, Erdine S, Hans G, Kress H G, Langford R, Likar R, Raffa R B, Sacerdote P. Opioids and the management of chronic severe pain in the elderly: consensus statement of an International Expert Panel with focus on the six clinically most often used World Health Organization Step III opioids (buprenorphine, fentanyl, hydromorphone, methadone, morphine, oxycodone). Pain Pract. 2008; 8 (4): 287-313. (PubMed)
- Ramsin B, Trescot A M, Datta S, Buenaventura R, Adlaka R, Sehgal N, Glaser S E, Vallejo R. Opioid Complications and Side Effects. Pain Physician 2008; 11: S105-S120. (PubMed)
- Rodríguez J L, Mencías A B. Consideraciones sobre el empleo de opioides en el dolor crónico del paciente geriátrico. Rev Soc Esp Dolor 2008; 15 (7) :463-474. (PubMed)
- R.A. Cruciani. Efectos secundarios asociados al uso de opioides: estreñimiento. Rev Soc Esp Dolor. 2009;16(Espec Cong):7-9. (PubMed)
- Lancaster T, Silagy C, Gray S. Primary care management of acute herpes zoster: systematic review of evidence from randomised controlled trials. Br J Gen Pract 1995; 45:39-45. (PubMed)
- Power I . An update on analgesics. Br J Anaesth. 2011; 107 (1): 19-24. (PubMed)
- Zeppetella G.Opioids for the management of breakthrough cancer pain in adults: A systematic review undertaken as part of an EPCRC opioid guidelines project . Palliat Med 2011; 25: 516-524. (PubMed)
- Samper D. Tratamiento del dolor irruptivo espontáneo. Rev Soc Esp Dolor. 2009; 16 (Espec Cong):1-3. (PubMed)
- Mercadante S, Caraceni A. Conversion ratios for opioid switching in the treatment of cancer pain: a systematic review. Palliat Med. 2011; 25 (5): 504-15. (PubMed)
- O“™Connor A B, Dworkin R H. Evidence-based treatment of chronic neuropathic pain using nonopioid pharmacotherapy. Continuum Lifelong Learning Neurol 2009; 15 (5): 70-83. (PubMed)
- Attal N, Neuropathic Pain.: Mechanisms, Therapeutic Approach, and Interpretation of Clinical Trials. Continuum Lifelong Learning Neurol 2012 ; 18 (1) : 161““175. (PubMed)
- Volmink J, Lancaster T, Gray S, Silagy C. Treatments for postherpetic neuralgia: A systematic review of randomized controlled trials. Family Practice. 1996; 13: 84-91. (PubMed)
- Soler Pedrola M, Homs Riera M, Monerris Tabasco M M, Samper Bernal D. Etiología y manejo de la neuropatía diabética dolorosa. Rev Soc Esp Dolor 2010; 17 (6) :286 – 296-5. (PubMed)
- McQuay H J, Tramer M, Nye B A, Carroll D, Wiffen P J, Moore R A. A systematic review of antidepressants in neuropathic pain. Pain. 1996; 68 (2-3): 217-227. (PubMed)
- Saarto T, Wiffen PJ. Antidepressants for neuropathic pain: a Cochrane review. J Neurol Neurosurg Psychiatry. 2010; 81 (12): 1372-3. (PubMed)
- Sultan A, Gaskell H, Derry S, Moore RA. Duloxetine for painful diabetic neuropathy and fibromyalgia pain: systematic review of randomised trials. BMC Neurology 2008; 8: 29-37. (PubMed)
- Coluzzi F, Mattia C. Mechanism-based treatment in chronic neuropathic pain: the role of antidepressants. Curr Pharm Des 2005; 11: 2945-60. (PubMed)
- Micó JA, Ardid D, Berrocoso E, Eschalier A. Antidepressants and pain.Trends Pharmacol Sci 2006; 27: 348-354. (PubMed)
- Bellingham G A, Peng P W H. Duloxetine: A Review of its Pharmacology and Use in Chronic Pain Management. Regional Anesthesia & Pain Medicine 2012; 35 (3): 294-303. (PubMed) (pdf)
- McQuay H, Carroll D, Jadad A R, Wiffen P, Moore A. Anticonvulsant drugs for management of pain: a systematic review. BMJ. 1995; 311 (7012): 1047-52. (PubMed)
- Moore RA, Straube S, Wiffen PJ, Derry S, McQuay HJ. et al. Pregabalin for acute and chronic pain in adults. Cochrane Database Syst Rev. 2009 Jul 8;(3): CD007076. (PubMed)
- McQuay H, Carroll D, Jadad A R, Wiffen P, Moore A. Anticonvulsant drugs for management of pain: a systematic review. BMJ. 1995; 311(7012): 1047-52. (PubMed)
- Wiffen PJ, Derry S, Moore RA, McQuay HJ. Carbamazepine for acute and chronic pain in adults. Cochrane Database of Systematic Reviews. Cochrane Database Syst Rev. 2011 19; (1): CD005451. Review. (PubMed)
- Robaina F. Neuralgia del Trigémino. Revisión del tratamiento médico y quirúrgico. Rev Soc Esp Dolor 2008; 15 (4): 248-256. (PubMed)
- Ortega JL, Neira F. Revisión del tratamiento con corticoides en el dolor de espalda según la medicina basada en la evidencia. Rev Soc Esp Dolor 2009; 16(6): 352 ““ 369. (PubMed)
- Chou R, Loeser JD, Owens DK, Rosenquist RW, Atlas SJ, Baisden J, et al. Interventional therapies, surgery, and interdisciplinary rehabilitation for low back pain: an evidence-based clinical practice guideline from the American Pain Society. Spine 2009;34 (10):1066-77. (PubMed)
- Khaliq W, Alam S, Puri N. Topical lidocaine for the treatment of postherpetic neuralgia (Review). The Cochrane Library. 2007: 18; (2): CD004846. Review. (PubMed)
- Cuartero J, Pérez-Alfranca C, Lafuente F, Martínez-Ubieto J, Girón J A, Longás J. Lidocaína endovenosa como coadyuvante en el tratamiento inicial de la neuralgia postherpética. Bases fisiopatológicas del uso de anestésicos locales en el tratamiento del dolor neuropático. Rev Soc Esp Dolor 2005; 12(8): 485 ““ 490. (PubMed)
- Torres L M, Pérez-Bustamante F, Román D,Calderón E, Vidal M A . Capsaicina tópica en el tratamiento del dolor neuropático. Rev Soc Esp Dolor 2004; 11(5): 306 ““ 318. (PubMed)




El tapentadol tiene una dosis de inicio de 25 mgrs cada 12 horas que, en general, es más tolerada por pacientes NAIVE. Muy buen resumen.
Alguna puntualizacion a esta interesante Guia Básica:
– No queda clara la diferencia entre el 3º y 4º escalones que no debe de estar basado tanto en la intensidad del dolor (EVA) sino en las necesidades y tolerancia al mismo con los diferentes fármacos. Actualmente se considera el 3º escalon añadiendo opiaceos mayores y el 4º quedaria relegado para los procedimientos especificos como bloqueos, radioterapia, etc.
– La Metadona tambien es un opiaceo mayor con efecto agonista y antagonista de receptores NMDA. Aunque su equivalencia con los otros opiaceos es variable y hay que utilizarla con precaución (por su vida media larga y efecto acumulativo), es un analgesico muy eficaz en paciente que han sido o son adictos a drogas, así como una alternativa en en el tratamiento del dolor neuropático.
– Me gustariá incidir en la importancia que tiene ( y su comodidad) la vía subcutánea para la aplicación de morfina (y otros fármacos). Se trata de una vía de administración validada desde hace años y que curiosamente es muy poco utilizada, salvo en Cuidados Paliativos. Permite infusiones de diferentes medicamentos de forma continua utilizando catéteres finos e infusores de 24-72-120 horas. En el tema de la analgesia, la administración de morfina por vía subcutánea es rápida (aproximadamente 1 minuto comienza su efecto) y segura (sin necesidad de dilucción y en bolo). Cuando se prevea necesidad de dosis repetidas de morfina (o infusión contínua), se puede utilizar un catéter flexible subcutáneo para evitar diferentes pinchazos.
Gracias por esta información.
Es una buena revisión, claro está que lo debemos complementar con muchos Tips como ejem. Los mencionados en los comentarios.
Gracias por la revisión
El de las drogas es un tema batatnse conocido por todos en la sociedad de hoy en deda, a diferencia de hace 20 af1os, cuando eran algo novedoso del que se sabeda poco.Creo que poco puedo af1adir sobre su peligrosidad porque cada tipo de droga tiene un sinfin de efectos nagativos, como bien se puede leer en los enlaces. Para mi lo me1s preocupante es que cada vez son me1s los adolescentes que caen en ellas. Este hecho no es por falta de informacif3n, ya que considero que es suficiente, pero algo se este1 haciendo mal para que pese a tener conciencia de lo que son, los me1s jf3venes caigan en ellas.Los primeros que deberedan tomar medidas son los padres, dando una correcta educacif3n antidrogas, protegiendo a sus hijos de entornos poco favorables y controlando comportamientos extraf1os.Para concienciar a los me1s jf3venes pienso que no es suficiente con ennumerar todos los efectos nocivos de una substancia. Ayuda mucho poner ejemplos de estas consecuencias.Un caso claro y que a mi siempre me ha llamado mucho la atencif3n es el de la gran cantidad de gente relacionada con el mundo de la mfasica que ha fallecido a causa de las drogas, siendo especialmente tre1gicas las de9cadas de los 80 y de los 90. Kurt Cobain (ledder de Nirvana), el rey del rock Elvis Presley, Jim Morrison (The Doors), Jimi Hendrix o me1s recientemente divas como Amy Winehouse o Whitney Houston engruesan esta larga lista negra.Al igual que el abpapelbb que tuvo en el mundo de la mfasica, especialmente en el rock, me llamf3 mucho la atencif3n un caso relacionado con el ffatbol. El protagonista fue Diego Armando Maradona abEl Pelusabb, considerado un Dios por la hinchada argentina y para muchos el mejor jugador de la historia.Maradona, tras su exitosa carrera tuvo que dejar el ffatbol en 1994 por dar positivo en un control antidopaje e incluso reconocif3 haber consumido cocaina. Para mi es una claro ejemplo de como una persona que lo tiene todo (buen futbolista, dinero,fama, ) lo puede echar a perder por culpa de la DROGA.Estos son varios casos que nos dan una idea de como la droga puede cambiar la vida de una persona (si no la mata) y la de las personas que la rodean.Un consejo que dareda a la gente que se este1 abiniciandobb en las drogas es que no sigan el camino que tanta gente a recorrido con un mismo final: la muerte.